当归Angelica sinensis (Oliv.) Diels是我国传统常用中药,味甘、辛,性温,归肝、心、脾经;具有补血活血、调经止痛、润肠通便等功效[1]。近年来由于当归引种区域扩大,栽培面积和产量持续增加以及全球气候变化等自然和人为因素的影响,当归药材品质面临着巨大挑战,开展品质形成相关功能基因及机制研究成为当归栽培学和育种学的新热点[2]。阿魏酸(ferulic acid,FA)是当归的有效成分之一,常作为药材质量的控制指标[1]。FA是一种植物来源的酚酸,在细胞壁中与多糖和蛋白质结合成为细胞壁的骨架[3]。FA具有广泛的药理学作用,如抗肿瘤、抗氧化、解毒、保肝等,是一种多靶点的抗肿瘤天然药物,且性质稳定、毒性低[3, 4, 5, 6]。在高等植物体内,FA是木质素生物合成过程的重要中间代谢产物之一,其生物合成涉及到许多酶的参与。咖啡酸-O-甲基转移酶(caffeic acid O-methyltransferases,COMT)是木质素合成途径中的1个关键甲基化酶,其催化咖啡酸、5-羟基松柏醇和5-羟基松柏醛甲基化分别生成阿魏酸、芥子醇和芥子醛,参与S-木质素的合成[7]。目前,COMT基因已在银合欢Leucaena leucocephala (Lam.) de Wit [8]、丹参Salvia miltiorrhiz Bunge [9]、唐松草Thalictrum tuberosum L.[10]、忽地笑Lycoris aurea Herb.[11]等药用植物中被克隆,并且对调控木质素及其他苯丙酸途径衍生物合成的分子机制进行了研究,但关于当归中COMT基因克隆和序列分析的研究未见报道。本研究成功克隆了当归COMT基因的cDNA全长序列,并对其编码蛋白质进行了生物信息学分析,可为当归COMT基因功能研究和当归阿魏酸生物合成与调控的机制研究提供基础。
1 材料实验用当归植株采自于甘肃岷县茶埠镇实验基地(海拔2 780 m,东经104°06′,北纬34°29′),经甘肃中医药大学王引权教授鉴定为伞形科当归属植物当归Angelica sinensis (Oliv.) Diels。田间采集当归全株,置于装有干冰的保温箱,于当天带至实验室后迅速用去离子水冲洗干净,将叶片分离后用液氮迅速冷冻,转移至−80℃超低温冰箱,用于总RNA提取材料。实验用大肠杆菌菌株Escherichia coli DH5α由本实验室保藏。
PCR扩增仪(Bio-Rad icycler IQ,美国),超微量分光光度计(Thermo BioMate 3,美国),高速冷冻离心机(Eppendorf 5427 R,德国),生物安全柜(HFsafe-1200 B2,上海),电泳系统(DYY-5,北京)。所用分子生物学试剂主要包括:SMARTerTM RACE cDNA扩增试剂盒(Clontech,北京)、Advantage®2 PCR试剂盒(Clontech,北京)、cDNA合成试剂盒(TaKaRa,大连)、RNA提取用试剂十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮360和LiCl均购自于美国Sigma公司,Taq DNA Polymerase(TaKaRa,大连)、PCR产物克隆试剂盒(Promega,美国)、PCR产物回收试剂盒(TransGen,北京),DNA Marker(TransGen,北京),其他生化试剂均为进口或国产分析纯产品。
2 方法 2.1 RNA提取与cDNA合成当归叶组织总RNA的提取参照文献中报道的CTAB法[12]进行,并略作修改[13]。总RNA的完整性采用非变性琼脂糖凝胶电泳检测,总RNA的纯度使用分光光度计测定,A260/A280值在1.8~2.0,说明RNA无污染。以约100 ng总RNA作为模板,利用RNA反转录试剂盒合成总cDNA。
2.2 COMT保守序列克隆通过对GenBank中注册的中国辣椒Capsicum chinense L.(AF081214)、柳枝稷Panicum virgatum L.(HQ645965)、美国枫香Liquidambar styraciflua L.(AF139533)、拟南芥Arabidopsis thaliana (L.) Heynh.(NM_124796)、挪威云杉Picea abies (L.) H. Karst.(AJ868575)、山字草Clarkia breweri Greene(AF006009)等植物COMT基因的CDS序列进行同源比对,以高度保守区段序列为模板,利用Primer 6.0生物软件设计一对扩增引物P1和P2,见表 1。以当归叶片总cDNA为模板,扩增当归COMT保守区片段,推测目的片段长度为415 bp。PCR反应体系为50 μL,包含下列组分:10×PCR缓冲液5 μL、dNTP(2 mmol/L)1.2 μL、MgCl2(25 mmol/L)5 μL、上下游引物(10 μmol/L)1 μL、cDNA 0.5 μL、DNA 聚合酶(5 U/mL)0.5 μL和无菌去离子水35.8 μL。反应程序:95℃预变性3 min;95℃变性30 s、55℃退火30 s、72℃延伸60 s,30个循环;最后72℃延伸10 min,PCR扩增产物用1.5%琼脂糖凝胶电泳检测。目的片段回收和纯化按照DNA凝胶纯化试剂盒说明书进行。纯化回收的DNA连接至pGEM-T Easy克隆载体,CaCl2法转化E. coli DH5α,随机挑取克隆用菌落PCR验证,阳性克隆接种于含氨苄青霉素的液体LB培养基培养(37℃,150 r/min)过夜,委托生工生物工程(上海)有限公司测序。
|
|
表 1 引物名称和序列 Table 1 Names and sequences of primers |
以测序的核心片段设计一条用于5’RACE的基因特异性引物P3,一条用于3’RACE的基因特异性引物P4(表 1),P3与P4分别与SMATer® RACE试剂盒自带通用引物UPM组对分别用于5’端片段和3’端片段的扩增。5’RACE以5’RACE-ready first-strand cDNA为模板,按Advantage2 PCR kit 操作说明建立反应体系,反应条件:94℃、30 s,72℃、3 min,5个循环;94℃、30 s,70℃、30 s,72℃、3 min,5个循环;94℃、30 s,68℃、30 s,72℃、3 min,27个循环。3’RACE以3’RACE-ready first-strand cDNA为模板,依据Advantage2 PCR kit操作说明建立反应体系,反应条件:94℃、30 s,72℃、3min,5个循环;94℃、30 s,70℃、30 s,72℃、3 min,5个循环;94℃、30 s,68℃、30 s,72℃、3 min,27个循环。PCR产物的克隆和测序方法同“2.2”项。
2.4 COMT基因全长cDNA的克隆用DNAMAN对5’RACE、3’RACE所得序列和核心序列进行拼接得到cDNA全长电子拼接序列,以其为模板设计COMT基因全长cDNA扩增引物P5和P6(表 1)。以5’RACE-ready first-strand cDNA为模板,依据Advantage2 PCR kit操作说明建立扩增体系,反应条件:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸2.5 min,30个循环;72℃、10 min终止反应。PCR产物克隆及测序等过程同“2.2”项,将测序的全长序列在NCBI网站的GenBank数据库注册。
2.5 cDNA序列的生物信息学分析将测序的cDNA序列用DNAMAN 软件翻译成氨基酸序列,用DNAMAN和NCBI(National Center for Biotechnology Information,http://www.ncbi.nlm.nih.gov/)网站上的Blast N和Blast P进行核苷酸序列和氨基酸序列比对,使用ORF Finder查找开放阅读框(ORF)。生物信息学分析采用一些网上软件包进行分析,采用ExPASy在线服务器的Compute PI/Mw和ProtScale对蛋白质的理论等电点(pI)、相对分子质量及亲水性/疏水性进行分析,用SignalP 4.1 Serve进行信号肽分析,TargetP1.1 Serve分析亚细胞定位,TMHMM server v2.0进行跨膜结构分析;用在线工具SOPMA(https://www.prabi.ibcp.fr/htm/index.php)和ExPASy在线服务器的PROSITE进行二级结构预测,SWISS-MODEL(http://swissmodel.expasy.org/)进行结构域的三维同源建模;用Clustal W软件和MEGA 5.1软件构建 Neighbor-joining系统进化树。
3 结果与分析 3.1 总RNA的提取及检测非变性琼脂糖凝胶电泳结果显示,28 S rRNA和18 S rRNA凝胶条带清晰,无杂质条带(图 1),表明总RNA的完整性较好,A260/A280平均值为1.96,表明总RNA的纯度较高,适用于cDNA制备和PCR扩增。
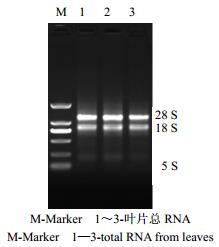 | 图 1 叶片总RNA非变性琼脂糖凝胶电泳 Fig.1 Nondenaturing agarose gel electrophoresis of total RNA from leaves |
用引物P1和P2进行COMT保守区序列的PCR扩增,非变性琼脂糖凝胶结果显示在400 bp处有1条亮带(图 2-A),与目的片段大小基本一致,推测为当归COMT片段,测序长度为375 bp。
 | 图 2 核心区 (A)、5’RACE (B)、3’RACE (C) 和全长cDNA (D) 扩增产物电泳图 Fig.2 Electrophoretogram of amplification products for conserved region (A),5’RACE (B),3’ RACE (C),and full-length cDNA (D) |
5’RACE扩增产物长度约为1 500 bp(图 2-B),3’RACE扩增产物长度约为750 bp(图 2-C),经纯化回收后转化连接至pGEM-T Easy载体,CaCl2法转化E. coli DH5α,随机选取克隆进行菌落PCR,阳性克隆委托生工生物工程(上海)有限公司测序。用DNAMAN对5’RACE、3’RACE所得序列和核心序列进行拼接得到cDNA全长电子拼接序列,以其为模板设计引物扩增COMT基因全长cDNA序列,结果显示扩增产物的长度约为1 600 bp,进一步对其进行了克隆测序。
3.4 COMT全长cDNA的生物信息学分析结果显示克隆的cDNA全长为1 436 bp,将其在GenBank注册(登录号KP188587),命名为AsCOMT。序列分析表明,cDNA序列包括5’-UTR(76 bp)和3’-UTR(362 bp),含有1个1 098 bp的ORF,编码365个氨基酸的多肽链(图 3)。氨基酸同源性比对显示AsCOMT与峨参Anthriscus sylvestris (L.) Hoffm.、大阿米芹Ammi majus L.、长春花Catharanthus roseus (L.) G. Don、野茶树Camellia sinensis (L.) Kuntze、罗勒Ocimum basilicum L. 等植物COMT的序列相似性较高,分别为94.5%、91.5%、80.8%、80.6%和80.7%(图 4)。ExPASy在线服务器的Compute PI/Mw预测蛋白质相对分子质量为40 230,pI为5.43;ProtScale蛋白亲/疏水性预测结果显示,多肽链第319位的天冬氨酸(Asp)分值最高,为2.322,第332位的精氨酸(Arg)分值最低,为−2.700,亲水性氨基酸均匀分布于整个多肽链且略多于疏水性氨基酸,整体看来多肽链表现为亲水性,无明显的疏水区域,可认为AsCOMT为亲水性蛋白(图 5);TMHMM server v2.0预测AsCOMT跨膜区,结果显示无跨膜区。SignalP 4.1 Serve分析结果显示C值为0.118,S值为0.124,Y值为0.291,得分均较低,表明AsCOMT无信号肽(图 6);TargetP1.1 Serve亚细胞定位分析结果显示,AsCOMT无叶绿体转运肽和线粒体转运肽。
 | 图 3 AsCOMT 的核苷酸序列及推测的氨基酸序列 Fig.3 Nucleic acid sequence and deduced amino acid sequence of AsCOMT |
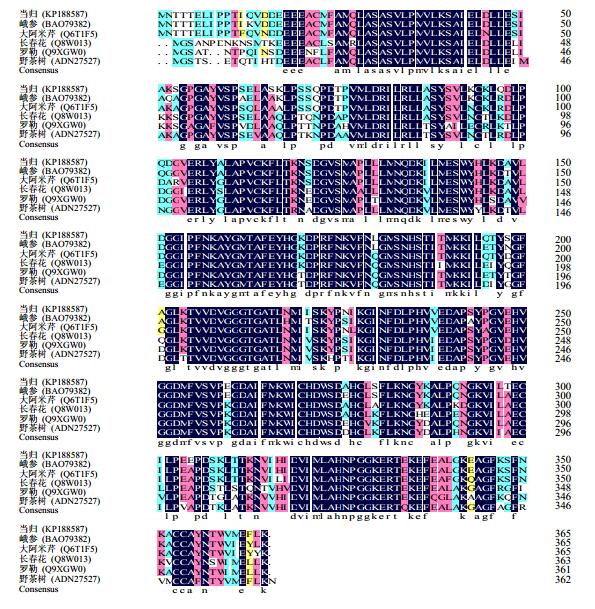 | 图 4 AsCOMT 与部分植物 COMT 氨基酸序列相似性多重比较 Fig.4 Multiple comparison on amino acid sequence between AsCOMT and COMTs of other plant species |
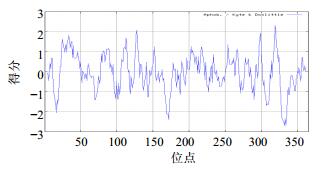 | 图 5 AsCOMT 疏水/亲水预测 Fig.5 Predicted hydrophobicity/hydrophilic for AsCOMT |
 | 图 6 AsCOMT 信号肽剪切位点预测 Fig.6 Predicted signal peptide cleavage sites for AsCOMT |
利用SOPMA程序对AsCOMT的二级结构预测,结果显示该蛋白的二级结构由37.26%的α-螺旋、20%的延伸链、10.96%的β-转角和31.78%的不规则卷曲组成,其中α-螺旋和不规则卷曲为主要成分。用PROSITE工具分析AsCOMT的二级结构域,分析结果显示该蛋白具有典型的II型氧甲基转移酶结构域SAM_OMT_II(26~355 aa),S-腺苷-L-甲硫氨酸结合位点为233位的天冬氨酸,酶活性位点(质子受体)为271位的组氨酸。将ASCOMT氨基酸序列在NCBI的蛋白质数据库(pdb)中进行同源比对,其与紫花苜蓿Medicago satival COMT(登录号KYW_A)的同源性最高,同源性为73.55%,在SWISS-MODEL选用同源比对模式(Aligament Mode)以MsCOMT为模板对AsCOMT进行结构域的三维同源建模(图 7),结果显示预测的AsCOMT三级结构与PDB在线软件对MsCOMT X射线晶体衍射结构鉴定结果一致[14]。
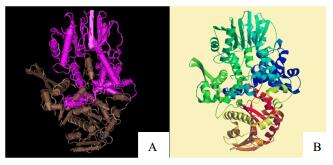 | 图 7 MsCOMT (A) 与 AsCOMT (B) 三维结构对比 Fig.7 Blast of 3D structure between MsCOMT (A) and AsCOMT (B) |
利用MEGA 5.0软件进行系统进化分析,采用Neighbor-joining方法,对AsCOMT与GenBank中与其同源性较高的18种植物COMT蛋白的氨基酸序列构建系统进化树,进行聚类分析(图 8),结果显示AsCOMT与峨参、大阿米芹、芝麻、罗勒和丹参等物种COMT的亲缘关系最近,聚为一类,与同科植物峨参的COMT亲缘关系最近;与蓖麻Ricinus communis L.、梅花Prunus mume Sieb.、绒毛烟草Nicotiana tomentosiformis L. 和灯笼椒Napsicum annuum L. 等物种COMT的亲缘关系较远。
 | 图 8 AsCOMT 系统发育树分析 Fig.8 Phylogenetic tree analysis of AsCOMT |
COMT属于氧甲基转移酶(O-methyltransferase,OMTs)中重要的一类,与植物很多次生代谢产物的合成相关[8]。COMT在许多植物中以基因家族形式存在,各成员基因的结构具有一定的保守性[15]。通过同源克隆结合cDNA末端快速扩增(RACE)技术克隆了与当归阿魏酸生物合成相关的COMT cDNA序列,并命名为AsCOMT。生物信息学分析表明,其编码蛋白质相对分子质量约为40 230,属II类OMTs,为Mg2+依赖型,以咖啡酸作为催化底物参与阿魏酸生物合成[16]。预测AsCOMT氨基酸序列信号肽及亚细胞定位,其不存在信号肽酶切位点,不具有信号肽,且未显示出明确的叶绿体、线粒体定位信号,提示AsCOMT在细胞质中合成后直接与基质中的底物结合,而不进行蛋白转运。
今后研究工作需进一步通过蛋白瞬时表达和蛋白异源表达系统明确亚细胞定位及其催化功能,利用反义核酸技术揭示对阿魏酸生物合成途径的调控机制。本研究结果为深入研究AsCOMT蛋白功能,探明当归阿魏酸生物合成途径的基因调控、通过生物技术提高当归药材质量奠定了基础。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 刘敬,李文建,王春明,等. 当归中有效成分阿魏酸的生物合成及调控[J]. 中草药,2008,39(12): 1909-1912. |
| [3] | 胡益勇,徐晓玉. 阿魏酸的化学和药理研究进展[J]. 中成药,2006,28(2): 253-255. |
| [4] | Hou Y Z,Zhao G R,Yuan Y J,et al. Inhibition of rat vascular smooth muscle cell proliferation by extract of Ligusticum chuanxiong and Angelica sinensis[J]. J Ethnopharmacol,2005,100: 140-144. |
| [5] | Chao W W,Lin B F. Bioactivities of major constituents isolated from Angelica sinensis (Danggui)[J]. Chin Med,2011,6(29): 73-79. |
| [6] | 汤浩,高庆剑,陆铖,等. 阿魏酸和异阿魏酸对HepG2细胞增殖及其细胞色素P450酶的影响[J]. 中草药,2014,45(12): 1726-1730. |
| [7] | Anderson N A,Chapple C. Perturbing lignin biosynthesis: metabolic changes in response to manipulation of the phenylpropanoid pathway[J]. Rec Adv Pol Res,2014,16(4): 39-59. |
| [8] | Dwivedi U N,Gupta P,Pandey V P,et al. Caffeic acid O-methyltransferase from Leucaena leucocephala: cloning,expression,characterization and molecular docking analyses[J]. J Mol Catal B: Enzym,2014,106: 63-70. |
| [9] | 宋银,王东浩,吴锦斌,等. 丹参咖啡酸-O-甲基转移酶基因(SmCOMT1)的克隆及其分析[J]. 植物研究,2012,32(4): 437-443. |
| [10] | Yang H J,Ahn J H,Jeong K J,et al. The homodimerization of Thalictrum tuberosum O-methyl transferases by homology-based Modelling[J]. Bull Korean Chem Soc,2003,24(9): 1256-1260. |
| [11] | 桂柳姿,崔培梧,潘清平,等. 忽地笑加兰他敏生物合成代谢途径中COMT酶基因克隆及序列分析[J]. 湖南中医药大学学报,2013,33(3): 35-40. |
| [12] | Pandit S S,Mitra S S,Giri A P,et al. A quick method for isolating RNA from raw and ripe fleshy fruits as well as for co-isolating DNA and RNA from polysaccharide and polyphenol-rich leaf tissues[J]. J Plant Biol,2007,50(1): 60-64. |
| [13] | 雒军,王引权,温随超,等. 当归DXR基因保守区克隆和组织特异性表达分析[J]. 中草药,2014,45(13): 1907-1913. |
| [14] | Biasini M,Bienert S,Waterhouse A,et al. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information[J]. Nucl Acids Res,2014,42: 252-258. |
| [15] | 倪志勇,吕萌,李波,等. 棉花咖啡酸-O-甲基转移酶基因的克隆及特征分析[J]. 中国农业科学,2010,43(6): 1117-1126. |
| [16] | Joshi C P. Conserved sequence motifs in plant S-adenosyl-L-methionine-dependent methyltransferases[J]. PM Biol,1998,37(4): 663-674. |
 2016, Vol. 47
2016, Vol. 47


