猫爪草RanuncoliTernati Radix的抗结核作用于20世纪50年代被报道,是目前抗结核疗效最好的药物之一[1]。传统剂型猫爪草胶囊,由于口服给药,药物随血液分布到全身,但病灶部位如结核感染局部药物浓度较低,无法达到杀死结核杆菌的最低杀菌浓度,在一定程度上影响了药效发挥[2]。多耐药难治性肺结核的病灶内有不同程度的纤维化,以常规制剂给药,病灶部位达不到最低抑菌浓度,因此现阶段临床上采用介入疗法,运用纤维支气管镜将抗结核药物的水溶液或普通凝胶剂直接注入病灶部位[3],增加病灶药物浓度,同时减少全身用药不良反应。但水溶液或普通凝胶剂无法在病灶部位长期滞留,为了制备在病灶部位长期滞留、缓释效果良好的制剂,本课题组设计了将抗结核药物制备成原位凝胶(in situ gel,ISG)的方案。ISG是一种新型药物传递系统,该系统在储藏条件下是自由流动的液体,给药后可根据环境变化而迅速发生相转变,在给药部位形成固态或半固态的凝胶[4]。本课题组前期研究制备了猫爪草提取物离子敏感型原位凝胶(Ranuncoli Ternati Radix extracts-ISG,RTRE-ISG),本研究对大鼠经纤维支气管镜肺部介入给予RTRE-ISG,考察其肺部安全性、局部滞留性和局部药物释放性,为猫爪草新型给药体系的开发提供依据。
1 材料 1.1 仪器85-2A数显测速恒温磁力搅拌器(江苏省金坛市荣华仪器制造有限公司);ZRS-4型智能溶出试验仪(天津大学无线电厂);VV2000型旋转蒸发仪(德国Heidolph);SNB-1数字黏度计(上海精密科学仪器有限公司天平仪器厂);AR2140型电子天平(上海天平仪器厂);LC-10AT型高效液相色谱(N2000型色谱工作站,日本岛津公司),FZ102微型植物粉碎机(天津泰斯特仪器有限公司),XW-80A型旋涡混合器(上海精科有限公司);Fx Pro型多功能活体成像系统(美国Kadak公司);酶标仪(VersaMax,Molecular Devices)。
1.2 药品与试剂猫爪草药材(原产地河南,购自北京同仁堂)经青海大学医学院药学系袁明副教授鉴定为毛莨科植物小毛莨Ranunculus ternatus Thunb.的块根;LF240D海藻酸钠(批号S20527,美国FMC);氯化钙(CaCl2,批号20080431),北京凤礼精求商贸有限公司;小毛茛内酯对照品(美国Sigma公司,质量分数>99%,批号BC4821),Cy5.5荧光染料,北京泛博生物化学有限公司;DIR荧光染料(批号781178),美国Invitrogen公司。甲醇为色谱纯,水为娃哈哈矿泉水,其他试剂均为分析纯。
1.3 动物健康SPF级SD雄性大鼠,体质量150~200 g,健康Nu/Nu雌性裸鼠,体质量18~20 g,均购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2012-0001;动物饲养室保持温度(23.0±1.5)℃,相对湿度(45±15)%。动物自由饮食饮水,适应1周后开始实验。
2 方法与结果 2.1 猫爪草提取物的制备[5]精密称取适量猫爪草粉末(80目),置于圆底烧瓶中,料液比1∶3,加70%乙醇回流提取3次,每次提取2 h,滤过,浓缩,1 200 r/min离心10 min,上清液以70%乙醇定容于50 mL量瓶中即得(提取物中含小毛茛内酯174 μg/mL)。
2.2 猫爪草提取物离子敏感型原位凝胶的制备[6]精密称取处方量海藻酸钠,在室温的条件下搅拌使其在50 mL猫爪草提取物中充分溶胀24 h,制备RTRE-ISG(含小毛茛内酯174 μg/mL)。
2.3 统计学处理使用SPSS 13.0软件对实验资料进行统计分析,实验所得数据以x±s表示,采用SPSS软件单因素方差分析方法(ANOVA),进行组间差异的显著性检验。
2.4 肺部安全性的初步评价[7,8] 2.4.1 分组及给药将SD大鼠随机分为7组,分别以A~G表示,A、B组分别给予生理盐水1、7 d,C、D组分别给予1%海藻酸钠RTRE-ISG1、7 d,E、F组分别给予2%海藻酸钠RTRE-ISG1、7 d,G组为不处理的正常对照,每组6只。除G组外,各组大鼠ip戊巴比妥钠(60 mg/kg)麻醉,气管插管,将0.2 mL生理盐水或RTRE-ISG(含小毛茛内酯174 μg/mL,小毛茛内酯抑制肺结核杆菌的最低抑菌浓度为64 μg/mL[2,7]),注入肺底并注入0.1 mL CaCl2。
2.4.2 肺灌洗液的制备及指标检测实验结束时,大鼠ip过量戊巴比妥钠致死,仰卧位固定在手术台上,打开胸腔,延甲状软骨的上缘开口。采用外径为1.8 mm的静脉导管作为肺泡灌洗用导管,并将插管沿气管缓缓插入,待插管到达气管杈时,用2.5 mL预热的生理盐水(37 ℃)作为灌洗液对双肺灌洗,重复4次,收集灌洗液,4 ℃离心(1 500r/min,10 min),取上清液4 ℃保存备用。采用试剂盒(均购自南京建成生物工程研究所)方法分别测定肺灌洗液中的总蛋白、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、羟脯氨酸(Hyp)、肿瘤坏死因子-α(TNF-α)水平。
表 1结果表明给药1d后,A、C及E组各项指标较G组均有升高(P<0.01),且C、E组较A组各项指标水平显著升高(P<0.01),说明RTRE-ISG对大鼠肺部可能具有损伤作用,E组大鼠各项指标均显著高于C组(P<0.01),说明2%海藻酸钠RTRE-ISG较1%海藻酸钠RTRE-ISG毒性增加;给药7 d后,B组各项指标水平与G组相比差异不显著,表明生理盐水不会对大鼠肺部产生不良影响,D组的IL-6、IL-8、TNF-α与G组比较差异不显著,这可能跟海藻酸钠本身具有免疫调节作用有关,但总蛋白、Hyp较G组升高;F组各项指标均显著高于B组和D组(P<0.01),且Hyp与E组相比无下降趋势,表明2%海藻酸钠RTRE-ISG可能由于黏度过大或其他一些原因使肺部炎症反应和致纤维化作用强于1%海藻酸钠RTRE-ISG,但D组中Hyp的表达较C组中有所下降,说明随着时间的推移1%海藻酸钠RTRE-ISG致肺纤维化作用有所减弱。
| 表 1 各组大鼠肺灌洗液中相关指标测定结果 Table 1 Determination of relativeindicators in BALF of rats in eachgroup |
将1%海藻酸钠RTRE-ISG灭菌后,加入水溶性荧光染料Cy5.5[10,11](激发波长670 nm,发射波长760 nm),使其在凝胶中溶解,均匀分散后,4 ℃冷藏保存。
2.5.2 受试药物考察1%海藻酸钠制备的RTRE-ISG(含小毛茛内酯174 μg/mL)在体内的滞留性,同时以2%卡波姆凝胶RTRE-ISG(含小毛茛内酯174 μg/mL)为对照。
2.5.3 活体荧光成像采用Nu/Nu裸鼠(20g左右),分成2组,每组3只。小鼠ip戊巴比妥钠(7.5 mg/kg)麻醉,气管插管,将0.2 mL 1%海藻酸钠RTRE-ISG或2%卡波姆凝胶RTRE-ISG注入肺底部,再注入处方量的CaCl2,分别在规定时间点置入活体成像仪中观察复合缓释载体在小鼠体内的滞留情况。由实验结果(图 1和2)可知,1%海藻酸钠RTRE-ISG注入Nu/Nu裸鼠肺部后即刻出现荧光,随着时间的推移肺部荧光逐渐减弱,且其在肺部滞留时间长达120~144 h,而2%卡波姆凝胶RTRE-ISG在体内的滞留时间仅为25~36 h。
 | 图 1 1%海藻酸钠制备的RTRE-ISG肺部滞留性Fig.1 Retention ability ofRTR-ISG prepared by 1% sodium alginate inlung |
 | 图 2 2%卡波姆凝胶制备的RTRE-ISG肺部滞留性 Fig.2 Retention ability ofRTRE-ISG prepared by 2%CG in lung |
Hypersil ODS色谱柱(150 mm×4.6 mm,5μm,伊利特公司),流动相甲醇-乙腈-水(40∶40∶20),体积流量1 mL/min,柱温30℃,检测波长254 nm,进样量20 μL。
2.6.2 标准曲线绘制精密称取小毛茛内酯对照品1.24 mg,加甲醇定容于50 mL量瓶中,作为储备液。精密吸取适量储备液,加甲醇分别稀释成24.80、12.40、6.20、3.10、1.55、0.78、0.39、0.18、0.09、0.05 mg/L的系列溶液,按“2.6.1”项条件测定,以质量浓度为横坐标(X),峰面积为纵坐标(Y),得回归方程Y=32 658 X-259(R2=0.9991),线性范围0.18~24.8 mg/L。
2.6.3 精密度试验分别精密量取0.39、3.1、24.8 mg/L共3个质量浓度的小毛茛内酯对照品溶液,于1 d内重复测定5次,计算日内精密度RSD分别为1.32%、0.33%、0.17%,连续测定5 d,计算日间精密度RSD分别为1.74%、1.02%、0.85%。
2.6.4 稳定性试验取大鼠空白肺灌洗液1 mL,配成含小毛茛内酯对照品4.28 μg/mL的灌洗液(n=5),作为质控样品,分别在0.5、1、2、4、8、12、24、48 h进行HPLC分析,计算得RSD均小于5%,可知小毛茛内酯在大鼠肺灌洗液中48 h稳定。
2.6.5 回收率试验取大鼠空白肺灌洗液1 mL,配成含小毛茛内酯对照品分别为0.27、4.28、34.20 μg/mL的灌洗液,每个浓度配制5份,作为质控样品,进行HPLC分析,将测得结果与相应浓度对照品溶液结果相比较,计算绝对回收率。0.27、4.28、34.20 μg/kg的灌洗液的绝对回收率分别为(86.61±3.96)%、(92.60±1.32)%、(94.96±1.91)%,RSD分别为4.17%、1.14%、2.21%。
2.6.6 改良肺泡灌洗技术的建立大鼠ip过量戊巴比妥钠致死,仰卧位固定在手术台上,打开胸腔,沿甲状软骨的上缘剪下气管,取出全肺,采用外径为1.8 mm的静脉导管作为肺泡灌洗用导管,并将插管沿气管缓缓插入,待插管到达气管叉时,气管上端用线扎紧,用注射器吸取生理盐水2.5 mL,通过导管将生理盐水缓慢注入肺部,可见肺部逐渐变得膨大、苍白,缓慢回抽灌洗液,再将所得液体缓慢注入肺部,如此反复抽注4次,最后一次边回抽边将插管缓慢外拔,此为第1次灌洗,重复上述操作3次,共完成4次灌洗,最后挤压出存留在肺部的全部灌洗液,合并上述所有灌洗液,4 ℃离心(1 500 r/min)10 min,冷冻干燥待测。
2.6.7 给药方案大鼠ip戊巴比妥钠(60mg/kg)麻醉后,气管插管,注入1%海藻酸钠RTRE-ISG或2%卡波姆凝胶RTRE-ISG(均含小毛茛内酯174 μg/mL)0.2 mL,并注入处方量的CaCl2,分别在0、0.5、1、3、5、8、12、24、48、72、96、120、144 h处死大鼠,每个时间点6只动物,按“2.6.6”项方法提取肺灌洗液并处理样品,按“2.6.1”项下条件测定得药物质量浓度。
2.6.8 肺部药物浓度-时间曲线以时间为横坐标,药物浓度为纵坐标,绘制RTRE-ISG的肺局部药物浓度-时间曲线图。结果见图 3。由结果可知,1%海藻酸钠RTRE-ISG在大鼠肺部5 h药物释放浓度达到峰值为5.24 μg/mL,144 h药物浓度为0.08 μg/mL,2%卡波姆凝胶RTRE-ISG在大鼠肺部3 h药物释放浓度达到峰值为9.21 μg/mL,48 h药物浓度为0.03 μg/mL。
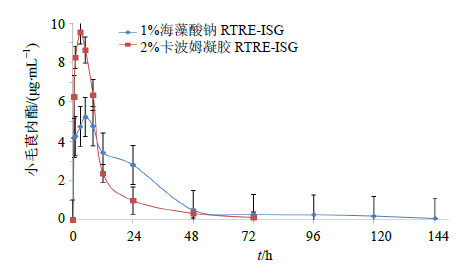 | 图 3 RTRE-ISG肺局部药物浓度-时间曲线Fig.3 Concentration-time curves of RTRE-ISG in local lung |
由于猫爪草提取物中含有多种成分,可能会影响RTRE-ISG的离子敏感性,通过实验证明,1%和2%海藻酸钠的RTRE-ISG再加入CaCl2后,依然能形成凝胶,证明其离子敏感性未受影响。
在外源性化合物经呼吸道染毒对肺毒性作用的研究中,特别是动物实验研究,已越来越多地应用支气管肺泡灌洗技术。可以通过对支气管肺泡灌洗液中多种成分的分析,探讨外源化合物对肺的毒性作用机制。
在本研究中选取了5种细胞因子作为观察指标,分别为总蛋白、Hyp、IL-6、TNF-α、IL-8,肺灌洗液中总蛋白的变化可反映肺的急性损伤情况;Hyp作为胶原纤维中特有的一类非必需氨基酸,是肺成纤维细胞是肺内胶原的主要合成细胞,而肺组织Hyp的量与胶原量之间具有较确定的数量关系,因此,研究肺组织Hyp量的表达变化可以反映肺纤维化的程度。IL-6是由活化的单核细胞、成纤维细胞、内皮细胞等产生的细胞因子,是炎症急性期合成的重要介质,作为一种重要的非特异性炎症因子,参与肺部炎症病理过程。TNF-α是早期主要的前炎症因子之一,是炎性反应释放最早、最重要的内源性介质。IL-8是一种强而有力的中性粒细胞趋化和活化因子,由单核细胞、上皮细胞、表皮细胞、纤维母细胞和T淋巴细胞在IL-1、TNF和外源性因子细菌多糖的刺激下产生,主要生物学作用是趋化并激活中心粒细胞,促进中性粒细胞的溶酶体酶活性和吞噬作用,对嗜碱性粒细胞和T细胞也有一定的趋化作用。
通过对大鼠肺部灌洗液细胞因子检测发现,给药1 d后,给予生理盐水组及RTRE-ISG组较对照组均有升高,这可能是由于异物进入实验动物肺部引起的一过性反应;给药7 d后,给予生理盐水组细胞因子与对照组相比无显著性差异,表明生理盐水不会对大鼠肺部产生不良影响,给予1%海藻酸钠制备的RTRE-ISG组的IL-6、IL-8、TNF-α较对照组无差异,这可能跟海藻酸钠本身具有免疫调节作用有关,但总蛋白、Hyp较对照组较高,表明制剂有潜在的致肺纤维化的作用,2%海藻酸钠RTRE-ISG组各项指标较生理盐水组均高,且Hyp与给药1d相比无下降趋势,表明2%海藻酸钠组可能由于黏度过大或其他一些原因使肺部炎症反应和致纤维化作用强于1%海藻酸钠RTRE-ISG组,但1%海藻酸钠RTRE-ISG给药7 d后Hyp的水平较给药1 d后有所下降,这说明随着时间的推移1%海藻酸钠RTRE-ISG致肺纤维化的作用有所减弱,但其长期给药致肺纤维化问题还需进一步通过实验证明。安全性实验数据显示1%海藻酸钠RTRE-ISG较2%海藻酸钠RTRE-ISG肺部安全性好。
本实验共有2处制备肺泡灌洗液的方法,但在操作手法上有所不同,第1次是经典的肺泡灌洗液的制备方法,主要是为了得到肺部表达的炎症因子,第2次是本课题组改良的肺泡灌洗液的制备方法,重点是为了得到肺部滞留的药物,两者操作最大的区别在于最后一步经典的方法无需挤压肺部,只是用导管吸出肺部灌洗液即可(避免挤压时炎症因子等过度表达),而改良法为了充分得到肺部滞留的药物,需要挤压肺部时灌洗液全部挤出,最大限度地提高药物的回收率。
本实验大鼠肺部滞留性实验与肺部药物浓度实验均采用2%卡波姆凝胶RTRE-ISG作对照,结果显示,1%海藻酸钠RTRE-ISG体内滞留性优于对照组。
| [1] | Girling D J. The hepatic toxicity of antituberculosis regimens containing isoniazid, rifampicin and pyrazinamide[J]. Tubercle, 1977, 59(1):13-32. |
| [2] | 何柯新, 吕世静. 猫爪草有效成分抗结核治疗进展[J]. 检验医学与临床, 2008, 5(6):354-356. |
| [3] | 陈志, 张广宇. 支气管镜介入技术在支气管结核治疗中的应用进展[J]. 中国防痨杂志, 2011, 33(8):509-510. |
| [4] | 胡春晖, 朱春燕. 利福平微球-ISG复合给药系统的研究[J]. 中国药学杂志, 2011, 46(4):283-286. |
| [5] | 胡春晖, 邱祥建, 袁庆. 正交试验优选猫爪草中小毛茛内酯的提取工艺[J]. 中国实验方剂学杂志, 2012, 20(12):17-19. |
| [6] | 胡春晖. 猫爪草提取物离子敏感型原位凝胶的制备及体外释药研究[J]. 时珍国医国药, 2015, 26(10):2412-2413. |
| [7] | Ji X Y, Li S Y, Meng S, et al. Synthesis and antimycobacterial activity of ternatolide[J]. J Chin Pharma Sci, 2012, 21(3):265-268. |
| [8] | 李艳贞, 张志荣, 林燕, 等. 肺部吸入微球致大鼠急性肺损伤的初步研究[J]. 中国药学杂志, 2012, 47(15):1123-1126. |
| [9] | Hu C H, Feng H Z, Zhu C Y. Preparation and characterization of rifampicin-PLGA microspheres/sodium alginate in situ gel combination delivery system[J]. Colloids Surf B Biointerfaces, 2012(95):162-169. |
| [10] | AlHilal T A, Alam F, Park J W, et al. Prevention effect of orally active heparin conjugate on cancer-associated thrombosis[J]. J Controlled Release, 2014, 195:155-161. |
| [11] | Hu S H, Fang R H, Chen Y W, et al. Photoresponsive Protein-Graphene-Protein Hybrid Capsules with dual targeted heat-triggered drug delivery approach for enhanced tumor therapy[J]. Adv Funct Mater, 2014, 24(26):4144-4155. |
 2016, Vol. 47
2016, Vol. 47

