2. 国家药典委员会, 北京 100061
2. Chinese Pharmacopeia Commission, Beijing 100061, China
地黄为玄参科地黄属植物地黄Rehmannia glutinosa Libosch. 的新鲜或干燥块根,为最常用和用量最大的中药材之一。《中国药典》2015年版收录的炮制方法有蒸法或酒炖法[1],地黄加工炮制后药性和功效发生改变,生地黄大寒而凉血,蒸制熟地黄性寒而补肾,酒炖熟地黄性微温而补血[2],临床依据不同药效而应用于不同病症。地黄主要含有糖类、环烯醚萜类、氨基酸类等成分,其中糖类成分的生物学活性受到了广大学者的关注,现代研究表明地黄低聚糖类具有提高机体免疫力、促进血细胞增殖、抗氧化、降血糖、抗老年痴呆等作用[3, 4, 5, 6, 7, 8, 9, 10]。目前文献报道地黄生品与炮制品主要关注梓醇、环烯醚萜类、水苏糖等成分的差异[11, 12],但同时测定地黄中8种糖类成分的分析方法尚未见报道。为了进一步探讨地黄炮制前后成分的变化规律,阐明炮制作用机制,本实验采用HPLC-ELSD法研究地黄生品与炮制品中8种糖类成分的变化情况,观察其动态变化过程,为揭示地黄炮制机制提供数据支持。
1 仪器与材料Agilent 1200高效液相色谱仪,美国安捷伦公司,Chemstation色谱工作站;AG285电子天平,瑞士Mettler Toledo公司;2000ES蒸发光散射检测器,Alltech公司;KQ-300VDB型双频数控超声波清洗仪,昆山市超声仪器有限公司;MilliQ-Advantuge A10,Millipore公司。
乙腈,Merck公司,色谱纯;甲醇,杭州化学试剂有限公司,分析纯;纯水,Milli-Q自制。D-无水葡萄糖(供定量测定用,质量分数99.5%,批号110833-201205)、蔗糖(供定量测定用,批号111507-20001)、果糖(供定量测定用,质量分数99.4%,批号100231-121305),均购自中国食品药品检定研究院;密二糖(质量分数99%,批号C1301015)、棉子糖(质量分数99%,批号E1222007)、水苏糖(质量分数98%,批号G1316008),均购自Aladdin Industrial公司;甘露三糖(质量分数>99%),由中国食品发酵工业研究所赠送;毛蕊花糖(质量分数>95%,批号120801),购于Megazyme公司。
地黄、熟地黄样品分别由嘉兴东方国药有限公司(批号:地黄130605、130610,熟地黄S130605、S130610)、宁波市中药饮片有限公司(批号:地黄1305322、130606,熟地黄S1305322、S130606)、浙江中医药大学中药饮片厂(批号:地黄3年存,熟地黄3年存)、杭州桐君堂医药药材有限公司中药饮片厂(批号:地黄20130530、20130604,熟地黄S20130530、S20130604)提供(同一厂家相应批次的熟地黄由对应批次的生地黄炮制得到),经浙江省食品药品检验研究院郭增喜主任中药师鉴定均为玄参科地黄属植物地黄Rehmannia glutinosa Libosch.的干燥块根。
2 方法与结果 2.1 色谱条件色谱柱为Prevail Carbohydrate ES柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱:0~20 min,72%~60%乙腈;20~30 min,60%~55%乙腈;体积流量0.8 mL/min;蒸发光散射检测器检测。典型图谱见图 1。
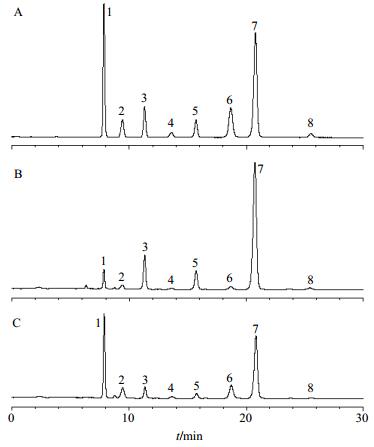 |
1-果糖 2-葡萄糖 3-蔗糖 4-密二糖 5-棉子糖 6-甘露三糖 7-水苏糖 8-毛蕊花糖 1-fructose 2-glucose 3-surcrose 4-melibiose 5-raffinose 6-manninotriose 7-stachyose 8-verbascose 图 1 对照品 (A) 、地黄 (B) 和熟地黄 (C) 的HPLC图Fig. 1 HPLC of reference substances (A),unprocessed R. glutinosa (B),and processed R. glutinosa (C) |
取对照品适量,精密称定,加25%甲醇分别制成含果糖362.7 μg/mL、葡萄糖180.7 μg/mL、蔗糖160.8 μg/mL、密二糖133.4 μg/mL、棉子糖168.0 μg/mL、甘露三糖752.5 μg/mL、水苏糖687.0 μg/mL、毛蕊花糖72.8 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备选取杭州桐君堂提供的地黄(批号20130530)平均分成10份,置蒸锅内,分别蒸制0、3、6、9、12、15、18、21、24、27 h,取出,低温干燥,得到不同炮制时间点的熟地黄样品。
取不同批次地黄的生品和炮制品适量,剪碎,精密称定,精密加入等量硅藻土,研匀,取粉末约2 g,精密称定,置锥形瓶中,精密加入25%甲醇溶液25 mL,精密称定质量,超声处理1 h,放冷,加25%甲醇补足减失的质量,摇匀,高速离心10 min后用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.4 线性关系考察精密吸取上述混合对照品溶液0.5~30 μL,分别注入液相色谱仪,测定峰面积,以进样量的对数为横坐标(X),峰面积积分值的对数为纵坐标(Y),以最小二乘法进行线性回归,得回归方程、相关系数(r)及线性范围分别为果糖Y=1.723 X+3.594,r=0.999 1,0.181~2.902 μg;葡萄糖Y=1.532 X+3.510,r=0.998 6,90.4~3 614.0 ng;蔗糖Y=1.422 X+3.694,r=0.999 2,80.4~3 216.0 ng;蜜二糖Y=1.379 X+3.286,r=0.998 9,0.114~2.858 μg;棉子糖Y=1.486 X+3.511,r=0.999 3,0.162~3.240 μg;甘露三糖Y=1.450 X+2.938,r=0.999 7,0.343~10.278 μg;水苏糖Y=1.449 X+3.470,r=0.999 6,0.137~6.183 μg;毛蕊花糖Y=1.386 X+3.592,r=0.998 4,69.6~1 392.0 ng;结果显示,果糖、葡萄糖、蔗糖、蜜二糖、棉子糖、甘露三糖、水苏糖和毛蕊花糖分别在相应进样范围内呈良好的线性关系。
2.5 精密度试验分别精密吸取混合对照品溶液10 μL,重复进样6次,以峰面积值为指标计算RSD(n=6),考察方法精密度,结果果糖、葡萄糖、蔗糖、蜜二糖、棉子糖、甘露三糖、水苏糖和毛蕊花糖的RSD分别为1.5%、4.3%、2.7%、3.7%、1.8%、0.9%、0.8%和3.8%,表明仪器精密度良好。
2.6 重复性试验精密称取熟地黄(批号S130605)粉末6份,按照“2.3”项方法制备供试品溶液,测定峰面积并分别计算各成分的量。结果果糖平均质量分数为45.83 mg/g,RSD为1.4%;葡萄糖平均质量分数为24.43 mg/g,RSD为1.9%;蔗糖平均质量分数为17.24 mg/g,RSD为3.5%;蜜二糖平均质量分数为13.63 mg/g,RSD为2.7%;棉子糖平均质量分数为16.32 mg/g,RSD为1.8%;甘露三糖平均质量分数为78.53 mg/g,RSD为1.4%;水苏糖平均质量分数为81.01 mg/g,RSD为0.8%;毛蕊花糖平均质量分数为5.29 mg/g,RSD为4.3%。
2.7 稳定性试验取重复性试验第1份供试品溶液,分别间隔0、3、6、9、11、13 h进样分析,以峰面积为指标计算RSD,考察供试品溶液稳定性,结果供试品溶液果糖、葡萄糖、蔗糖、蜜二糖、棉子糖、甘露三糖、水苏糖和毛蕊花糖峰面积的RSD分别为1.5%、3.0%、2.1%、4.2%、3.5%、2.2%、1.6%、4.3%,表明对照品溶液和供试品溶液在13 h内稳定。
2.8 加样回收率试验采用加样回收率测定法评价该方法的准确度。精密量取已测定的熟地黄(批号S130605)粉末6份,分别精密加入各对照品溶液适量,按照供试品制备方法制备供试品溶液,测定峰面积,计算平均回收率和RSD。结果果糖平均回收率为103.2%,RSD为1.4%;葡萄糖平均回收率为98.8%,RSD为1.3%;蔗糖平均回收率99.1%,RSD为3.7%;密二糖平均回收率102.1%,RSD为2.0%;棉子糖平均回收率98.5%,RSD为2.2%;甘露三糖平均回收率为99.0%,RSD为2.7%;水苏糖平均回收率为97.5%,RSD为1.6%;毛蕊花糖平均回收率为101.3%,RSD为2.0%。
2.9 样品测定取生地黄样品和炮制后的熟地黄样品,按“2.3”项方法制备供试品溶液,分别测定果糖、葡萄糖、蔗糖、蜜二糖、棉子糖、甘露三糖、水苏糖和毛蕊花糖的量,结果见表 1。
| 表 1 生地黄和熟地黄样品测定结果 (n = 2) Table 1 Determination ofsamples of unprocessed and processed R. glutinosa (n = 2) |
将不同炮制时间点的熟地黄样品,分别按照“2.3”项方法制备供试品溶液,进样测定,记录峰面积,并计算各成分质量分数,测定结果见表 2。
表 2测定结果显示,与炮制前比较,熟地黄中果糖、葡萄糖、蜜二糖和甘露三糖明显升高,而蔗糖、棉子糖、水苏糖和毛蕊花糖明显下降(P<0.01,8个成分炮制前后比较均具显著性差异),这可能与炮制受热过程蔗糖分解为果糖和葡萄糖、棉子糖分解成为蜜二糖和果糖、水苏糖分解为甘露三糖或蜜二糖相关。从测定结果看出,生地黄中以蔗糖、棉子糖、水苏糖和毛蕊花糖为主成分,而熟地黄中以果糖、葡萄糖、密二糖、甘露三糖为主成分。
| 表 2 不同炮制时间点的熟地黄各成分定量测定结果 (n = 2) Table 2 Determination each constituent in processed R. glutinosa at different processing time points (n = 2) |
不同炮制时间点的熟地黄各指标成分定量测定结果发现,果糖、葡萄糖、蜜二糖和甘露三糖在炮制过程中呈现上升趋势,9 h内上升较为明显,之后变化较为缓和。水苏糖、蔗糖、棉子糖和毛蕊花糖4种成分总体呈现下降趋势。
3 讨论本实验还对地黄经液相分离所得各色谱峰用对照品对照和LC-MS手段验证,证明了对照品成分与地黄中各成分的一致性。
本实验对回流提取和超声提取进行了比较,结果显示回流提取方法部分指标成分低于超声提取方法,与文献报道[13, 14, 15]这些糖类热不稳定性相吻合,故本实验选用超声提取方法。超声时间比较结果显示,超声40 min与超声60 min结果基本一致,为保证提取完全,实验选用超声60 min。本实验还对提取溶剂体积进行了比较,结果显示所设计的溶剂体积满足提取要求。本方法所得生地黄和熟地黄图谱特征性明显,可方便地区分两者,方法简便,结果准确,可为评价生地黄和熟地黄质量提供依据。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 张丽萍, 李军, 张振凌, 等. 熟地黄炮制方法的历史沿革[J]. 河南中医学院学报, 2005(2):69-71. |
| [3] | 汤建芳, 茹祥斌, 顾国明, 等. 地黄低聚糖对小鼠免疫和造血功能的作用[J]. 中药药理与临床, 1997, 13(5):19-21. |
| [4] | 陈力真, 冯杏婉, 周金黄, 等. 地黄多糖b的免疫抑瘤作用及其机理[J]. 中国药理学与毒理学杂志, 1993, 7(2):153-156. |
| [5] | 刘福君, 赵修南, 汤建芳, 等. 地黄寡糖对SAMP8小鼠造血祖细胞增殖的作用[J]. 中国药理学与毒理学杂志, 1998, 12(2):127-130. |
| [6] | 苗明三, 孙艳红, 方晓艳.(怀)熟地黄多糖抗氧化作用[J]. 中国中医药信息杂志, 2002, 9(10):32-33. |
| [7] | 樊淼, 杨菁, 白剑, 等. 地黄寡糖及其主要成分对大鼠脑片氧化应激损伤保护作用研究[J]. 中药药理与临床, 2009, 25(5):64-67. |
| [8] | 苗明三, 方晓艳. 怀地黄多糖免疫兴奋作用的实验研究[J]. 中国中医药科技, 2002, 9(3):159-160. |
| [9] | 张汝学, 贾正平, 刘景龙, 等. 地黄寡糖对2型糖尿病大鼠肝脏糖代谢关键酶活性及基因表达的影响[J]. 中草药, 2012, 43(2):316-320. |
| [10] | 蒋青, 沈明勤, 石磊, 等. 地黄寡糖对血管性痴呆大鼠海马区神经细胞凋亡及相关蛋白表达的影响[J]. 中国实验方剂学杂志, 2013, 19(2):192-196. |
| [11] | 李更生, 刘明, 王慧森, 等. 地黄药材炮制过程中环烯醚萜苷类成分动态变化的研究[J]. 中国中医药科技, 2008, 15(6):440-442. |
| [12] | 温学森, 杨世林, 马小军, 等. 地黄在加工炮制过程中HPLC谱图的变化[J]. 中草药, 2004, 35(2):153-156. |
| [13] | 胡志方, 王小平, 郭慧玲, 等. 地黄不同炮制品中低聚糖含量的HPLC-ELSD测定[J]. 时珍国医国药, 2013, 24(4):877-879. |
| [14] | 邱建国, 张汝学, 贾正平, 等. HPLC法测定地黄及含地黄成药中寡糖[J]. 中草药, 2010, 41(12):1997-2000. |
| [15] | 刘彦飞, 赵宇, 武卫红, 等. 地黄的化学成分及其在加工炮制过程中的变化[J]. 国外医药·植物药分册, 2007, 22(3):102-108. |
 2016, Vol. 47
2016, Vol. 47



