2. 温州医科大学, 浙江 温州 325000
2. Wenzhou Medical University, Wenzhou 325000, China
肾纤维化是多种细胞因子介导、多通道信号转导的病理过程,以细胞外基质过度沉积和肾脏组织结构破坏以及功能逐渐丧失为特征[1],是绝大部分慢性肾病(chronic kidney disease,CKD)共同的转归途径。2015年有报道称,CKD患病率在未来的20年内会急速蹿升,美国30~64岁的个体中超过一半人可能发生CKD[2]。在我国CKD患病率同样也呈上升趋势,2012年的研究表明,中国成年人群CKD的患病率为10.8%[3],并呈逐年上升趋势。因此,了解CKD的发生发展以及防治措施具有重大的社会意义。一般认为,肾纤维化的基本病机为脾肾气虚为本,兼夹水湿、痰浊、血瘀。清化固肾排毒方是温州市中医院自拟方,具有补脾益气、清热除湿、祛痰消浊、活血化瘀之功。方中黄芪健脾益气固本,山药滋阴降火,柴胡、白花蛇舌草清热,金钱草燥湿,佐以白芥子化皮里膜外之痰,最后大黄活血化瘀去毒。该方在临床上已经广泛应用于CKD的治疗,并取得显著治疗效果[4,5]。本研究通过复制单侧输尿管梗阻肾纤维化模型,旨在观察清化固肾排毒方对Wnt信号通路中Wnt1和β-catenin表达的影响,探讨其抗肾纤维化的可能机制。
1 材料 1.1 实验动物健康雄性SD大鼠108只,SPF级,体质量(180±20)g,购于温州医科大学动物实验中心,由上海斯莱克实验动物有限责任公司提供,许可证号SCXK(沪)2012-0002。在温州医科大学实验动物中心SPF级饲养,人工光照,明、暗各12 h,(50±5)%相对湿度,25 ℃恒温的普通设施中,自由饮水,进食标准普通饲料,每笼6只。适应性饲养5d后,无不良反应即进入实验。
1.2 药物清化固肾排毒颗粒(江阴天江药业有限公司产品,批号20141007)是清化固肾排毒方原方药材提取加工制成颗粒剂组方规格:黄芪提取物1.5 g、柴胡提取物1 g、白花蛇舌草提取物1 g、山药提取物1 g、金钱草提取物1 g、大黄提取物0.5 g、白芥子提取物1 g,以上7味药提取物混合30 min使均匀,干法制成18~40目的颗粒,按100 g/瓶分装。每100克颗粒相当于生药822 g。主辅料比例为3∶1,辅料主要为麦糊精和乳糖(2∶1),乙醇浓度为50%。洛丁新(盐酸贝那普利片,北京诺华制药制药有限公司,批号12294563)。
1.3 主要试剂Masson染色试剂盒、DAB显色试剂盒(福州迈新生物技术开发有限公司);磷酸缓冲液(PBS)、柠檬酸缓冲液(北京中杉金桥生物技术有限公司);抗Wnt1抗体、抗β-catenin抗体(Abcam);GTVisionTM III抗鼠/兔通用型免疫组化检测试剂盒[基因科技(上海)有限公司]。
1.4 仪器DW-86L626超低温冰箱,海尔集团;BX51光学显微镜,日本Olympus公司;微量加样枪,德国Eppendorf公司;RM2235病理切片机,德国Leica公司;KD-TS3A组织脱水机,郑州南北仪器设备有限公司;CoulterAU5800全自动生化分析仪,美国Beckman公司。
2 方法 2.1 动物分组、造模及给药108只SPF级雄性SD大鼠适应性饲养5 d后,按随机数字表法分为假手术组(n=18)和造模组(n=90)。造模组采用单侧输尿管梗阻术(UUO)[6]建立肾间质纤维化大鼠模型:禁食不禁水12 h,称体质量,以10%水合氯醛3.5 mL/kg ip麻醉,取右侧卧位固定于手术台,剪除左侧腹部被毛。常规消毒,从背部距左侧肋脊角1.5 cm处做1.2~1.5 cm的斜向切口,逐层剪开皮肤、肌肉,开腹后暴露左侧肾脏,游离左输尿管,分别于约肾盂处和输尿管上1/3处双重结扎(不剪断),后纳肾归原位,然后逐层缝合。造模后,造模组按随机数字表法分为模型组,洛丁新组,清化固肾排毒颗粒高、中、低剂量(3.0、1.5、0.75 g/kg)组,每组18只。假手术组开腹后只分离左侧输尿管,但不结扎。造模后第2天开始给药,每日称大鼠体质量,假手术组、模型组ig给予10 mL/kg生理盐水。清化固肾排毒颗粒用生理盐水配成相应浓度,ig给药体积为10 mL/kg。清化固肾排毒颗粒高、中、低剂量分别按相当于60 kg体质量成人每日剂量的20、10、5倍(成人每日服用清化固肾排毒颗粒9 g)计算。洛丁新组ig给予药物1.6 mg/kg(0.16 mg/mL)。
2.2 标本收集和处理6组大鼠分别于术后第7、14、21天时分批随机抽取6只大鼠处死。处死前1 d禁食,自由饮水,称体质量,10%水合氯醛(3.5 mL/kg)ip麻醉,心脏取血3 mL,3 000 r/min离心5 min,取血清,−20 ℃保存备用。留取大鼠左侧(梗阻侧)肾脏,去除包膜,迅速分切肾组织,一半置于中性福尔马林溶液中固定,其余肾脏组织用生理盐水清洗后液氮速冻,转置−80 ℃冰箱中保存。
2.3 观察指标及检测方法 2.3.1 血肌酐(SCr)、血尿素氮(BUN)测定心脏取血,收集血清,并通过全自动生化分析仪检测(温州市中医院检验科提供)。
2.3.2 肾脏组织常规染色观察肾脏组织经中性福尔马林溶液固定24 h,常规脱水、透明、浸蜡、包埋,制成3 μm石蜡切片,按常规方法行HE染色和Masson染色。①HE染色评定:光学显微镜观察(×400倍),依据每个视野肾小管病变(肾小管上皮细胞空泡变性、肾小管扩张、肾小管萎缩、红细胞管型、蛋白管型、间质水肿、间质纤维化、间质炎性细胞浸润等)累及的小管数目评定肾小管间质损伤指数[7]。0分:肾小管结构正常,未见病变;l分:肾小管病变数目<3个;2分:肾小管病变数目3~5个;3分:肾小管病变数目>5个或肾小管结构消失。每张切片随机选取10个视野不相重叠的皮质处肾小管,每只大鼠选5张组织切片,最后取平均值。②Masson染色半定量分析:在400倍视野下,每只大鼠选取5张组织切片,每张切片随机选取5个互不重叠的肾皮质处肾小管间质视野,取平均值。根据视野中胶原染色阳性面积占整个视野面积的百分比评定肾间质纤维化指数[8]。标准如下:0分,纤维化阳性面积<2%;1分,纤维化阳性面积2%~10%;2分,纤维化阳性面积11%~20%;3分,纤维化阳性面积21%~30%;4分,纤维化阳性面积>30%。
2.3.3 免疫组织化学法检测肾脏组织Wnt1、β-catenin表达3 μm石蜡切片(制备同“2.3.2”项)常规脱蜡水化,柠檬酸盐缓冲液(pH值6.0)中高压煮沸修复抗原,加3% H2O2孵育20 min(室温);滴加山羊血清封闭液(室温封闭30 min),滴加一抗,抗Wnt1(1∶200)、β-catenin(1∶500),4 ℃过夜。加使用聚合HRP标记的二抗(37 ℃、20 min)。DAB显色(室温,镜下控制反应时间)、蒸馏水洗涤、苏木素轻度复染。脱水、透明、封片。光学显微镜下观察,400倍视野下,每张切片随机取5个非重叠且非髓质视野,避开切片边缘区和组织破损区,拍照;Image Pro Plus 6.0软件分析每张照片中阳性染色面积的平均积分吸光度值,以反映Wnt1和β-catenin表达量。
2.4 统计学方法用SPSS 13.0统计软件处理,计量资料数据以x±s表示,采用单因素方差分析(One-way ANOVA)对多个样本均数进行比较,两两比较采用SNK-q检验,方差不齐时采用Welch法,两两比较采用Dunnett T3检验。
3 结果 3.1 大鼠肾功能检测结果各组大鼠血清BUN、SCr变化情况见表 1。与假手术组相比,模型组大鼠血清SCr和BUN均明显升高(P<0.05)。与模型组相比较,清化固肾排毒颗粒大鼠血清SCr和BUN均明显降低(P<0.05);清化固肾排毒颗粒高、中、低剂量组之间比较无统计学差异;清化固肾排毒颗粒各组与洛丁新组比较,差异无统计学意义。随着时间的延长,各造模组SCr和BUN均逐渐升高。
| 表 1 各组大鼠血清SCr和BUN水平 Table 1 Results of SCr and BUN in serum of rats in each group |
假手术组大鼠肾脏形态色泽正常,无明显异常病理改变。造模组(包括模型组,清化固肾排毒颗粒高、中、低剂量组和洛丁新组)大鼠梗阻侧肾脏体积不同程度增大,肾实质明显变薄,肾脏颜色较对侧为浅,可见肾盂扩张,呈囊状,肾乳头萎缩,并随着梗阻时间的延长,情况进一步加重,切开后可见棕褐色浑浊液体。右肾基本正常。
3.2.2 HE染色①组织形态观察:假手术组HE染色未见明显病理改变,肾小管上皮细胞胞质丰满、小管管腔较小,间质中未见明显炎症细胞浸润。造模组,肾脏可见部分肾小管上皮细胞空泡变性,管腔扩张,肾小管上皮细胞萎缩、坏死、脱落、间质增宽,以及单核、淋巴细胞浸润,间质组织中出现成纤维细胞增生和肾间质纤维化,随梗阻时间延长,情况进一步加重。与模型组比较,洛丁新组及清化固肾排毒颗粒组肾小管损伤程度有所缓解。②肾小管间质损伤指数比较:与假手术组比较,各造模组肾间质损伤指数显著增加(P<0.05),且随梗阻时间延长,肾间质损伤指数逐渐增加(P<0.05)。与模型组比较,经清化固肾排毒颗粒、洛丁新治疗7 d后,大鼠肾间质损伤程度减轻,但差异不显著;治疗14、21 d后,洛丁新组与清化固肾排毒颗粒中剂量组肾损伤程度明显轻于模型组(P<0.05)。结果见图 1和表 2。
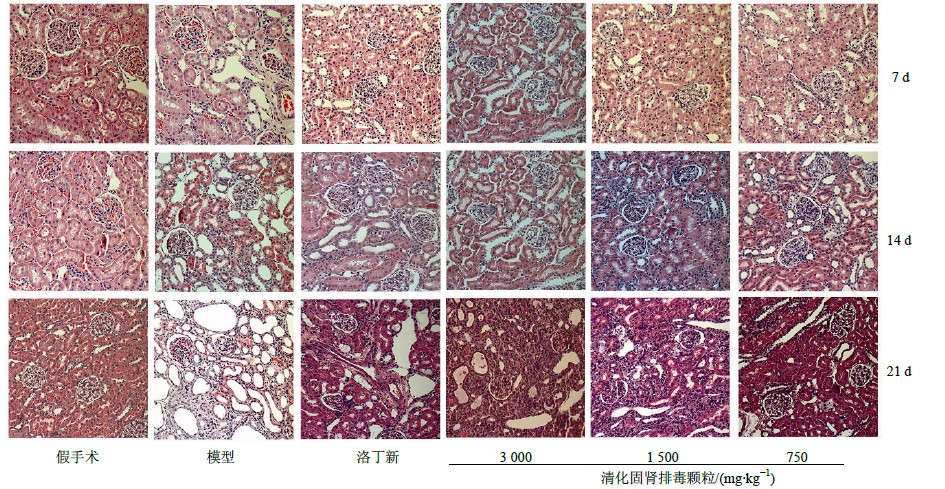 | 图 1 各组大鼠肾组织HE染色结果Fig.1 Results of HE staining for kidney tissue of rats in each group |
| 表 2 各组大鼠肾小管间质损伤指数比较 Table 2 Renal injury index of renal tubular interstitial of rats in each group |
假手术组,肾组织Masson染色未见明显病理改变,仅见肾小管基膜处呈线状分布的蓝染的胶原组织。而造模组随着梗阻时间的延长,间质中蓝染的胶原纤维逐渐增多,小管上皮细胞红染变淡,提示纤维化进行性加重,小管上皮损伤。胶原半定量分析显示,与假手术组比较,各造模组肾间质纤维化指数显著增加(P<0.05),随着梗阻时间延长,肾小管间质纤维化逐渐加重(P<0.05)。与模型组比较,清化固肾排毒颗粒、洛丁新组肾间质纤维化指数减轻(P<0.05);治疗21 d后,清化固肾排毒颗粒中剂量组较洛丁新组更能减缓肾间质纤维化程度(P<0.05)。结果见图 2和表 3。
 | 图 2 Masson染色评价肾间质纤维化情况Fig.2 Evaluation of renal interstitial fibrosis by Masson staining |
| 表 3 各组大鼠肾间质纤维化指数比较 Table 3 Renal interstitial fibrosis index of rats in each group |
假手术组,Wnt1在肾小管上皮细胞胞质内有微量表达。造模后,各造模组大鼠肾小管上皮细胞细胞质和细胞核内Wnt1均有不同程度的表达,肾小球内也有少量Wnt1表达,在梗阻后第7天Wnt1表达量最高(P<0.05),随着时间延长,Wnt1表达减少,且均显著高于假手术组(P<0.05)。与模型组相比较,清化固肾排毒颗粒各组与洛丁新组Wnt1表达均有降低(P<0.05)。结果见图 3和表 4。
 | 图 3 Wnt1免疫组化结果 Fig.3 Immunohistochemicalresultsof Wnt1 |
| 表 4 各组大鼠肾脏组织Wnt1蛋白在不同时间表达情况比较 Table 4 Protein expression of Wnt1 in renal tissue of rats in each group at different time |
在假手术组,β-catenin在肾小管上皮细胞膜有少量表达,上皮细胞胞质内有微量表达。造模后,各造模组大鼠肾小管上皮细胞内β-catenin大量表达,随着梗阻时间延长,各造模组肾间质β-catenin表达量增多,且均显著高于假手术组(P<0.05)。与模型组相比较,清化固肾排毒颗粒各剂量组与洛丁新组β-catenin表达均降低(P<0.05)。治疗第7天,洛丁新组、清化固肾排毒颗粒中剂量组较清化固肾排毒颗粒低剂量组更能降低β-catenin表达(P<0.05)。结果见图 4和表 4。
 | 图 4 β-catenin免疫组化结果Fig.4 Immunohistochemicalresultsof β-catenin |
中医古籍中并无肾纤维化的记载,但根据叶天士提出“久病入络”“久痛入络”的理论,肾纤维化可属于中医学肾络病的范畴。根据肾络病“易滞易淤、易入难出、易积成形”病机特点[9],治疗上主要以益气活血、利湿化痰为主。清化固肾排毒方,以黄芪、山药益气固肾,柴胡、白花蛇舌草、金钱草清热、化瘀、利湿,特别是运用白芥子清化皮里膜外之痰,从多靶位、多层次、多途径进行整体调节。临床研究表明清化固肾排毒方可调节免疫功能、减少炎症介质分泌,在治疗慢性肾炎方面可获得满意的疗效[5]。
慢性肾功能不全肾纤维化涉及的信号通路,现在研究的比较清楚的主要有转化生长因子β/Smad信号转导通路、丝裂原激活蛋白激酶级联的信号转导系统、腺苷通路等。近年来,越来越多的证据表明Wnt信号通路与肾纤维化的形成息息相关,在慢性肾功能不全的发生发展过程中发挥着重要的作用[10,11]。深入研究Wnt信号通路在肾间质纤维化发生发展中的作用,可为抗肾脏纤维化的治疗提供新途径和干预靶点。
Wnt信号通路编码和分泌许多细胞生长因子以及细胞分化因子,对肾脏的发生和发育起着至关重要的作用。Wnt信号通路的突变或异常改变可引发许多肾脏疾病,包括肾脏的纤维化、癌变、多囊肾、急性肾衰竭、糖尿病肾病以及肾脏的缺血性损伤等[12]。Wnt信号通路分为经典通路和非经典通路。经典通路即Wnt/β-catenin通路。非经典通路主要包括三条通路:Wnt/PCP通路、Wnt/Ca2+途径、调节纺锤体定向和不对称细胞分裂通路[13]。
目前,研究较清楚的是Wnt经典通路。β-catenin在该信号通路中处于中心位置,正向调控Wnt途径的下游靶基因转录[14]。在肾纤维化病变中,β-catenin大量积聚,激活纤维化相关基因的表达,如基质金属蛋白酶7(MMP-7)、纤溶酶原激活物抑制物1(PAI-1)、血管内皮生长因子(VEGF)等,促进上皮间质转化的发生。本研究发现,β-catenin在肾纤维化大鼠中表达显著高于假手术组,统计学有差异(P<0.05),随着梗阻时间延长,各造模组肾间质β-catenin表达量增多,且均显著高于假手术组(P<0.05),说明β-catenin与肾纤维化的发生发展有关。经过药物治疗后,清化固肾排毒颗粒各组与洛丁新组β-catenin相较模型组表达均有降低(P<0.05)。证明清化固肾排毒方能下调β-catenin的表达,提示清化固肾排毒方可能能过抑制Wnt信号通路发挥抗肾纤维化的作用。
Wnt信号通路迄今为止,在人和小鼠等多种脊椎动物中发现了19种Wnt基因[15],编码19种蛋白。Wnt蛋白是一类分泌型糖蛋白。Wnt蛋白的异常表达与Wnt信号通路的激活有关[16]。Wnt1作为Wnt家族的多个成员之一,在维持组织内环境的稳定以及在肾纤维化的发生发展中都有重要作用[11]。2009年He等[11]的研究表明,当小鼠单侧输尿管结扎造成间质纤维化模型后,Wntl在梗阻后第7天出现最高表达,随后下降。
本实验研究结果与文献报道一致[11],Wnt1蛋白在输尿管梗阻后第7天出现最高表达(P<0.05),随后第14天、第21天表达下降,但各造模组Wnt1蛋白表达均高于假手术组(P<0.05),提示Wnt1可能在肾纤维化的发生发展中起作用。与模型组相比较,经过药物治疗后,清化固肾排毒颗粒各组与洛丁新组Wnt1表达均有降低(P<0.05)。表明清化固肾排毒颗粒能一定程度下调肾纤维化大鼠Wnt1蛋白的表达,并可能是通过Wnt信号通路发挥作用。Wnt1蛋白作为Wnt/β-catenin通路中的上游信号蛋白,与β-catenin有着密切联系,Wnt1信号的异常激活可引起肾小管胞质内β-catenin增多。Wnt信号通路本身比较复杂,且Wnt信号通路与其他信号通路存在着交互联系,Wnt1是否为Wnt信号通路的启动因子无法确定。因此,寻找Wnt信号通路在肾纤维化发生中的启动信号以及清化固肾排毒方对肾纤维化其他通路的影响及机制有待进一步研究。
志谢:本实验在温州医科大学动物实验中心、温州医科大学附属第二医院科研中心完成,温州市中医院检验科、病理科提供技术支持。
| [1] | 李明亮, 杜洁, 戴英波. 肾纤维化信号通路的研究进展[J]. 医学综述, 2013, 19(18):3275-3278. |
| [2] | Hoerger T J, Simpson S A, Yarnoff B O, et al. The future burden of CKD in the United States:A simulation model for the CDC CKD initiative[J]. Am J Kidney Dis, 2015, 65(3):403-411. |
| [3] | Zhang L X, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet, 2012, 379(9818):815-822. |
| [4] | 陈念昭, 冯如流, 陈春, 等. 清化固肾排毒方治疗慢性肾功能不全患者45例疗效观察[J]. 浙江中医杂志, 2015, 50(5):353-354. |
| [5] | 董飞侠, 朱宗元, 曾章超. "清化固肾方"治疗慢性肾炎的临床研究[J]. 江苏中医药, 2006, 27(1):28-29. |
| [6] | Yuan X P, Liu L S, Fu Q, et al. Effects of ligustrazine on ureteral obstruction-induced renal tubulointerstitial fibrosis[J]. Phytother Res, 2012, 26(5):697-703. |
| [7] | Solez K, Axelsen R A, Benediktssen H, et al. International standardization of criteria for the histologic diagnosis of renal allograft rejection:the Banff working classification of kidney transplant pathology[J]. Kidney Int, 1993, 44(2):411-422. |
| [8] | Heungsoo K, Takashi O, Jesus L G, et al. TIMP-1 deficiency does not attenuate interstitial fibrosis in obstruetive nephropathy[J]. J Am Soc Nephrol, 2001, 12(4):736-748. |
| [9] | 贾振华, 吴以岭. 络病理论及其应用研究[A]//全国中医药中青年科技创新与成果展示论坛论文集[C]. 重庆:中华中医药学会, 2009. |
| [10] | 罗婷, 董飞侠, 程锦国. Wnt信号通路在肾纤维化中作用的研究进展[J]. 国际泌尿系统杂志, 2015, 35(2):301-305. |
| [11] | He W, Dai C, Li Y, et al. Wnt/beta-catenin signaling promotes renal interstitial fibrosis[J]. J Am Soc Nephrol, 2009, 20(4):765-776. |
| [12] | Pulkkinen K, Murugan S, Vainio S. Wnt signaling in kidney development and disease[J]. Organogenesis, 2008, 4(2):55-59. |
| [13] | Veeman M T, Axelrod J D, Moon R T. A second canon:Functions and mechanisms of beta-catenin-independent Wnt signaling[J]. Dev Cell, 2003, 5(3):367-377. |
| [14] | Hung H, He X. Wnt/beta-catenin signaling:new (and old) players and new insights[J]. Curr Opin Cell Biol, 2008, 20(2):119-125. |
| [15] | Chien A J, Conrad W H, Moon R. A Wnt survival guide:from fliesto human disease[J]. J Invest Dermatol, 2009, 129(7):1614-1627. |
| [16] | Polakis P. Wnt signaling and cancer[J]. Genes Dev, 2000, 14(15):1837-1851. |
 2016, Vol. 47
2016, Vol. 47



