2. 西藏大学农牧学院, 西藏 林芝 860000
2. Agricultural and Animal Husbandry College of Tibet University, Linzhi 860000, China
肠道上皮细胞作为具有保护功能的屏障经常接触外界环境中的微生物和有毒物质,这一屏障保护宿主避免致病菌和共生菌的入侵与系统传播,构成了个体防御微生物入侵的第一道防线[1,2]。果蝇没有类似哺乳动物的B淋巴细胞和T淋巴细胞,因而不具有获得性免疫系统,只能通过天然免疫对入侵的病原微体做出免疫应答。其中双重氧化酶(dual oxidase,DUOX)产生的活性氧(reactive oxygen species,ROS)与核转录因子(NF-κB)信号通路产生的抗菌肽(antibacterialpeptide,AMP)为其主要的防御机制[3]。在果蝇肠道免疫中,ROS的动态生成和消除对调节体内平衡的氧化还原反应具有重要意义,而过量的ROS对肠道上皮细胞产生一定的损伤[4,5]。近几年的研究结果表明,一些化学物质如氯化钠、十二烷基硫酸钠(SDS)、H2O2和1,1-二甲基-4,4-联吡啶阳离子盐(百草枯,PQ)等化合物通过应激反应影响肠道内环境稳态,并诱导肠道细胞的分化和凋亡[4,6]。
近年来许多人类疾病如帕金森病、阿尔茨海默病、糖尿病、心血管疾病以及癌症都以果蝇作为模式生物进行研究[7]。而中药具有抗炎、抗氧化、抗病毒、抗肿瘤以及提高机体免疫力的作用。其中毛茛科(Ranuculaceae)乌头属Aconitum L.的工布乌头Aconitum kongboense Lauener具有抗炎止痛、祛风除湿的作用,可治疗跌打损伤、风湿骨痛、牙痛、毒蛇以及毒虫咬伤等[7]。工布乌头分布于西藏、四川西部,藏药名为榜那,为常用藏药[8]。其块茎含有多种生物碱,主要成分为毒性较大的二萜类生物碱,包括乌头碱、新乌头碱和塔拉萨敏等。虽然乌头属植物作为传统中药受到广泛关注,但对于工布乌头的药用机制方面的研究报道很少。本实验采用多种致炎因子喂食果蝇,诱导果蝇肠道损伤,通过分析比较果蝇生存率、肠道上皮细胞凋亡、肠道细胞内ROS的量和肠道形态变化等,探讨工布乌头提取物对果蝇肠道免疫功能的影响,为工布乌头增强肠道免疫功能研究和进一步开发利用提供科学依据。
1 材料 1.1 药材与试剂工布乌头采自西藏浪卡子县,经东北林业大学生命科学学院王秀华教授鉴定为工布乌头Aconitum kongboense Lauener的根。H2O2、PQ和SDS购自Sigma公司,葡聚糖硫酸钠(DSS)购自Mpbio公司,7-氨基放线菌素(7-AAD)和二氢乙锭(DHE)购自Invitrogen公司,其他试剂均为分析纯。
1.2 果蝇野生型黑腹果蝇Drosophila melanogaster W1118和esgGal4 UAS-GFP品系为本实验室保存。果蝇培养箱温度为(25±1)℃,湿度为50%~60%。
1.3 仪器ALC-210.4型电子分析天平,北京赛多利斯公司;Elix5去离子水系统,Millipore公司;SZ51型显微镜,日本Olympus公司;Axioskop 2 plus型荧光显微镜,Zeiss公司。
2 方法 2.1 工布乌头提取物的制备称取工布乌头粉末10 g于300mL去离子水中,浸泡12 h,中火煮沸3 h,滤过,滤渣再加入200 mL去离子水,继续中火煮沸3 h,滤过,将2次滤液混合,浓缩至50 mL,得到质量浓度为200 mg/mL的工布乌头提取物(利用HPLC方法检测工布乌头提取物中含塔拉萨敏0.181%),4 ℃密封储存备用。
2.2 培养基的配制对照组培养基(正常培养基)配制方法参考文献方法[9]。实验组培养基(含工布乌头提取物培养基)为对照培养基中去离子水换成等体积工布乌头提取物,配制成质量分数为0.5%、1.0%和1.5%的工布乌头培养基和10%刺五加果实培养基(阳性对照)[9]。
2.3 果蝇生存率分析随机收集对照组和实验组羽化了3~5 d的成虫果蝇,每组雌雄各15只,对各组果蝇饥饿处理2 h后转移到放有5层滤纸的果蝇管中,分别加入5%蔗糖溶液,分别包含0.6% SDS、4.0% DSS、1.0% H2O2以及6.0 mmol/L PQ等致炎因子使滤纸充分润湿,喂食4~7 d,每隔24 h更换1次滤纸并记录果蝇死亡数,每组分别重复3次实验。对照组为正常培养基;实验组分别为含0.5%、1.0%和1.5%的工布乌头提取物培养基和10%刺五加果实培养基。
2.4 肠道上皮细胞凋亡分析和ROS定量测定随机收集对照组和实验组羽化了3~4 d的雌果蝇,喂食SDS后,各提取10~15条果蝇肠道于冷的PBS中,用7-AAD或DHE室温染色30 min,4%多聚甲醛固定10 min,DAPI染色10 min,最后用70%甘油封片,于显微镜下观察并照相。每组实验分别重复2~3次。7-AAD染色的果蝇喂食0.6% SDS溶液96 h后提取肠道;DHE染色的果蝇喂食1.0%的SDS溶液48 h后提取肠道。
2.5 免疫染色随机收集对照组和实验组羽化了3~4 d的esgGal4 UAS-GFP品系雌果蝇,喂食0.6% SDS溶液,时间为16 h,各提取10~15条果蝇肠道于甲醛中,常温固定30 min,与GFP抗体结合,4 ℃过夜,2抗rat-FITC结合2 h后DAPI染色10 min,最后用70%甘油封片,于显微镜下观察并照相。每组实验分别重复2~3次。
2.6 肠道形态变化观察随机收集对照组与实验组羽化了3~4 d的雌果蝇,喂食0.6% SDS溶液96 h。提取10~15条果蝇肠道于预冷的PBS中,显微镜下观察并照相。每组实验分别重复2~3次。
2.7 统计学处理采用Prism5软件进行统计学分析,组间差异采用单因素方差进行分析。
3 结果 3.1 对果蝇生存率的影响为了观察工布乌头提取物对果蝇肠道免疫功能的影响,以喂食10%刺五加果实为阳性对照[4,9],分别用0.6% SDS、4.0%DSS、1.0% H2O2以及6.0 mmol/L PQ等致炎因子处理对照组与实验组果蝇。用SDS处理4 d后,对照组果蝇生存率为26.6%、阳性对照组为63.3%,而喂食1.0%工布乌头提取物组果蝇生存率为57.1%,与对照组相比提高了30.5%。但是喂食0.5%和1.5%工布乌头提取物组生存率没有变化,与对照组相似(图 1-A)。喂食DSS 7 d后,对照组和阳性对照组生存率分为10.0%和78.9%,而0.5%和1.0%工布乌头提取物组生存率分别为46.7%和50.9%,比对照组分别提高了36.7%和40.9%。而1.5%工布乌头提取物组生存率没有明显的变化,只比对照组提高了22.2%(图 1-B)。同样,用H2O2或PQ处理5 d或4 d后,对照组的生存率分别为8.8%和12.2%、阳性对照组为53.0%和57.0%,而1.0%工布乌头提取物组生存率分别为45.5%和46.2%,分别较对照组提高了36.7%和34.0%(图 1-C和D);0.5%工布乌头提取物组生存率分别为30.0%和15.6%,只能提高H2O2处理后的生存率。1.5%工布乌头提取物组的生存率与对照组相似,没有明显改善。此结果说明,1.0%工布乌头提取物可以明显减缓致炎因子引起的肠道损伤,并能够有效提高果蝇生存率。后续实验均考察1.0%工布乌头提取物对其他指标的影响。
 |
与对照组比较:***P<0.001 ***P < 0.001 vs control group 图 1 工布乌头提取物对致炎因子SDS (A)、DSS (B)、H2O2 (C) 和PQ (D) 处理果蝇生存率的影响Fig.1 Effect of A. kongboense extract on survival rate of D. melanogaster treated with SDS(A), DSS (B), H2O2 (C), and PQ (D) |
孵化3~4 d的雌果蝇,经0.6% SDS溶液处理96 h后分离肠道,利用7-AAD染色分析肠道上皮细胞凋亡数量。结果表明,对照组果蝇的肠道上皮出现大量凋亡细胞(红色标记细胞),而喂食1.0%工布乌头提取物的果蝇肠道上皮细胞凋亡数量明显减少(图 2)。说明工布乌头提取物能减缓SDS诱导的肠道上皮细胞凋亡,从而保护肠道过度损伤。
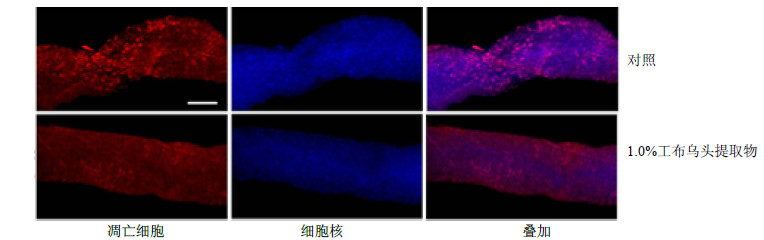 | 图 2 工布乌头提取物对SDS处理果蝇肠道上皮细胞凋亡的影响Fig.2 Effectsof A. kongboenseextract on apoptosis of intestinal epithelial cells in D. melanogaster treated with SDS |
以1.0%SDS处理果蝇48 h,利用DHE进行染色分析肠道内ROS的量。结果显示,经致炎因子处理后,对照组果蝇的中后肠出现了大量的ROS,而喂食1.0%工布乌头提取物的果蝇,肠道内ROS量与对照组相比明显减少(图 3)。说明工布乌头提取物能够降低肠道内过量的ROS,从而避免肠道氧化应激造成的细胞损伤。
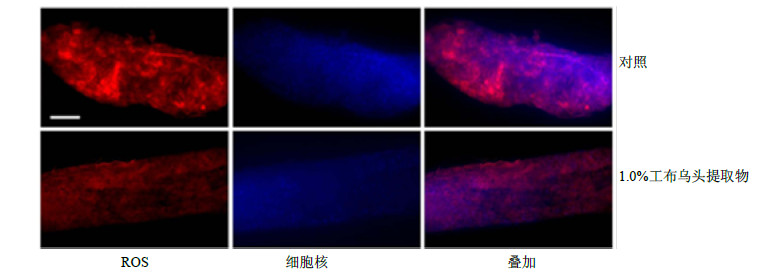 | 图 3 工布乌头提取物对SDS处理果蝇肠道上皮细胞内ROS水平的影响Fig.3 Effectsof A. kongboenseextract on ROS level in intestinal epithelial cells of D. melanogaster treatedwith SDS |
果蝇通过肠道干细胞和成肠细胞的增殖、分化补充肠道上皮细胞因凋亡和受损而减少的细胞,从而维持肠道细胞的稳态。但肠道干细胞过度增殖会导致肠道中未分化的成肠细胞大量积累,破坏肠道稳态,进而对机体产生不利影响[10]。为分析工布乌头提取物对肠道上皮细胞和成肠细胞增殖、分化的影响,本实验利用携带绿色荧光蛋白报告基因的果蝇,喂食0.6% SDS 16 h后分离肠道进行分析。结果表明,与对照组相比,喂食1.0%工布乌头提取物的果蝇的肠道干细胞和成肠细胞明显减少(图 4),可以较好地抵御干细胞及成肠细胞的过度增殖。
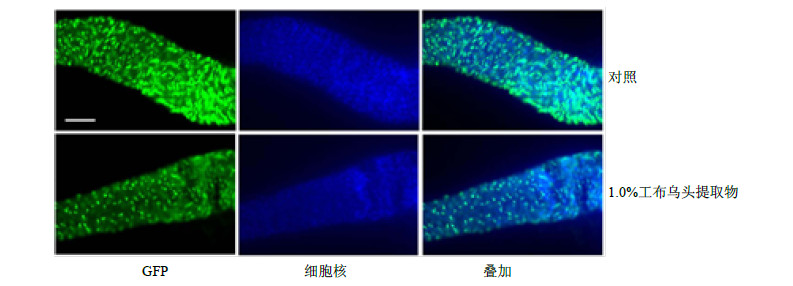 | 图 4 工布乌头提取物对SDS处理果蝇肠道干细胞和成肠细胞数量的影响Fig.4 Effects of A. kongboenseextract on numbers of intestinal epithelial cells of D. melanogaster treatedwith SDS |
肠道上皮细胞凋亡及过量ROS的沉积可能会导致肠道形态发生变化。为进一步分析工布乌头提取物对肠道损伤的缓解作用,对照组和加入1.0%工布乌头提取物的实验组雌果蝇,分别用0.6% SDS溶液处理96 h后分离肠道,在显微镜下拍照。结果(图 5)表明,对照组果蝇肠道由于上皮细胞的大量凋亡,导致肠道长度明显缩短,而1.0%工布乌头组果蝇肠道长度是对照组的2倍左右;并且对照组果蝇的中后肠可以观察到明显的黑色素瘤,但1.0%工布乌头提取物组没有出现黑色素瘤。说明工布乌头提取物对肠道损伤具有较好的保护作用。
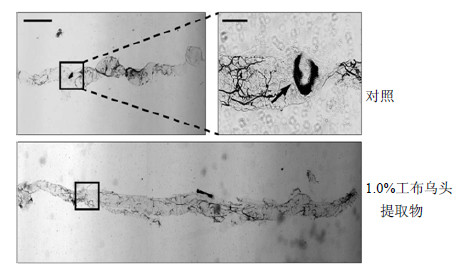 | 图 5 工布乌头提取物对SDS处理果蝇肠道形态的影响Fig.5 Effects of A. kongboense extracton intestinal morphology of D. melanogaster treated with SDS |
乌头属植物作为一种有毒的药用植物在我国一直受到广泛关注,被应用于许多疾病的临床治疗,并获得了较好的治疗效果[11],但是目前对工布乌头的药理研究报道比较少。工布乌头提取物中包括9种生物碱[7],其中乌头碱具有多种药理作用,包括抗炎、强心、镇痛、活血、调节免疫以及抗肿瘤等活性[12]。本实验选取采自西藏的工布乌头作为实验材料,利用模式生物果蝇对其药理作用进行了较详细地分析。果蝇作为一种广泛应用的模式生物没有类似于人的获得性免疫系统,抵制病原菌的入侵依赖于先天性免疫系统。其中肠道是抵御病原微生物入侵的第一道防线,许多疾病的发生都是从肠道开始。而果蝇与人类的肠道结构、功能和干细胞分化机制十分相似[13,14]。所以,可利用模式生物果蝇来研究提高肠道免疫功能相关的药用植物及其次生代谢产物。
本实验通过喂食致炎因子建立果蝇肠道功能损伤模型,观察其生存率、肠道上皮细胞凋亡、肠道细胞内ROS的量、肠道干细胞分化、肠道内黑色素瘤的产生及形态变化来研究藏药工布乌头对果蝇肠道免疫功能的影响。本实验以10%刺五加果实提取物为阳性对照,分别选取0.5%、1.0%和1.5%工布乌头提取物为实验组分析了果蝇生存率。结果表明,针对SDS、PQ等致炎因子诱导的损伤,1.0%工布乌头提取物有效地提高了果蝇的生存率,并且减少了经SDS诱导后的肠道上皮细胞凋亡数量和肠道上皮细胞内ROS量。喂食SDS时肠道内产生大量的ROS,过量的ROS导致肠道上皮细胞过度分化和趋向死亡,工布乌头提取物中可能含有某种抗氧化物,能够有效地清除肠道内ROS,从而有效地保护肠道免受损伤。工布乌头作为一种有毒的藏药,喂食较高浓度的工布乌头提取物时果蝇出现生长速度缓慢、后代较少等影响正常生长发育的现象。野生型果蝇在质量分数为1.5%的工布乌头提取物培养基中的生长速度比正常培养基中的生长速度稍慢,可能是工布乌头的毒性抑制其生长,所以不能明显提高4种致炎因子处理后果蝇生存率。然而,野生型果蝇在质量分数为1.0%的工布乌头提取物培养基中的生长速度及状态与正常培养基相似。
综上所述,工布乌头作为一种有毒的藏药,低质量浓度的工布乌头提取物具有提高果蝇肠道免疫功能的作用,对致炎因子诱导的肠道损伤具有较好的保护作用,其具体作用机制有待在其他动物模型上加以研究验证。
| [1] | Ferrandon D. The complementary facets of epithelial host defenses in the genetic model organism Drosophila melanogaster:from resistance to resilience[J]. Curr Opin Immunol, 2013, 25(1):59-70. |
| [2] | 郝阳光, 张玮钰, 金丽华. 果蝇肠道免疫的研究进展[J]. 免疫学杂志, 2013, 29(9):813-817. |
| [3] | Kim S H, Lee W J. Role of DUOX in gut inflammation:lessons from Drosophila model of gut-microbiota interactions[J]. Front Cell Infect Microbiol, 2014. doi:10.3389/fcimb.2013.00116. |
| [4] | Li W J, Luo Q X, Jin L H. Acanthopanax senticosus extracts have a protective effect on Drosophila gut immunity.[J]. J Ethnopharmacol, 2013, 146(1):257-263. |
| [5] | Wolf M J, Amrein H, Izatt J A, et al. Drosophila as a model for the identification of genes causing adult human heart disease[J]. Proc Natl Acad Sci USA, 2006, 103(5):1394-1399. |
| [6] | 周洋, 柳宗琳, 陈羽臣, 等. 瓜蒌、红花、川芎和菊花提取物对氧化应激诱导的果蝇肠道免疫的影响[J]. 中草药, 2014, 45(15):2194-2200. |
| [7] | 王若丁, 王超. 工布乌头中三种生物碱HPLC法测定优化[J]. 黑龙农业科学, 2014(1):106-109. |
| [8] | 阿萍, 王锋鹏. 工布乌头中生物碱成分研究[J]. 天然产物研究与开发, 2002, 14(5):37-39. |
| [9] | 李文佳, 刘强, 金丽华. 刺五加提取物对果蝇免疫功能的影响[J]. 中草药, 2012, 43(10):1997-2001. |
| [10] | Biteau B, Hochmuth C E, Jasper H. JNK activity in somatic stem cells causes loss of tissue homeostasis in the aging Drosophila gut[J]. Cell Stem Cell, 2008, 3(4):442-455. |
| [11] | 李志勇, 李彦文. 乌头属植物在少数民族医药中的应用[J]. 中央民族大学学报:自然科学版, 2010, 19(2):72-74. |
| [12] | 杨姝, 金振辉. 乌头属植物的化学成分及药理作用的研究进展[J]. 云南农业大学学报, 2007, 22(2):293-295. |
| [13] | Kuraishi T, Hori A, Kurata S. Host-microbe interactions in the gut of Drosophila melanogaster.[J]. Front Physiol, 2013, 17(4):375. |
| [14] | Buchon N, Broderick N A, Poidevin M, et al. Drosophila intestinal response to bacterial infection:activation of host defense and stem cell proliferation[J]. Cell Host Microbe, 2009, 5(2):200-211. |
 2016, Vol. 47
2016, Vol. 47


