2. 广中医药大学基础医学院, 广东 广州 510000
2. College of Basic Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510000, China
肺癌为临床常见肿瘤,也是引起肿瘤患者死亡的常见原因。肺癌患者在确诊时很多已属晚期,能手术的病例较少,往往以放疗及化疗为主,预后较差,约80%病人在诊断后1年内死亡[1],中晚期肺癌的治疗目前主张多方法综合治疗。中西医结合及中医药治疗肺癌,已显示其在减少毒副反应、改善症状、稳定病灶、提高生存质量、延长生存期和提高生存率等方面优势[2]。目前,中医对肺癌病因病机的认识有“正气虚损学说”“邪毒侵肺论”“痰湿内聚论”3种学说。临床采用扶正培本和清热解毒,软坚化痰,活血化瘀酌情伍用治法,取得了较好的疗效[2]。
在众多治疗肺癌的复方中,猪苓为常用药物[3, 4]。猪苓多糖(polyporus polysaccharide,PPS)为猪苓的主要成分,现代药理研究表明,PPS具有增强免疫、抗肿瘤等多种功能[5],体内外实验均表明,PPS对肺癌细胞有抑制作用[6],但其作用机制尚不清楚。本实验拟观察PPS对肺癌A549细胞增殖的作用,并初步探讨其相关的分子生物学机制。
1 材料 1.1 细胞株肺癌A549细胞株购自中山大学生物细胞库。
1.2 药品和试剂PPS购自南京泽朗生物科技有限公司,质量分数为95%,批号为ZL2015050651。胎牛血清、RPMI 1640培养基、0.25%胰酶-EDTA消化液均购自美国Gibco公司;实时荧光定量PCR(qRT-PCR)试剂盒、逆转录试剂盒、蛋白酶抑制剂、RIPA缓冲液均购自德国Roche公司,四甲基偶氮唑蓝(MTT)购自美国Sigma公司,兔抗人Cyclin D1抗体、兔抗人人抗原R(HuR)抗体、兔抗人β-actin抗体、兔抗人α-tubulin抗体、Lanin B1抗体、HRP标记抗兔抗体均购自美国CST公司;Western blotting所用试剂购自美国Bio-Rad公司。
1.3 仪器酶标仪,美国Perkin Elmer公司;FC500流式细胞仪,美国Beckman Coulter公司;电泳及转印系统、凝胶成像系统,美国Bio-Rad公司;7500实时荧光定量基因扩增系统,美国ABI公司。
2 方法 2.1 细胞培养及分组A549细胞常规培养在含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640培养液中,置37 ℃、5% CO2培养箱中培养。实验分4组,对照组(正常培养的细胞,未做任何处理)和PPS低、中、高剂量(50、100、200 μg/mL)组。
2.2 MTT法检测细胞增殖取对数生长期A549细胞,用培养基制成单细胞悬液,调整细胞浓度为3×104/mL,接种于96孔,每孔100 μL,培养24 h后,各实验组加入相应量的药物和培养基至每孔液体总量为20 μL,实验设6个复孔,继续培养24、48、72 h后,各孔分别加入MTT(5 mg/mL)20 μL,继续培养4 h,弃培养上清,每孔加入二甲基亚砜(DMSO)150 μL,震荡待结晶溶解后酶标仪上检测490 nm波长下的吸光度(A)值。
2.3 流式细胞术检测细胞周期各组细胞常规培养48 h后,收集细胞到离心管中离心,应用预冷的PBS洗涤收集的细胞3次,离心沉淀细胞,弃上清。以70%预冷的乙醇重悬细胞,吹打均匀,4 ℃储存过夜;离心乙醇固定过的细胞,弃上清,PBS洗涤细胞3次以去除残留的乙醇。应用细胞周期检测试剂重悬细胞,常温避光染色30 min,应用流式细胞仪测定细胞周期。计算增殖指数。
增殖指数=(G2/M+S)/(G0/G1+S+G2/M)
2.4 Western blotting法分析Cyclin D1蛋白表达A549细胞接种于6孔板,常规培养后于对数生长期分别加入不同质量浓度(50、100、200 μg/mL)的PPS培养48 h;收集细胞后用RIPA提取细胞总蛋白,BCA法测定蛋白浓度,100 ℃变性8 min,SDS-PAGE蛋白电泳,后将蛋白转至PVDF膜,室温封闭1 h后用一抗4 ℃孵育过夜,TBST缓冲液洗涤3次,二抗室温孵育1 h,洗涤后以ECL化学发光法于凝胶成像系统进行检测。
2.5 qRT-PCR法检测Cyclin D1 mRNA水平细胞分组及培养方法同“2.4”项;用Trizol抽提细胞总RNA,按Roch试剂盒操作说明逆转录cDNA。Cyclin D1上游引物:5’-GGGCAGCAGAA- GCGAGAG-3’,下游引物:5’-GTTCCTCGCAG- ACCTCCAG-3’。以β-actin为内参,其上游引物:5’-GTGGGGTGGCTTTTAGGATGG-3’,下游引物:5’-TCACAATGTGGCCGAGGACTTT-3’。qRT-PCR扩增条件为:95 ℃、10 min;95 ℃、15 s,60 ℃、60 s,循环40次;扩增完毕后进行熔解曲线分析。
2.6 Cyclin D1 mRNA稳定性的检测细胞分组及培养方法同“2.4”项;将放线菌素D以DMSO溶解后,加入培养基内,使放线菌素D的终质量浓度为5 ng/mL,给予放线菌素D处理后的0、2、4、6 h时间点分别收集细胞,提取RNA,以qRT-PCR法检测Cyclin D1的mRNA的水平,设定各组细胞0 h mRNA的量为100%,计算各组细胞2、4、6 h各时间点相对该组0 h的mRNA量的比值,绘制各组Cyclin D1 mRNA的降解拟合曲线,比较各组细胞Cyclin D1 mRNA的稳定性[5]。
2.7 胞浆、胞核中HuR蛋白表达的检测各实验组细胞经不同质量浓度(50、100、200 μg/mL)PPS处理24 h后,弃去培养基,以预冷的PBS缓冲液清洗细胞2次。以细胞刮收集细胞至离心管,离心,弃上清,按胞核-胞浆蛋白提取试剂盒说明分别提取胞浆蛋白和胞核蛋白。用Western blotting法检测总的、胞浆和胞核HuR的蛋白表达,具体操作方法同“2.4”项。
2.8 统计学方法用SPSS 17.0软件进行统计分析,计量资料用x±s表示,组间比较采用单因素方差分析;对于各组细胞Cyclin D1 mRNA稳定性比较,采用重复测量资料的方差分析。
3 结果 3.1 PPS对A549细胞增殖的抑制作用A549细胞在不同质量浓度PPS分别作用24、48、72 h后,用MTT检测A549细胞的增殖,与对照组相比,50 μg/mL PPS组与对照组测得的A值在各个时间点上均没有显著差异(P>0.05),100、200 μg/mL PPS组在24、48、72 h各时间点均能明显抑制A549细胞的增殖(P<0.05)。结果见图 1。
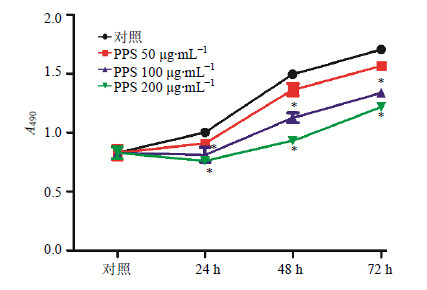 |
与对照组比较:*P<0.05,下同 *P < 0.05 vs control group,same as below 图 1 PPS对A549细胞增殖的影响 (x±s,n = 6)Fig.1 Effect of PPS on proliferation of A549 cells (x±s,n = 6) |
细胞在不同质量浓度PPS分别作用48 h后,流式细胞仪检测显示,中、高剂量PPS组A549细胞的增殖指数降低(P<0.05)。结果见图 2。
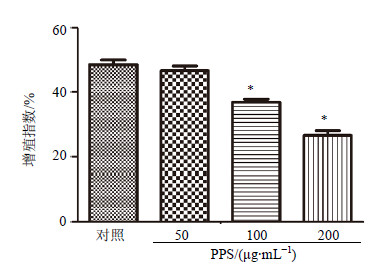 | 图 2 PPS对A549细胞增殖指数的影响(x±s,n = 3)Fig.2 Effect of PPS on proliferation index of A549 cells(x±s,n = 3) |
qRT-PCR检测显示,与对照组比较,不同质量浓度PPS作用于A549细胞48 h后,PPS低剂量组与对照组Cyclin D1 mRNA表达无显著差异,PPS中、高剂量组Cyclin D1 mRNA表达明显减少(P<0.05)。结果见图 3。
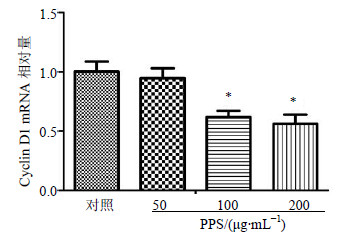 | 图 3 PPS对A549细胞Cyclin D1 mRNA表达的影响(x±s,n = 3) Fig.3 Effect of PPS on expression of Cyclin D1 mRNA in A549 cells (x±s,n = 3) |
Western blotting检测显示,与对照组比较,不同质量浓度PPS作用于A549细胞48 h后,PPS低剂量组与对照组Cyclin D1蛋白表达没有显著差异,PPS中、高剂量组Cyclin D1蛋白表达明显减少(P<0.05)。结果见图 4。
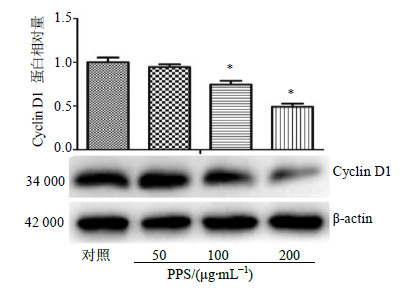 | 图 4 PPS对A549细胞Cyclin D1蛋白表达的影响 (x±s,n = 3)Fig.4 Effect of PPS on expression of Cyclin D1 protein in A549 cells (x±s,n = 3) |
分别于放线菌素D处理0、2、4、6 h检测Cyclin D1 mRNA的量,绘制衰减曲线,与对照组比较,PPS低剂量组与对照组Cyclin D1 mRNA稳定性没有明显差别,PPS中、高剂量组Cyclin D1 mRNA稳定性明显下降(P<0.05)。
 | 图 5 PPS对A549细胞Cyclin D1 mRNA稳定性的影响(x±s,n = 3) Fig.5 Effect of PPS on stability of Cyclin D1 mRNA in A549 cells (x±s,n = 3) |
不同质量浓度PPS作用于A549细胞48 h后,各组细胞总HuR蛋白比较,差异不显著(P>0.05);与对照组比较,50 μg/mL PPS组胞浆HuR蛋白无明显变化,100、200 μg/mL PPS组胞浆HuR蛋白表达明显减少(P<0.05);与对照组比较,50 μg/mL PPS组胞核HuR蛋白无明显变化,100、200 μg/mL PPS组胞核HuR蛋白表达明显增加(P<0.05),见图 6。
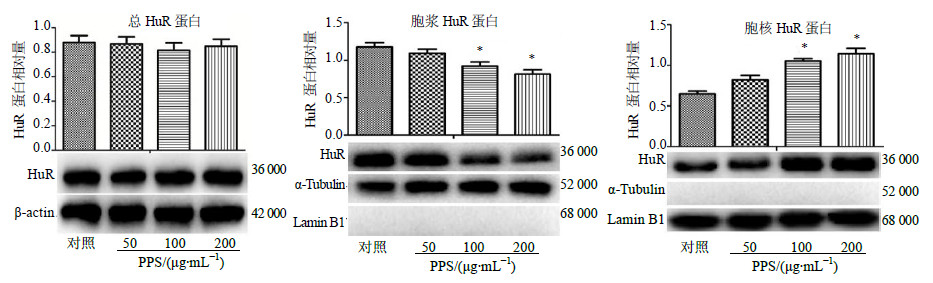 | 图 6 PPS对A549细胞HuR蛋白亚细胞定位的影响 (x±s,n = 3)Fig.6 Effect of PPS on subcellular distribution of HuR protein in A549 cells (x±s,n = 3) |
细胞增殖是由于细胞生长和细胞分裂而导致细胞数目的增加,真核细胞的细胞周期分为间期和分裂期,间期又分为G1期、S期、G2期。本实验通过MTT研究显示,PPS可抑制A549细胞的增殖;流式细胞周期分析也显示PPS可抑制A549细胞的增殖指数,中、高剂量PPS组细胞G1期比例明显升高(P<0.05),而G2期和S期细胞比例明显降低(P<0.05),增殖指数明显下降(P<0.05),提示PPS可抑制A549细胞G1期向S期转换。
在真核细胞细胞周期的调控中,Cyclin D1是调控G1期向S期转化的重要蛋白,能和细胞周期依赖激酶形成蛋白复合体,最终使细胞通过G1/S控制点,进入DNA合成的S期。研究表明,Cyclin D1基因是一种原癌基因,在多种肿瘤中发现了Cyclin D1基因表达升高,包括肺癌、乳腺癌、膀胱癌、甲状旁腺癌等。本研究显示,中、高剂量的PPS可降低A549细胞Cyclin D1 mRNA的量,也可降低Cyclin D1蛋白的表达。因此推测PPS抑制A549细胞增殖的作用可能与其降低Cyclin D1蛋白的表达有关。
mRNA是蛋白质生物合成的模板,在真核生物基因表达的转录后水平调控中,mRNA稳定性起重要作用,其机制主要通过影响mRNA的降解速率影响蛋白质的翻译效率。放线菌素D是一种最常用的基因转录抑制剂[6],能嵌合于DNA双链内与鸟嘌呤基团结合,抑制DNA依赖的RNA聚合酶活力,干扰细胞的转录,从而抑制mRNA合成。放线菌素D抑制了DNA的转录为mRNA的过程,则mRNA的水平只与mRNA的降解速度有关,此时mRNA降解的速度可反映其稳定性。本实验研究表明,中、高剂量PPS组细胞的Cyclin D1 mRNA的稳定性较对照组细胞明显降低,与之相应的Cyclin D1 mRNA的水平及Cyclin D1蛋白表达量下降,推测PPS导致的Cyclin D1 mRNA的稳定性下降减少了用于翻译的mRNA的模板量,最终使Cyclin D1蛋白表达水平降低。
真核生物的RNA转录在细胞核内完成,而翻译合成蛋白质在胞质中完成,故合成的mRNA需要转运至胞质合成蛋白质,在此过程中,mRNA常受到核酸酶的破坏而降解。在此过程中,ARE(AU-rich element)结构很重要。ARE是位于mRNA 3’端非翻译区(3’-untranslated regions,3’-UTR)的一类十分重要的顺式调控元件,常见的有UUAUUUAUU和AUUUA重复序列2种形式[7]。HuR是一个重要的RNA结合蛋白,与mRNA有高度亲和性,直接或间接结合ARE结构而调控mRNA的降解[8, 9, 10]。HuR可在细胞核和细胞浆之间穿梭,静息状态下HuR多定位于核内,在细胞外信号作用下,胞浆中HuR蛋白量增高,并通过RNA识别基序(RRM)与多种mRNA 3’-UTR的ARE结合,使mRNA在由胞核转运至胞浆的过程中免受核酸酶降解,从而增加mRNA稳定性[11, 12, 13]。Cyclin D1 mRNA的3’-UTR含有较多的ARE结构,目前已发现胞浆HuR可参与Cyclin D1 mRNA稳定性的调控[13, 14, 15]。
本实验研究表明,PPS作用于A549细胞时,胞核内的HuR水平升高、胞浆内HuR水平降低,细胞内总的HuR蛋白没有明显变化,故PPS可以改变HuR在细胞内的定位。而胞浆HuR水平对Cyclin D1 mRNA稳定性起重要作用,本实验中,PPS作用后A549细胞胞浆HuR水平下降,Cyclin D1 mRNA的稳定性也下降,提示二者之间的相关性,即在PPS作用后,Cyclin D1 mRNA的稳定性下降可能是由于胞浆HuR水平的下降引起。而Cyclin D1 mRNA的稳定性下降最终导致Cyclin D1蛋白的表达量下降及细胞增殖的抑制。
综上所述,本研究结果证实PPS可以抑制A549细胞的增殖,此作用可能是因为PPS减少HuR在A549细胞胞浆内表达,降低Cyclin D1 mRNA的稳定性和Cyclin D1蛋白表达而引起。然而,mRNA的稳定性受到多种因素的调节,要想肯定PPS通过改变HuR在细胞内定位而降低Cyclin D1 mRNA的稳定性之间的相关性,还需要通过免疫共沉淀等方法确定其二者之间的关系,本课题组将继续深入研究。
| [1] | Siegel R L, Miller K D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2015, 65(1):5-29. |
| [2] | 刘嘉湘. 肺癌的中医学治疗进展[J]. 中国肿瘤, 2002, 11(6):326-329. |
| [3] | 李向晖. 中西医结合治疗晚期非小细胞肺癌临床观察[J]. 新中医, 2015, 47(7):129-131. |
| [4] | 嵇冰, 周维顺, 张峰. 周维顺教授治疗肺癌经验拾萃[J]. 中华中医药学刊, 2015, 33(3):639-641. |
| [5] | 李心群, 许文. 猪苓多糖通过Toll样受体4对小鼠骨髓来源树突状细胞作用研究[J]. 中草药, 2011, 42(1):118-123. |
| [6] | Wu H, Zhu H, Li X, et al. Induction of apoptosis and cell cycle arrest in A549 human lung adenocarcinoma cells by surface-capping selenium nanoparticles:an effect enhanced by polysaccharide-protein complexes from Polyporus rhinocerus[J]. J Agric Food Chem, 2013, 61(41):9859-9866. |
| [7] | He Y, Zhang X, Zeng X, et al. HuR-mediated posttranscriptional regulation of p21 is involved in the effect of Glycyrrhiza uralensis licorice aqueous extract on polyamine-depleted intestinal crypt cells proliferation[J]. J Nutr Biochem, 2012, 23(10):1285-1293. |
| [8] | Mochizuki U, Murphy C J, Brandt J D, et al. Altered stability of mRNAs associated with glaucoma progression in human trabecular meshwork cells following oxidative stress[J]. Invest Ophthalmol Vis Sci, 2012, 53(4):1734-1741. |
| [9] | Sun W, Song L, Ai T, Zhang Y, et al. Prognostic value of MET, cyclin D1 and MET gene copy number in non-small cell lung cancer[J]. J Biomed Res, 2013, 27(3):220-230. |
| [10] | Takeuchi O. HuR keeps interferon-β mRNA stable[J]. Eur J Immunol, 2015, 45(5):1296-1299. |
| [11] | Khabar K S. Post-transcriptional control during chronic inflammation and cancer:a focus on AU-rich elements[J]. Cell Mol Life Sci:CMLS, 2010, 67(17):2937-2955. |
| [12] | Barreau C, Paillard L, Osborne H B. AU-rich elements and associated factors:are there unifying principles?[J]. Nucl Acids Res, 2005, 33(22):7138-7150. |
| [13] | Kakuguchui W, Kitamura T, Kuroshima T, et al. HuR knockdown changes the oncogenic potential of oral cancer cells[J]. Mol Cancer Res:MCR, 2010, 8(4):520-528. |
| [14] | Nguyen-Chi M, Morello D. Aberrant regulation of mRNA 3' untranslated region in cancers and inflammation[J]. Med Sci, 2008, 24(3):290-296. |
| [15] | Briata P, Ilengo C, Corte G, et al. The Wnt/beta-catenin-Pitx2 pathway controls the turnover of Pitx2 and other unstable mRNAs[J]. Mol Cell, 2003, 12(5):1201-1211. |
 2016, Vol. 47
2016, Vol. 47


