2. 上海市中医临床重点实验室, 上海 201203;
3. 上海高校中医内科学E-研究院, 上海 201203
2. Shanghai Key Laboratory of Traditional Chinese Clinical Medicine, Shanghai 201203, China;
3. E-institute of TCM Internal Medicine, Shanghai Municipal Education Commission, Shanghai 201203, China
肝纤维化是多种慢性肝病的共同病理过程,以细胞外基质(ECM)成分的过度增生与异常沉积为特征。近年研究发现,肝脏血管新生是肝纤维化的重要病理特点[1],也是门脉高压发生、发展的病理机制[2, 3],更重要的是,血管新生是肝纤维化难以逆转的重要原因[4],其中肝窦内皮细胞是肝纤维化血管新生的关键细胞学基础。
丹参始载于《神农本草经》,具有活血散瘀、通经止痛、宁心安神等功效[5]。现代药理学研究发现,丹参在治疗慢性肝病,尤其是抗肝纤维化方面有很好的疗效[6]。同时研究也表明丹参对肿瘤及缺血性疾病的血管新生具有干预作用[7]。丹参成分包括水溶性和脂溶性两大类,其中水溶性成分主要为酚酸类化合物,包括丹参素钠、丹酚酸A、丹酚酸C、迷迭香酸、咖啡酸、丹酚酸B等,研究证实丹参对急慢性肝损伤有治疗作用[8]。本研究通过观察丹参水溶性成分对人肝窦内皮细胞增殖、转基因斑马鱼及鸡胚血管生成的影响,评价丹参水溶性成分抑制肝窦内皮细胞功能及血管新生的活性。
1 材料 1.1 药物丹参素钠、丹酚酸A、丹酚酸B、丹酚酸C、咖啡酸、迷迭香酸,由上海融禾医药科技发展有限公司分离、提取、鉴定,质量分数>98%;甲苯磺酸索拉非尼片(简称索拉菲尼,商品名多吉美),购自Bayer公司,质量分数>98%,批号PY595112。CCK-8检测试剂盒,上海翊圣生物科技有限公司。
1.2 试剂内皮细胞培养基、胎牛血清(FBS)、内皮细胞生长补充因子(ECGS),购自ScinecellTM公司;二甲基亚砜(DMSO)购自国药集团化学试剂有限公司;CD31,购自Abcam公司;EdU细胞增殖试剂盒,购自广州锐博生物科技有限公司;NO荧光探针、NOS试剂盒,购自碧云天生物技术研究所。
1.3 实验对象人来源的肝窦状内皮细胞HHSEC细胞株,上海中医药大学附属曙光医院肝病研究所长期保存,以含5% FBS的内皮细胞培养液培养,每3天传代1次。斑马鱼购自山东省科学院,鸡胚购自上海市农业科学院。
1.4 主要仪器Olympus IX70倒置显微镜(日本Olympus);Image-pro Plus 6.1图像分析软件(美国Media Cybernetics公司);ArrayScan® VTI 高内涵筛选分析仪(美国Thermo Scientific);微孔板扫描分光光度计(美国Bio-Tek);Thermo Scientific Varioskan Flash光谱扫描多功能读数仪(美国Thermo Scientific)。
2 方法 2.1 HHSEC细胞增殖实验 2.1.1 CCK-8法确定各成分的无毒浓度按每孔7 500个HHSEC细胞接种于96孔板,长至亚单层,弃原培养液。6种丹参主要水溶性成分以含5% FBS的内皮细胞培养液稀释成5~160 μmol/L添加至HHSEC细胞,同时设正常培养液作为对照组,设4个复孔,孵育48 h。弃原培养液,添加CCK-8工作液,100 μL/孔,再孵育2 h,于波长450 nm处微孔板扫描分光光度计测定各孔吸光度(A)值。分别与对照组进行比较,以各药物组与对照组A值有显著差异(P<0.05)的相应浓度为有毒浓度,从而确定各成分无毒浓度。丹酚酸A、丹酚酸C、丹参素钠、咖啡酸、迷迭香酸、丹酚酸B浓度分别在12.5、100、25、50、50、12.5 μmol/L以下时对HHSEC细胞活力无显著影响。
2.1.2 CCK-8法检测各成分对ECGS诱导HHSEC细胞活力的影响以每孔7 500个HHSEC细胞接种于96孔板,待细胞长至亚单层,在无毒浓度范围内,分别选择丹酚酸A 10 μmol/L、丹酚酸C 80 μmol/L、丹参素钠20 μmol/L、咖啡酸40 μmol/L、丹酚酸B 10 μmol/L、迷迭香酸40 μmol/L(各成分对细胞无毒浓度的0.8倍)及阳性对照索拉非尼5 μmol/L与2%ECGS共同孵育48 h诱导细胞增殖,以正常培养基为对照组,单独ECGS作用为模型组。按照“2.1.1”项方法测定各组A值。
2.1.3 EdU法检测各成分对ECGS诱导HHSEC细胞增殖的影响细胞接种及分组给药同“2.1.2”项。细胞经药物处理48 h后,弃原培养液,加入50 μmol/L EdU溶液孵育2 h,4%多聚甲醛固定15 min,0.2%甘氨酸孵育10 min,PBS洗5 min×2次,0.5% Triton X-100透化10 min,PBS洗5 min,Appllo®染色反应液避光孵育30 min,PBS洗5 min×3次,Hoechst避光孵育10 min,PBS洗5 min×2次,ArrayScan® VTI高内涵筛选分析仪检测各组细胞荧光强度。
2.1.4 荧光探针法检测细胞内NO和NOS水平(1)NO水平检测:细胞接种及分组给药同“2.1.2”项。细胞经药物处理48 h后,弃药物培养液,原位装载5 μmol/L DAF-FM DA(NO探针),100 μL/孔,37 ℃培养箱内孵育20 min,PBS洗3次,Thermo Scientific Varioskan Flash光谱扫描多功能读数仪上检测各组细胞荧光强度,使用495 nm激发波长,515 nm发射波长。(2)NOS活性检测 细胞接种及分组给药同“2.1.2”项。细胞经药物处理48 h后,弃原培养液,加入100 μL NOS检测缓冲液,加入100 μL检测反应液,37 ℃细胞培养箱内孵育2 h,PBS洗3次,Thermo Scientific Varioskan Flash光谱扫描多功能读数仪上检测,使用495 nm激发波长,515 nm发射波长。
2.1.5 免疫荧光法检测细胞CD31表达细胞接种及分组给药同“2.1.2”项,细胞经药物处理48 h后,弃原培养液,多聚甲醛固定15 min,PBS洗涤2次,2.5%小牛血清白蛋白室温封闭1 h,一抗37 ℃孵育60 min,PBS洗涤3次,相应的荧光二抗37 ℃孵育1 h,DAPI染核5 min,PBS洗涤3次,高内涵分析[9]。
2.2 鸡胚绒毛尿囊膜实验种蛋大头朝上,无菌培养箱孵育72 h,温度37.8 ℃,湿度60%。眼科剪在种蛋大头打孔,10 mL无菌注射器吸取蛋清4~6 mL,弃去。在种蛋中间位置开口,加100 μmol/L的各药物成分(部分药物剂量高于100 μmol/L,出现鸡胚坏死,各成分浓度统一确定为100 μmol/L)100 μL,对照组加生理盐水,每组6个种蛋,透明胶带密封开窗处,继续孵育24 h,摄片,Image-pro plus 6.1图像分析软件分析血管面积。
2.3 斑马鱼血管新生实验转基因斑马鱼(VEGFR:GFP)受精卵发育24 h,移至96孔板中,每孔预加入受试样品溶液(多次实验摸索发现100 μmol/L药物浓度为斑马鱼可耐受浓度),每组5个复孔,对照为胚胎培养用水加相应量的助溶剂,加盖封闭,置于光照培养箱(28 ℃)内继续发育24 h,于倒置显微镜下观察,记录节间血管(ISV)的血流情况。麻醉,荧光显微镜下对体节间血管进行计数并拍照。
2.4 统计学处理计量资料以x±s表示,数据均使用SPSS 12.0软件进行统计学分析,组间比较使用单因素方差分析。
3 结果 3.1 对ECGS诱导的HHSEC细胞活力及增殖的影响CCK-8法检测结果(图 1)显示,丹酚酸A(10 μmol/L)、丹酚酸C(80 μmol/L)、丹酚酸B(10 μmol/L)均能显著抑制ECGS刺激的HHSEC细胞活力;丹参素钠(20 μmol/L)、咖啡酸(40 μmol/L)、迷迭香酸(40 μmol/L)无明显抑制作用。
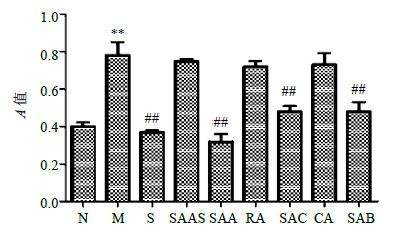 |
N-对照 M-模型 S-索拉非尼 SAAS-丹参素钠 SAA-丹酚酸A RA-迷迭香酸 SAC-丹酚酸C CA-咖啡酸 SAB-丹酚酸B,与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ## P<0.01,下同 N-control M-model S-sorafenib SAAS-Salvianic acid A sodium SAA-salvianolic acid A RA-rosmarinic acid SAC-salvianolic acid C CA-caffeic acid SAB-salvianolic acid B,*P < 0.05 **P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group,same as below 图 1 丹参水溶性成分对ECGS诱导的HHSEC细胞活力的影响(x±s, n = 4)Fig.1 Effects of water-soluble components from S. miltiorrhizaon HHSEC cells activity induced by ECGS (x±s,n = 4) |
EdU法检测细胞增殖显示,与对照组相比,模型组ECGS诱导的HHSEC细胞增殖明显;与模型组相比,索拉非尼、丹酚酸A、丹酚酸C、丹酚酸B可以明显抑制ECGS诱导的细胞增殖(图 2)。
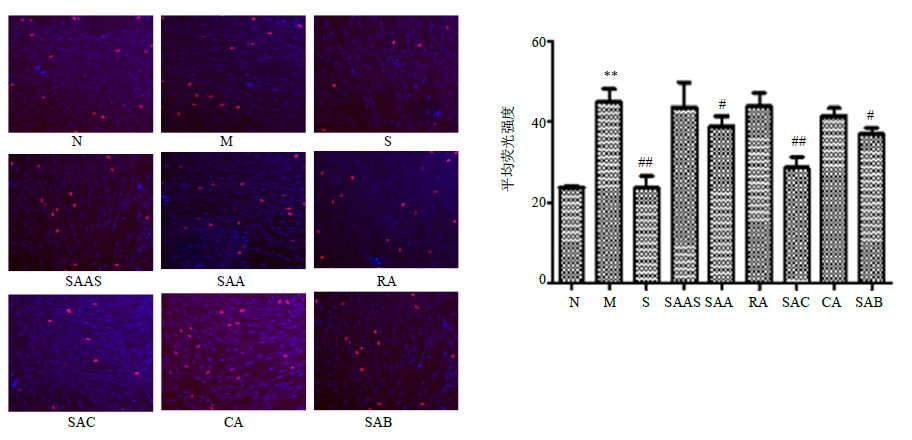 | 图 2 丹参水溶性成分对ECGS诱导的HHSEC细胞增殖的影响(x±s,n = 4) Fig.2 Effects of water-soluble components from S. miltiorrhiza on HHSEC cells proliferation induced by ECGS (x±s,n = 4) |
与对照组相比,ECGS诱导的HHSEC细胞NO水平和NOS活性明显升高;与模型组相比,索拉非尼、丹酚酸C、丹酚酸B、丹酚酸A可显著降低细胞NO量及NOS活性,其余组无显著变化(图 3)。
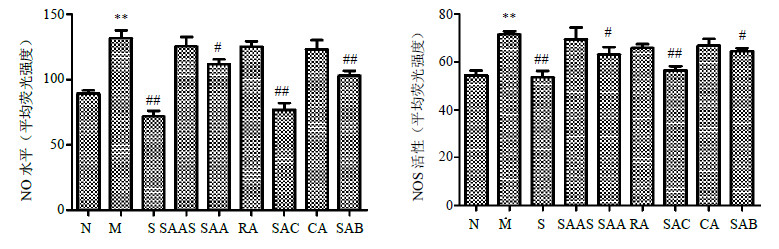 | 图 3 丹参水溶性成分对HHSEC细胞内NO水平和NOS活性的影响 (x±s,n = 4) Fig.3 Effects of water-soluble components from S. miltiorrhiza on intracellular NO level and NOS activity of HHSEC cells (x±s,n = 4) |
与对照组相比,ECGS诱导的HHSEC细胞CD31表达明显升高;与模型组相比,索拉非尼、丹酚酸A、丹酚酸C、丹酚酸B组细胞内CD31表达显著降低,其余各药物组对CD31无明显影响(图 4)。
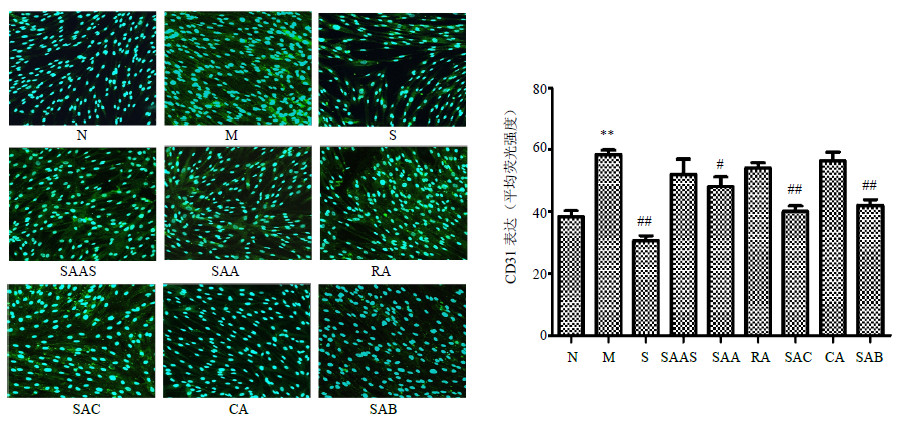 | 图 4 丹参水溶性成分对HHSEC细胞CD31表达的影响 (x±s,n = 4) Fig.4 Effectsof water-soluble components from S. miltiorrhiza on CD31 expression in HHSEC cells (x±s,n = 4) |
实验结果显示,与对照组相比,索拉非尼、丹酚酸B、丹酚酸A、咖啡酸可显著抑制鸡胚绒毛尿囊膜血管新生,其余各药物无明显作用(图 5)。
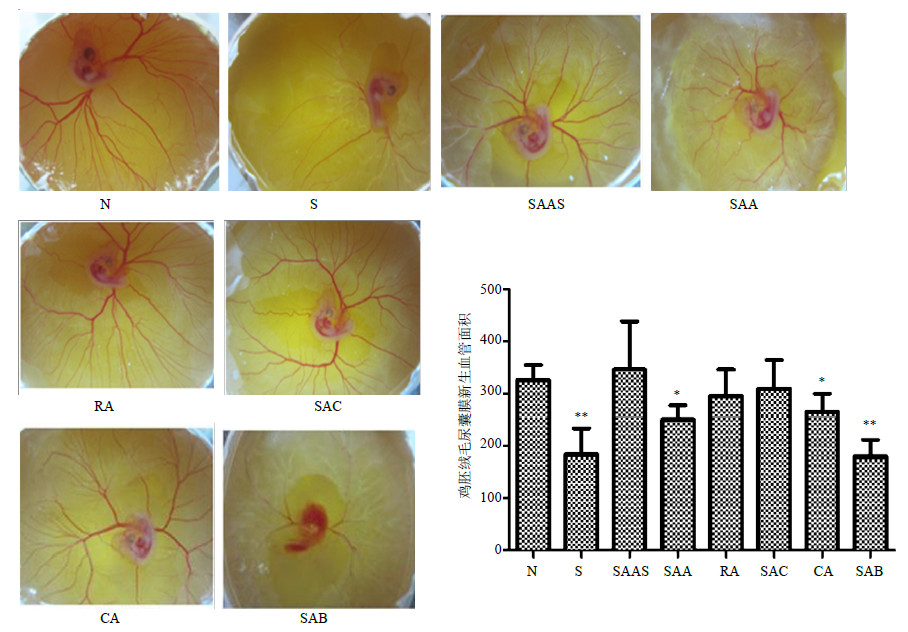 | 图 5 丹参水溶性成分对鸡胚绒毛尿囊膜血管新生的影响 (x±s,n = 6) Fig.5 Effects of water-soluble components from S. miltiorrhiza on angiogenesis in chick chorioallantoic membranes (x±s,n = 6) |
实验结果显示,与对照组相比,索拉非尼和丹酚酸C对斑马鱼功能血管具有明显的抑制作用,其余组无明显抑制作用(图 6)。
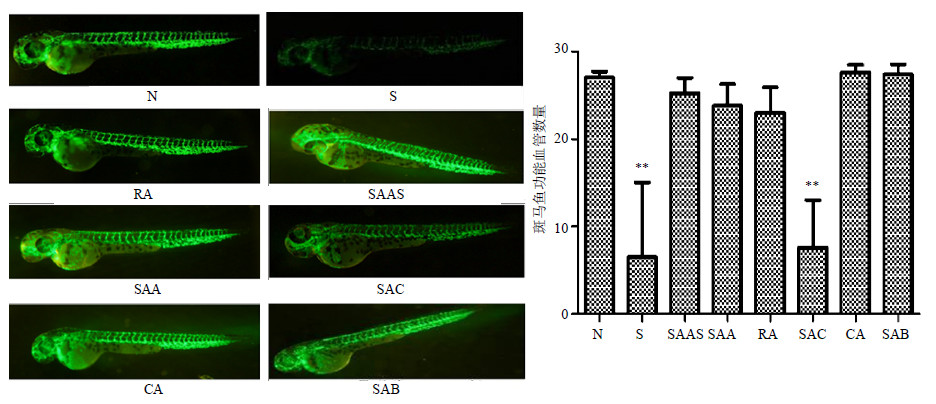 | 图 6 丹参水溶性成分对斑马鱼血管新生的影响 (x±s,n = 5) Fig.6 Effects of water-soluble components from S. miltiorrhiza on angiogenesis of transgenic zebrafish (x±s,n = 5) |
近年来,随着肝纤维化、肝硬化研究的不断深入,相关认识也发生很大变化。肝纤维化不仅存在严重程度、病理特点、分子病理机制的差异,而且存在静止性与活动性的区别。与静止性肝纤维化相比,活动性肝纤维化纤维间隔内有大量血管增生与炎性细胞浸润,这种血管新生特征明显的肝纤维化进展迅速,且难以逆转,即使纤维胶原成分被降解吸收,肝小叶结构亦难以恢复到正常状态,其危害更为严重[1, 10]。
肝脏血管结构由肝窦内皮细胞(LSECs)和周细胞组成。LSECs构成血管腔,是血管或肝窦的基础。在炎性损伤等病理情况下,LSECs可发生“去分化”表型改变:失窗孔、CD31表达增加,回到原始幼稚状态;胞内NO水平可影响细胞表型发生改变[11, 12, 13],促进血管新生的发生与发展。研究结果显示,丹酚酸A、丹酚酸C、丹酚酸B能够抑制细胞增殖;降低胞内NO水平以及NOS活性;下调HHSEC细胞CD31表达。
鸡胚绒毛尿囊膜是高度血管化了的、附着于蛋壳内面、薄而透明的膜结构,无需特别准备便能观察到其微血管结构变化,是公认的测试促进或抑制血管新生药物的试验器官[14]。斑马鱼血管以其直观性强、易于获得、重复性好且基因组与人类基因组具有高度同源性[15],逐渐被用作筛选血管活性药物的模型。故本研究采用这两个模型,从器官和整体水平评价药物抑制血管新生的活性。结果提示,丹酚酸A、咖啡酸、丹酚酸B对鸡胚绒毛尿囊膜血管具有抑制作用;丹酚酸C能够显著抑制斑马鱼功能血管数量。
本研究采用肝窦内皮细胞增殖模型、鸡胚绒毛尿囊膜实验及转基因斑马鱼模型,从细胞、器官、整体层次评价丹参水溶性成分抑制血管新生的活性,综合不同层次实验结果,初步发现丹酚酸A、丹酚酸B、丹酚酸C具有调节内皮细胞功能、抑制血管新生的良好效果,其作用机制仍有待于后期结合体内实验进一步研究
| [1] | Coulon S, Heindryckx F, Geerts A, et al. Angiogenesis in chronic liver disease and its complications[J]. Liver Int, 2011, 31(2):146-162. |
| [2] | Fernandez M, Semela D, Bruix J, et al. Angiogenesis in liver disease[J]. J Hepatol, 2009, 50(3):604-620. |
| [3] | Rosselli M, MacNaughtan J, Jalan R, et al. Beyond scoring:a modern interpretation of disease progression in chronic liver disease[J]. Gut, 2013, 62(9):1234-1241. |
| [4] | Hu D D, Habib S, Li X M, et al. Angiogenesis:a new surrogate histopathological marker is capable of differentiating between mild and significant portal hypertension[J]. Histol Histopathol, 2015, 30(2):205-212. |
| [5] | Carmeliet P. Angiogenesis in life, disease and medicine[J]. Nature, 2005, doi:10.1038/nature04478. |
| [6] | 陶艳艳, 刘成海. 丹参及其化学成分抗肝纤维化作用机制研究进展[J]. 中西医结合学报, 2004, 2(2):145-148. |
| [7] | 王爱云, 陶丽, 陆茵, 等. 丹参干预肿瘤和缺血性疾病血管生成研究进展[J]. 中草药, 2015, 46(9):1399-1404. |
| [8] | Tsai M K, Lin Y L, Huang Y T. Differential inhibitory effects of salvianolic acids on activation of rat hepatic stellate cells by platelet-derived growth factor[J]. Planta Med, 2011, 77(13):1495-1503. |
| [9] | 闫秀川, 刘成海. 可用于中医药系统研究的药物高内涵筛选分析[J]. 中草药, 2008, 39(8):1121-1124. |
| [10] | Hu D D, Habib S, Li X M, et al. Angiogenesis:a new surrogate histopathological marker is capable of differentiating between mild and significant portal hypertension[J]. Histol Histopathol, 2015, 30(2):205-212. |
| [11] | Zhang Z, Zhang F, Lu Y, et al. Update on implications and mechanisms of angiogenesis in liver fibrosis[J]. Hepatol Res, 2015, 45(2):162-178. |
| [12] | Iwakiri Y, Grisham M, Shah V. Vascular biology and pathobiology of the liver:Report of a single-topic symposium[J]. Hepatology, 2008, 47(5):1754-1763. |
| [13] | De Leve L D. Liver sinusoidal endothelial cells in hepatic fibrosis.[J]. Hepatology, 2015, 61(5):1740-1746. |
| [14] | Medina J, Arroyo A G, Sanchez-Madrid F, et al. Angiogenesis in chronic inflammatory liver disease[J]. Hepatology, 2004, 39(5):1185-1195. |
| [15] | Ribatti D, Nico B, Vacca A, et al. Chorioallantoic membrane capillary bed:a useful target for studying angiogenesis and anti-angiogenesis in vivo[J]. Anat Rec, 2001, 264(4):317-324. |
 2016, Vol. 47
2016, Vol. 47


