蒺藜为大宗常用药材,系蒺藜科植物蒺藜Tritulus terrestris L. 的干燥成熟果实,生于沙地、荒地、山坡,全球温带广泛分布。始载于《神农本草经》,被列为上品,具有平肝解郁、活血祛风、明目之功[1],传统上用于治疗头痛眩晕、乳闭乳痈、目赤翳障。蒺藜不仅在中国有着悠久的临床应用历史,且在全球也广泛应用,但药用领域存在明显差异。欧美地区蒺藜主要用于强壮肌肉、改善性功能;而在国内,蒺藜则以治疗心血管疾病为主。这种药效的不同应与它们的物质基础差异相关。研究显示,欧洲东南部、东亚和南亚产地的蒺藜存在不同的化学型[2]。我国地域广袤,地理环境与气候条件相差甚大,生长于不同地域的蒺藜其成分可能同样存在差异。但迄今为止,国内学者主要对市场上较常见的东北、华北产地蒺藜药材化学成分进行了分析比较,而对蒺藜资源丰富且尚未被开发的新疆产区蒺藜却研究较少,故新疆产区蒺藜与市面流通的蒺藜药材化学型是否一致尚不明确[3, 4, 5]。蒺藜传统药用部位为果实,但由于“心脑舒通胶囊”成功上市且临床疗效显著,而其为蒺藜全草中提取的蒺藜总皂苷,因而蒺藜全草入药也引起研究者的广泛关注,但传统药用部位和全草两者是否可以互用,仍有待考察[6]。因此比较新疆及其他产地的蒺藜果实之间化学成分的差异,探讨蒺藜全草与果实药效物质基础的差别将为蒺藜资源合理开发及临床应用提供理论指导。
本实验应用UPLC-Q-TOF MSE技术结合多元统计分析方法开展对以新疆为主不同产地的蒺藜果实样品及蒺藜果实与全草样品的对比分析,旨在为全面合理开发利用蒺藜提供科学数据。
1 仪器与材料Waters ACQUITYTM超高效液相色谱系统(Waters公司,Milford,MA,美国);SYNAPT G1质谱系统(Waters公司,Manchester,英国);Masslynx V4.1、Markerlynx、UmetricsEZinfo 2.0软件(Waters公司,Manchester,英国);色谱柱:Acquity HSS T3 C18(100 mm×2.1 mm,1.8 μm,Waters,爱尔兰);Sartorius BP211D十万分之一电子天平;天鹏TP600超声波清洗器;SPE固相萃取柱为Cleanert ODS C18(1 000 mg/6 mL,Agela,天津);0.22 μm微孔滤膜(上海兴亚净化材料厂)。甲醇、乙腈(色谱纯,Fisher,美国);甲酸(色谱纯,Acros Co. Ltd.,NJ,美国);屈臣氏蒸馏水(广州屈臣氏蒸馏水有限公司)。其他试剂均为市售分析纯。
实验样品实地采集于新疆3个产区,共12个蒺藜样本;北京1个蒺藜样本;以及从安徽亳州药材市场购买的内蒙产蒺藜2个样本,采集信息见表 1。各样本均经中国医学科学院北京协和医学院药用植物研究所郭宝林研究员鉴定为蒺藜科蒺藜属蒺藜Tribulus terrestris L.。
| 表 1 蒺藜采集地信息 Table 1Sampling site information of T. terrestris |
知母皂苷BII(内标)、25个蒺藜对照品(表 2)均为本实验室从蒺藜果实中分离得到,并通过波谱学鉴定结构[7, 8],且经HPLC检测,质量分数均大于98%。
| 表 2 蒺藜对照品信息 Table 2Information on reference substances of T. terrestris |
色谱柱:Waters ACQUITYTM UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱,线性梯度洗脱程序:0~0.5 min,5%~15% B;0.5~8.0 min,15%~20% B;8.0~14.0 min,20%~25% B;14.0~15.0 min,25%~28% B;15.0~18.0 min,28%~35% B;18.0~23.0 min,35%~45% B;23.0~27.0 min,45%~50% B;27.0~32.0 min,50%~70% B;32.0~34.0 min,70%~80% B;34.0~34.1 min,80~100% B;34.1~36.0 min,100% B;体积流量0.6 mL/min;柱温45 ℃;进样量4 μL。
2.2 质谱条件电喷雾电离离子源(ESI),离子化模式分为正、负离子,离子源温度为100 ℃,脱溶剂气体为氮气,体积流量为850 L/h,温度为450 ℃。毛细管电压为3 000 V,锥孔电压为30 V,扫描范围为m/z 100~1 500。低能量扫描时trap电压为6 eV,transfer电压为4 eV;高能量扫描时,负离子模式:trap电压为50~65 eV,transfer电压为12 eV,正离子模式:trap电压为45~60 eV,transfer电压为12 eV。准确质量数用leucineenk ephalin作校正液。
2.3 供试品溶液制备 2.3.1 内标溶液精密称取知母皂苷BII对照品1.53 mg,溶于5 mL 23%乙腈,配制成0.306 mg/mL溶液。
2.3.2 果实供试品溶液15个果实样品(1~15)分别粉碎后过40目筛,各取药材粉末1.0 g,精密称定,置于具塞三角瓶中,分别加入体积分数为60%乙醇20 mL,浸泡30 min后超声处理(功率250 W,频率40 kHz)20 min,冷却后经定量滤纸滤过,重复上述操作1次,合并滤液后经SPE固相萃取柱萃取,再经体积分数为80%乙醇洗脱至50 mL量瓶中并定容,取少量,经0.22 μm微孔滤膜滤过后,取续滤液1 mL,分别加入100 μL内标溶液,即得。
2.3.3 全草供试品溶液10个全草样品分为果实、茎、叶3部分,分别粉碎后过40目筛,按果实(0.127 g)︰茎(0.354 g)︰叶(0.519 g)比例取1.0 g,精密称定,按照“2.3.2”项下方法处理后,分别加入100 μL内标溶液,即得。
2.4 混合对照品溶液制备由于螺甾皂苷在甲醇-水系统较易溶解,而呋甾皂苷在甲醇-水系统易甲氧基化[9],在乙腈-水系统中完全溶解,故将呋甾皂苷溶解于乙腈-水系统;其他类型皂苷溶解于甲醇-水系统;其中呋甾皂苷中存在多对25 (R/S) 异构体,为便于区分,将呋甾皂苷分为两组1、2,其他类型皂苷为组3(23、24为一对25 (R/S)异构体,在反相C-18上无法实现分离),各对照品序号按照保留时间排序,见表 2。
25个对照品各取0.3 mg,精密称定,组1、2中各对照品分别溶解于1 mL 23%乙腈,组3中各对照品分别溶解于1 mL70%甲醇;制得各对照品储备液。再分别取各组中对照品储备液各100 μL,混匀,即得。
2.5 不同产地蒺藜果实化学成分对比分析 2.5.1 蒺藜果实化学成分分析根据液相色谱及质谱分析条件,取蒺藜果实供试品溶液进行分析。根据对照品信息,对UPLC-Q-TOF MSE总离子流图相应色谱峰进行标记,整体了解各果实中化学成分组成,化合物编号见表 2。其中具代表性的果实供试品:新疆昌吉(10-1)、北京(13-1)的总离子流图见图 1。
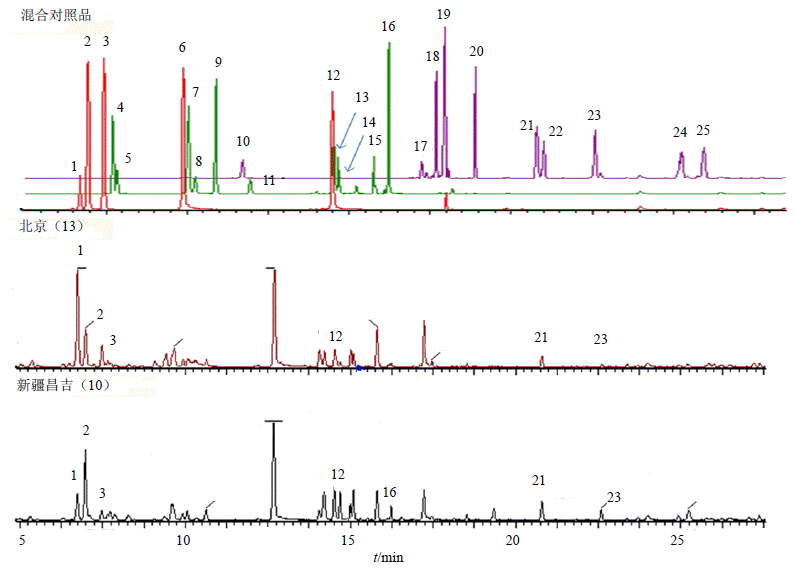 | 对照品峰编号与表2一致 Peak No. of control substance is consistent with table 2 图 1 蒺藜对照品溶液及蒺藜果实UPLC-MS表征BPI图 Fig.1 BPI profiled by UPLC-MS for reference solution of T. terrestris and fruits of T. terrestris |
为了区分不同产地蒺藜果实化学成分的差异,采用主成分分析(principal components analysis,PCA)模式识别各样品化学成分差异程度,所得PCA得分图见图 2。PCA得分图中蒺藜果实各样本均匀分布在图中,且互相混杂,说明各蒺藜果实样本无明显差异。
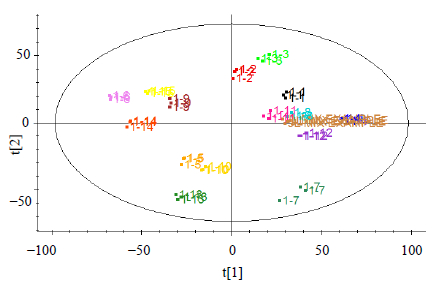 | PCA图中编号与表1一致 No. in PCA plot is consistent with Table 1 图 2 不同产地蒺藜果实PCA得分图 Fig.2 PCA/Scores plot of T. terrestris fruits obtained from different producing areas |
蒺藜果实化学成分的差异程度,选取了蒺藜果实中量较高的10个化学成分(表 2)进行相对定量分析[10]。统计各样本中各成分(与样品无干扰的内标知母皂苷BII及上述10个化合物)提取离子流色谱图的峰面积,知母皂苷BII色谱峰面积记为100,然后将各色谱峰面积相对于内标色谱峰的峰面积量化。分析不同产地样品中各成分色谱峰的相对峰面积(表 3)可以发现,新疆伊犁产蒺藜(1-1~4-1)成分基本一致;新疆阿勒泰产蒺藜(5-1~7-1)之间成分差异较大;新疆昌吉产蒺藜(8-1~12-1)化学成分差异性体现在同分异构体的种类和量上;北京产蒺藜(13-1)样品中25S-terrestrosin I(1)量较高;亳州药材市场购买内蒙产蒺藜果实(14-1~15-1)成分基本一致。
| 表 3 不同产地蒺藜果实中各成分相对峰面积 Table 3Relative peak areas of each constituent in T. terrestris fruits from different producing areas |
对10组不同产地相对应的蒺藜果实与全草样本进行PCA分析,所得PCA得分图见图 3。二维PCA得分图表明,蒺藜果实样本与全草样本化学成分差异较大。为了进一步探寻区分蒺藜不同药用部位的差异性成分,采用正交偏最小二乘判别分析(OPLS-DA)进行处理,得到S-Plot图(图 4)。选择离散程度较大的点,即VIP值大于2.5的点进行分析,这些点代表对两者差异贡献较大的成分,最终确定15个化学标志物(其中果实中存在12个,全草中存在3个),见表 4。由表 4可见,蒺藜果实与全草之间主要差异性成分为甾体皂苷类,在负离子模式易产生[2M+HCOO]− 加合离子峰,通过将这些差异性成分的保留时间、精确相对分子质量及碎片离子与实验室对照品及相关文献比对[7, 8, 11, 12, 13, 14],进行结构鉴定,其结构见图 5所示。果实中量较高的差异性成分为:25S-terrestrosin I、(25S)-26-O-β-D-吡喃葡萄糖基-5α-呋甾-22-甲氧基-2α,3β,22α,26-四醇-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖基-(1→4)-β-D-吡喃半乳糖苷;全草中量较高的差异性成分为uttroside B、tribuluside A。表 4中化合物13、14、15可匹配出相应分子式,但由于缺少相应文献报道,其具体结构尚需进一步研究。
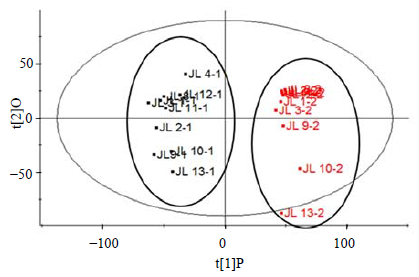 | PCA图中编号与表1一致,JL-1与JL-2分别代表蒺藜果实样品与蒺藜全草样品 No. in PCA plot is consistent with Table 1, JL-1 and JL-2 represent fruit and whole herb sample of T. terrestris 图 3 蒺藜果实与全草PCA得分图 Fig.3 PCA/Scores plot of fruit and whole herb of T. terrestris |
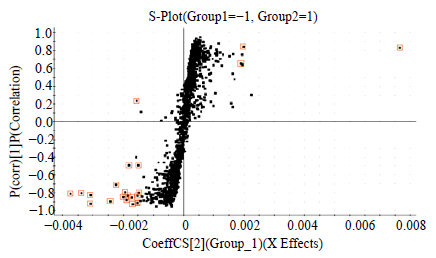 | 图 4 蒺藜果实与全草比较S-Plot分析图 Fig.4 OPLS-DA/S-Plot of fruit and whole herb of T. terrestris |
| 表 4 蒺藜不同药用部位差异性成分的鉴定结果 Table 4Identification of markers from different parts of T. terrestris |
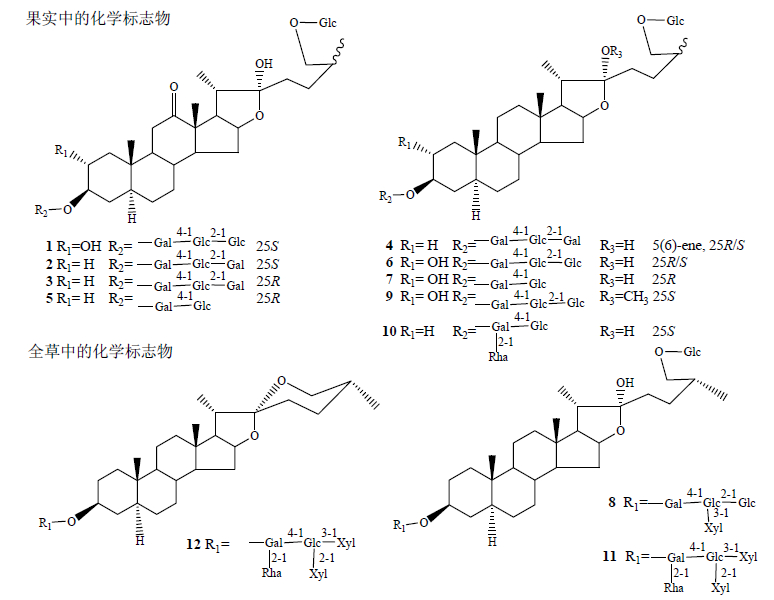 | 图 5 蒺藜不同药用部位差异性成分的结构 Fig.5 Structures of markers from different parts of T. terrestris |
本实验样品取材方面,由于新疆地区蒺藜研究较少,故在新疆具有代表性的3个区域采集了12份蒺藜样品以期充分比较新疆产区蒺藜果实与常规使用的北京、内蒙产区蒺藜果实化学成分差异性。在研究方法上,结合PCA及相对定量分析方法,不仅可以从整体角度研究不同产地蒺藜果实主成分是否一致,而且可以充分了解不同产地蒺藜果实之间化学成分含量的细微差别,比之前仅利用HPLC测定蒺藜药材中皂苷元或蒺藜总皂苷的方法更全面反映不同产地蒺藜果实的差异程度[4, 5]。尽管本实验的样品并未覆盖全国所有产区,但根据其地域跨度之大,亦可一定程度上说明国内各地区蒺藜果实中化学成分总体差异较小,而这一结论也与通过研究不同产地蒺藜果实种质差异性所得出的结论不谋而合[15, 16]。与此同时,结合PCA、OPLS-DA分析方法找出了蒺藜全草与果实之间差异性较大的化学标志物,主要为甾体皂苷类成分,并对其结构进行了鉴定。但目前蒺藜药理活性研究主要对象为蒺藜总皂苷,对蒺藜中单体化合物研究较少,故蒺藜果实与全草之间物质基础的差异是否会带来药效的不同尚不明确,还需要进行后续的药理学等实验。
本实验首次应用UPLC-Q-TOF MSE结合PCA及OPLS-DA模式的分析方法比较研究不同产地蒺藜及其不同药用部位化学成分的差异性。更全面、更科学地反映不同产地蒺藜药材的差异性,并给出了蒺藜果实与全草之间具有代表性的差异性成分,对蒺藜资源合理利用以及临床用药具有指导意义。
| [1] | 肖培根. 新编中药志[M]. 北京:化学工业出版社, 2001. |
| [2] | Dragomir D, Bogdan J, Liuba E, et al. Distribution of steroidal saponins in Tribulus terrestris from different geographical regions[J]. Phytochemistry, 2008, 69(1):176-186. |
| [3] | 张萍, 周旭, 王伽伯, 等. 紫外分光光度法测定不同产地蒺藜中总皂苷的含量[J]. 解放军药学学报, 2010, 26(6):533-535. |
| [4] | 李昊月, 冯琳, 李瑞海, 等. 18个不同产地蒺藜药材中蒺藜皂苷元的HPLC含量测定[J]. 实用药物与临床, 2015, 18(1):69-71. |
| [5] | 李瑞海, 冯琳. 不同产地蒺藜药材中蒺藜皂苷元的HPLC-ELSD含量测定[J]. 辽宁中医药大学学报, 2009, 11(10):155-156. |
| [6] | 牛伟, 翟伟菁, 曹群华, 等. RP-HPLC比较蒺藜全草和果实中的主要甾体皂苷元成分[J]. 中成药, 2005, 27(4):456-458. |
| [7] | Kang L P, Wu K L, Yu H S, et al. Steroid saponins from Tribulus terrestris[J]. Phytochemistry, 2014, 107:182-189. |
| [8] | 吴克磊, 康利平, 熊呈琪, 等. 蒺藜全草中甾体皂苷类化学成分研究[J]. 天津中医药大学学报, 2012, 31(4):225-228. |
| [9] | 戴忠, 姜红. 甾体皂苷研究进展[J]. 中国药师, 2003, 6(10):615-616. |
| [10] | 苏兰. 蒺藜果实中甾体皂苷类成分的研究[D]. 沈阳:沈阳药科大学, 2008. |
| [11] | Gheorghiu A, Ionescu-Matiu E. Presence of chlorogenin next to diosgenin and gitogenin in Tribulus terrestris[J]. Ann Pharm, 1968, 26(12):745-798. |
| [12] | De Combarieu E, Fuzzati N, Lovati M, et al. Furostanol saponins from Tribulus terrestris[J]. Fitoterapia, 2003, 74(6):583-591. |
| [13] | Liu Y, Wang Y M, Sun L K, et al. Steroidal glycosides from the fruits of Tribulus terrestris[J]. Chem Nat Comp, 2014, 50(3):483-488. |
| [14] | Xu Y J, Xu T H, Xie S X, et al. Two New Furostanol from Tribulus terrestris L.[J]. Chem Res Chin Univ, 2010, 26(1):46-49. |
| [15] | 张素军, 张学春. 不同产地蒺藜核糖体DNA内转录间隔区序列分析[J]. 实用药物与临床, 2011, 14(2):129-131. |
| [16] | 张素军. 不同产地蒺藜种质鉴定和化学成分聚类分析[J]. 现代中药研究与实践, 2012, 26(2):21-25. |
 2016, Vol. 47
2016, Vol. 47


