伊犁贝母Fritillaria pallidiflora Schrenk为百合科(LiIiaceae)贝母属Fritillaria L. 植物,在我国已经具有上千的药用历史,临床上具有镇咳、祛痰、平喘的功效[1]。伊犁贝母被收录在《中国药典》中的“伊贝母”项下,与伊贝母一同被收录的浙贝母和川贝母,是使用最广泛的贝母;由于近些年来川贝母资源的日渐枯竭,人们对其替代性品种的研究正不断的进行,而伊犁贝母的人工培育已经实现,能够大面积的推广种植,是一种潜在的替代性资源,据伊江兰等[2]对伊贝、浙贝和川贝总生物碱的研究,发现浙贝的总生物碱的量最高,伊贝次之,川贝的总生物碱的量最低。而徐惠波等[3]通过对伊犁贝母和川贝中的一个品种梭沙贝母在镇咳、抗菌、抗炎等方面的药理活性进行了比较,发现在镇咳、抗菌和抗炎等方面伊犁贝母均强于梭沙贝母。因此伊犁贝母是一种很好的川贝母的替代性物种,而对其进行全面系统的化学成分研究也具有很好的指导作用。生物碱成分目前被认为是贝母属植物的主要药理活性成分,在贝母属植物的化学研究中,研究的目标主要集中在川贝、浙贝和湖贝上,而对伊犁贝母则少有研究。徐东铭等[4, 5]、徐雅娟等[6, 7, 8]和Shen等[9]较早研究了伊犁贝母的生物碱成分,并从中分离得到了西贝素、西贝素苷、伊贝辛、贝母辛、西洛帕明、西洛泼辛碱、(20R,22R,23R,25R)-3β,23- dihydroxy-N-methyl-veratram-13(17)-en-6-one、伊贝碱苷A、伊贝碱苷B、伊贝碱苷C和伊贝辛11个生物碱成分;而其非生物碱成分则报道了苯基糖苷类、甾醇类、核苷酸类化合物[6, 7, 8, 9]。在之前对伊犁贝母鳞茎化学成分研究中,报道了1个新的甾体生物碱yibeinine,6个已知的生物碱以及4个非生物碱[10]。本实验主要报道从伊犁贝母鳞茎中分离得到4个化合物,分别鉴定为伊贝新(yibeirine,1)、伊贝嗪(yibeisine,2)、2′-甲氧基邪蒿内酯(2′-methoxyseselin,3)、1-O-β-D-葡萄糖基-(2S,3S,4R,8Z)-2-[(2′R)-(2′-羟基二十二碳酰) 氨基]-1,3,4-十八碳三醇-8-烯(1-O-β-D-glucopyranosyl- (2S,3S,4R,8Z)-2-[(2′R)-(2′-hydroxydocosanoyl) amido]- 1,3,4-octadecanetriol-8-ene,4)。其中,化合物1、2为新的甾体生物碱。
1 仪器与试剂Bruker AVANCE III型400/600 MHz核磁共振仪(德国Bruker公司);Waters Q-TOF Premier质谱仪。薄层板自制。所用试剂均为AR级(恒信化学试剂有限公司)。柱色谱硅胶、薄层色谱硅胶(青岛海浪硅胶干燥剂有限公司)。
伊犁贝母药材2009年8月购自新疆昌吉市,经四川省食品药品检验检测院张弘副研究员鉴定为贝母属植物伊犁贝母Fritillaria pallidiflora Schrenk的鳞茎,药材标本(2010-07-10)存于四川大学华西药学院天然药物研究室。
2 提取与分离取伊犁贝母的干燥鳞茎150 kg,80%乙醇回流提取3次,每次3 h,合并提取液,减压浓缩,得棕黑色的总浸膏1 614 g。将总浸膏加入适量蒸馏水混悬,依次用环己烷、环己烷-醋酸乙酯(1∶1)和醋酸乙酯萃取,浓缩,得到相应的萃取物。环己烷萃取物698 g,经硅胶柱色谱,以环己烷-醋酸乙酯(10∶1→0∶10)及醋酸乙酯-甲醇(0∶1→1∶4)为洗脱剂梯度洗脱,得Fr. 1~7。Fr. 1经硅胶柱色谱,石油醚-醋酸乙酯(95∶5)洗脱得到化合物3(230 mg)。将Fr. 5进行反相硅胶柱色谱,用甲醇水溶液(50%→70%)梯度洗脱,得到化合物4(70 mg)。Fr. 6经硅胶柱色谱,石油醚-醋酸乙酯(1∶1→1∶4)反复梯度洗脱得到化合物1(40 mg)。将Fr. 7进行硅胶柱色谱,以石油醚-醋酸乙酯-二乙胺(90∶10∶5)等度洗脱,然后进行制备薄层色谱,以三氯甲烷-甲醇(9∶1)为展开剂,氨熏,上行展开,分离得到一个单一斑点,即为化合物2(10 mg)。
3 结构鉴定化合物1:白色粉末(三氯甲烷),碘化铋钾试剂显色呈阳性,HR-ESI-MS谱中给出准分子离子峰m/z 432.347 6 [M+H]+(计算值432.343 3),推测分子式为C27H45O3N。化合物1的1H-NMR显示了3个甲基氢信号δ 0.97 (3H,s),1.04 (3H,d,J = 6.6 Hz) 和1.05 (3H,s),2个羟基取代碳上的氢信号δ 3.62 (1H,m),3.83 (1H,m)。化合物1的13C-NMR和DEPT谱显示了27个碳原子信号,包括3个伯碳、11个仲碳、11个叔碳和2个季碳信号(表 1)。依据以上核磁数据及贝母生源关系可推测化合物1为瑟文型异甾体生物碱[10, 11]。将该化合物的氢谱、碳谱数据与已知化合物isoverticine(异浙贝甲素)[12]进行比较,发现化合物1和异浙贝甲素C-1~16的化学位移基本一致,表明化合物1和isoverticine的A~D环的稠合方式应相同,差异存在于E环和F环上,即化合物1与isoverticine可能为立体异构体。由于二者的C-13、C-20和C-25化学位移一致,因此发生异构的位置可能在C-17和C-22位上。通过对比同在C-17位异构的浙贝乙素和西贝素[13]的碳化学位移,发现C-17位上氢异构为β构型后C-13的化学位移会由δC 39.3显著的向高场移动至δC 33.6[14],但化合物1与isoverticine的C-13化学位移相比基本未发生变化,因此排除在C-17位发生异构。而C-22的化学位移与isoverticine相比明显处于高场,表明化合物1的C-22位上的氢构型与isoverticine不同,应为β构型,因此导致C-17、C-18和C-22的化学位移值分别向高场移动了8.2,2.2和9.0,C-20和C-21的化学位移值分别向低场移动了1.0和1.7。通过化合物1的NOESY图谱可以发现,H-8和CH3-19,H-5和H-9,H-9和H-12,H-9和H-14,H-17和H-12及CH3-21之间有NOE效应,可证实A/B环为反式稠合,B/C环为反式稠合,C/D环为顺式稠合,D/E环应为反式稠合(图 1)。通过化合物1的HMQC和HMBC图谱,对化合物1的NMR数据进行了归属,具体数据见表 1。综上所述,可确定化合物1的结构为5α,14α,17α,22β-cevanin- 3β,6β,20β-triol,经SciFinder检索核实,为新化合物,命名为伊贝新。
| 表 1 化合物1、2的13C-NMR (150 MHz, CDCl3) 和DEPT数据 Table 113C-NMR and DEPT data for compounds 1 and 2 (150 MHz, CDCl3) |
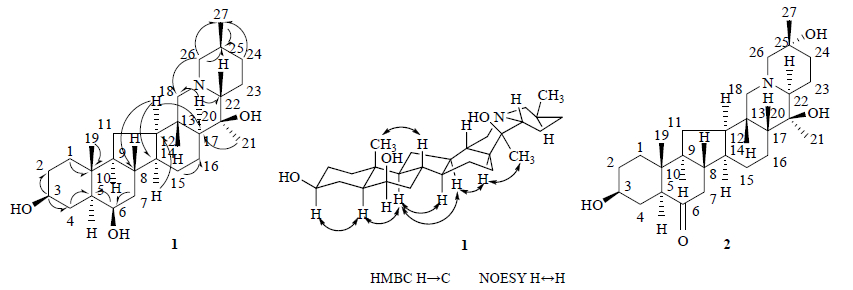 | 图 1 化合物1、2的结构及1的主要HMBC和NOESY Fig.1 Structures and key HMBC and NOESY of compounds 1 and 2 |
化合物2:白色粉末(三氯甲烷),碘化铋钾试剂显色呈阳性,HR-ESI-MS谱中给出准分子离子峰m/z 446.326 8 [M+H]+(计算值446.322 6),提示其应为生物碱类化合物。结合其碳谱和氢谱数据,推测该化合物的分子式为C27H43O4N。化合物2的1H-NMR显示了3个甲基质子信号δ 1.24 (3H,s),1.09 (3H,s) 和0.74 (3H,s) 和2个羟基取代碳上的氢信号δ 3.72 (1H,m,H-24),3.52 (1H,m,H-3)。
化合物2的13C-NMR和DEPT谱显示了27个碳原子信号,包括3个伯碳、11个仲碳、9个叔碳和4个季碳信号(表 1)。由于化合物2分离纯化出的量太少以至于不能进行二维图谱分析,依据以上核磁数据及贝母生源关系可推测化合物2为瑟文型异甾体生物碱[10, 11]。将化合物2的碳谱数据与已知化合物西贝素[13]的碳谱数据进行比较,发现化合物2与西贝素的C-1至C-22的化学位移基本一致,表明化合物2和西贝素的A~E环的稠合方式应该相同。由于化合物2的相对质量分数比西贝素的大16,且在δ 70左右多出1个季碳信号,再结合其分子式可知化合物2应该比西贝素在F环上多了1个羟基取代。而化合物2的甲基信号δ 1.24 (3H,s,CH3-27) 显示F环上的羟基取代应该在C-25位,即化合物2应是西贝素在25位的羟基取代物。由于受到25位羟基吸电子效应的影响,从而导致27-CH3、C-26、C-24的化学位移值分别向低场移动了8.2、5.7和8.8;而C-23的化学位移向高场移动。另外,根据张安将等[15]关于贝母属植物生物碱成分碳化学位移的综述可知在异甾体生物碱中β构型的羟基取代碳的化学位移相较于α构型的处在低场,其化学位移值都大于δC 70,而根据化合物2的碳谱信号δC 68.7 (C-25),可知C-25位羟基的空间构型应为α构型。综上所述,确定化合物2的结构为5α,14α,17β-cevanin-6-oxo-3β,20β,25α- triol,经SciFinder检索核实,为新化合物,命名为伊贝嗪。
化合物3:白色针状晶体(环己烷-醋酸乙酯),分子式C15H14O4。1H-NMR (400 MHz,CDCl3) δ: 1.50 (6H,s,2×CH3),3.96 (3H,s,OCH3),6.90 (1H,s,H-1′),6.88 (1H,d,J = 8.8 Hz,H-6),7.34 (1H,d,J = 8.8 Hz,H-5),7.64 (1H,d,J = 9.6 Hz,H-4),6.28 (1H,d,J = 9.6 Hz,H-3);13C-NMR (100 MHz,CDCl3) δ: 24.5 (2×CH3),24.5 (CH3),55.9 (OCH3),82.4 (C-3′),107.6 (C-1′),112.0 (C-3),112.7 (C-10),113.2 (C-8),116.9 (C-6),127.3 (C-5),144.8 (C-4),151.9 (C-7),151.9 (C-9),160.1 (C-2′),162.1 (C-2)。根据以上波谱数据,参考文献报道[16, 17],鉴定化合物3为2′-甲氧基邪蒿内酯。
化合物4:白色针状晶体(甲醇-水),分子式C49H95O10N;ESI-MS m/z: 858 [M+H]+,880 [M+Na]+,896 [M+K]+。1H-NMR (400 MHz,CDCl3+CD3OD) δ: 4.23 (1H,m,H-1a),3.53 (1H,m,H-1b),3.81 (1H,dd,J = 10.4,3.2 Hz,H-2),4.06 (1H,dd,J = 7.6,4.0 Hz,H-3),4.02 (1H,m,H-4),2.04 (2H,m,H-5),1.64 (1H,m,H-6),2.08 (1H,m,H-7),5.36 (H,m,H-8,9),2.08 (1H,m,H-10),1.28~1.40 (52H,H-11~17,H-4′~22′),3.61 (1H,t,J = 6.0 Hz,H-2′),1.70 (1H,m,H-3′a),1.54 (1H,m,H-3′b),4.28 (1H,d,J = 7.6 Hz,H-1″),3.17 (1H,m,H-2″),3.35 (1H,m,H-3″),3.27 (1H,m,H-4″),3.26 (1H,m,H-5″),3.88 (1H,dd,J = 12.0,2.4Hz,H-6″a),3.68 (1H,dd,J = 11.2,2.4 Hz,H-6″b),0.89 (3H,t,J = 6.0 Hz,CH3);13C-NMR (100 MHz,CDCl3+CD3OD) δ: 67.8 (C-1),49.6 (C-2),72.8 (C-3),69.4 (C-4),31.0 (C-5),24.2 (C-6),26.3 (C-7),128.9 (C-8),128.6 (C-9),25.2 (C-10),28.5~28.2 (C-11~17,C-4′~22′),102.4 (C-1″),73.5 (C-2″),75.7 (C-3″),71.0 (C-4″),75.8 (C-5″),60.5 (C-6″),175.0 (C-1′),70.9 (C-2′),33.6 (C-3′),12.7 (CH3)。根据以上数据,参考文献报道[18],确定化合物4为1-O-β-D-葡萄糖基-(2S,3S,4R,8Z)- 2-[(2′R)-(2′-羟基二十二碳酰) 氨基]-1,3,4-十八碳三醇-8-烯。
| [1] | 张亚山, 宫喜臣. 伊犁贝母的栽培技术[J]. 特种经济动植物, 2002(6):26-27. |
| [2] | 伊江兰, 麦迪尼亚提. 伊贝母总生物碱的研究概述[J]. 新疆中医药, 2002, 20(4):77-79. |
| [3] | 徐惠波, 杨晓波, 温富春, 等. 伊犁贝母和梭砂贝母生理活性的初步比较[J]. 中国中药杂志, 2000, 25(7):391-393. |
| [4] | 徐东铭, 庄子升, 杨秀伟, 等. 伊贝碱甙A的分离和鉴定[J]. 药学学报, 1990, 25(10):795-797. |
| [5] | 徐东铭, 黄恩喜, 王淑琴, 等. 伊贝母生物碱的研究[J]. 植物学报, 1990, 32(10):789-793. |
| [6] | 徐雅娟, 徐东铭, 崔东滨, 等. 伊贝碱甙B的分离和结构鉴定[J]. 药学学报, 1993, 28(3):192-196. |
| [7] | 徐雅娟, 徐东铭, 崔东滨, 等. 伊贝母中伊贝碱甙C的分离和结构测定[J]. 药学学报, 1994, 29(3):200-203. |
| [8] | 徐雅娟, 徐东铭, 黄恩喜, 等. 伊贝辛的分离和鉴定[J]. 药学学报, 1992, 27(2):121-124. |
| [9] | Shen S, Li G Y, Huang J, Tan Y, et al. Chemical constituents from Fritillaria pallidiflora Schrenk[J]. Biol Chem Syst Ecol, 2012, 4(12):183-187. |
| [10] | 曹新伟. 川贝母的化学成分研究与贝母属药用植物质量评价[D]. 北京:中国医学科学院药用植物研究所, 2008. |
| [11] | 阮汉利. 湖北省产贝母非生物碱成分的化学研究[D]. 武汉:同济医科大学, 1999. |
| [12] | 李清华, 吴宗好. 安徽贝母生物碱的分离和结构鉴定[J]. 药学学报, 1986, 21(10):767-771. |
| [13] | 陈茜, 祝丽华, 徐云峰, 等. 异浙贝甲素氮氧化物的分离和结构鉴定[J]. 药学学报, 2004, 39(5):348-350. |
| [14] | 刘庆华, 贾晓光, 任永风, 等. 新疆贝母化学成分的研究[J]. 药学学报, 1984, 10(12):894-898. |
| [15] | 张安将, 王化远, 邵海鹏. 贝母属植物的13C NMR化学位移研究[J]. 华西药学杂志, 1998, 13(2):100-104. |
| [16] | Kamat V S, Trivedi G K, Bhattacharyya S C. Transformation studies in pyranocoumarins:part I. Ring contraction in dihydrolomatin and reaction of 9,10-dihydro-8,8-dimethyl-2H,8H-benzo[1,2-b:3,4-b'] dipyran-2,9-dione[J]. Indian J Chem B, 1978, 16B(3):179-183. |
| [17] | Mukandiwa L, Ahmed A, Eloff J N, et al. Isolation of seselin from Clausena anisata (Rutaceae) leaves and its effects on the feeding and development of Lucilia cuprina larvae may explain its use in ethnoveterinary medicine[J]. J Ethno Pharmacol, 2013, 150(3):886-891. |
| [18] | Zhang W K, Xu J K, Zhang X Q, et al. Sphingolipids with neuritogenic activity from Euphorbia sororia[J]. Chem Phys Lipids, 2007, 148(2):77-83. |
 2016, Vol. 47
2016, Vol. 47


