乌药Lindera aggregata (Sims) Kosterm. 为樟科(Lauraceae)山胡椒属Lindera Thunb. 植物,别名鳑魮树、铜钱树、天台乌药、斑皮柴等,主产于浙江、安徽、湖南等地,为常绿灌木或小乔木,树皮灰褐色,根有纺锤结或结节状膨胀[1]。传统中药以其块根入药,其药性辛温,归肺、脾、肾、膀胱经,主治寒凝气滞、胸腹胀痛、呃逆、气厥头痛等气通症;现代药理学研究表明乌药不仅具有抗菌、抗病毒作用,还对消化系统、心血管系统以及促凝血等方面有显著的作用[2, 3]。对乌药的早期化学成分研究表明,乌药的主要化合物结构类型包括异喹啉生物碱、黄酮、倍半萜等[4, 5, 6]。本课题组前期已从该植物根的醇提物中分离得到了2类罕见的具有戊烯二酮螺环结构片段的化合物linderaspirone和bi-linderone,2类
结构均显示出十分显著的改善胰岛素抵抗活性[7, 8]。为进一步深入研究该植物的化学成分,本实验采用现代色谱分离技术,对乌药的化学成分进行了系统的分离,从其根的95%乙醇提取物中分离得到了14个化合物。其中化合物1为新化合物,命名为乌药双查尔酮(bi-linderachalcone,1),其余已知化合物分别鉴定为乌药环戊烯二酮甲醚(methyllinderone,2)、乌药环戊烯二酮(linderone,3)、帕夏查耳酮(pashanone,4)、球松素(pinostrobin,5)、甲基赤芝酮(methyllucidone,6)、松属素(pinocembrin,7)、5,7-二羟基-6,8-二甲氧基黄酮(5,7-dihydroxy- 6,8-dimethoxyflavone,8)、赤芝酮(lucidone,9)、乙基赤芝酮(ethyllucidone,10)、肉桂酸(cinnamic acid,11)、球松素查尔酮(pinostrobinchalcone,12)、蓟黄素(cirsimaritin,13)和β-谷甾醇(β-sitosterol,14)。其中,化合物1为新化合物,化合物13为首次从该属植物中分离得到。
1 仪器与材料BrukerAV-400 MHz和Bruker DRX-500MHz 核磁共振光谱仪;LC-IT-TOF质谱仪(日本岛津公司);Bruker Tensor 27 FT-IR红外光谱仪;Agilent 1200型高效液相色谱仪;Büchi旋转蒸发仪;SHB-3循环式多用真空泵(巩义市予华仪器有限责任公司);ZF-1型三用紫外仪(上海精科实业有限公司);柱色谱硅胶(80~100、200~300目,青岛海洋化工有限公司),Sephadex LH-20(瑞典Amersham Biosciences公司)。
乌药根茎2008年2月采于云南宁洱,原植物由中国科学院昆明植物研究所陈渝鉴定为樟科植物乌药Lindera aggregata (Sims) Kosterm,样品标本(BBP0020)储存在云南西力生物技术股份有限公司。
2 提取与分离干燥的乌药根茎粉末(10 kg),95%乙醇溶液加热回流提取3次,每次3 d,得到浸膏约800 g,再经硅胶柱色谱分离,石油醚-丙酮(9∶1→8∶2→7∶3→6∶4→1∶1→0∶1)洗脱,TLC检测合并得到Fr. 1~10。Fr. 1(石油醚-丙酮9∶1)经反复硅胶柱色谱并结合Sephadex LH-20(氯仿-甲醇1∶1)得到化合物1(11 mg)、2(124.7 g)、3(8.5 g)、4(8.3 g)、5(500 mg)、6(1.2 g)、8(240 mg)、9(3.1 g)、10(80 mg)、14(100 mg)。Fr. 3(石油醚-丙酮8∶2)经过反复正相硅胶柱色谱和Sephadex LH-20(氯仿-甲醇1∶1)得到化合物7(3.1 g)、11(2.4 g)、12(300 mg)、13(4 mg)。
3 结构鉴定化合物1:橙黄色粉末,FAB-MS给出分子离子峰m/z 551 [M-H]-,HR-ESI-MS显示为 [M-H]- 551.170 6(计算值551.170 5,C33H27O8),推断其分子式C33H28O8。IR光谱在3 423,3 245,1 630 cm-1处有强吸收,提示化合物中存在羟基和共轭羰基。在1H-NMR (500 MHz,DMSO-d6) 谱中(表 1),δ 7.67 (4H,m,H-2,2″,6,6″),7.43 (6H,m,H-3,3″,4,4″,5,5″) 为查尔酮B环上的芳烃质子信号;δ 8.12 (2H,d,J = 15.8 Hz,H-β,β′),7.69 (2H,d,J = 15.8 Hz,H-α,α′) 为反式双键上的烯烃质子信号;δ 6.06 (2H,s,H-5′,5′′′) 为查尔酮A环上的芳烃质子信号;δ 3.72 (6H,s,-OCH3) 和13.73 (2H,s,-OH) 分别为甲氧基与缔合羟基的质子信号;δ 3.67 (2H,s) 为亚甲基的质子信号。在13C-NMR (125 MHz,DMSO-d6) 谱中(表 1),δ 192.4 (s,C=O),141.4 (d,C-β,β′),127.8 (d,C-α,α′) 表明结构中存在α,β不饱和酮片段;δ 135.1 (s,C-1,1″),128.3 (d,C-2,2″),129.1 (d,C-3,3″),130.1 (d,C-4,4″),129.1 (d,C-5,5″),128.3 (d,C-6,6″) 表明结构中存在单取代苯环结构片段;δ 104.8 (s,C-1′,1),163.0 (s,C-2′,2′′′),106.8 (s,C-3′,3′′′),164.3 (s,C-4′,4′′′),90.6 (d,C-5′,5′′′),160.4 (s,C-6′,6′′′) 表明结构中存在五取代苯环;δ 55.5 (q,4′,4′′′-OMe) 和15.4 (d,H-7′) 分别表明结构中存在甲氧基和亚甲基基团。
| 表 1 化合物1的1H-NMR和13C-NMR数据 Table 11H-NMR and 13C-NMR data for compound 1 |
通过仔细分析对比化合物1和12的1H-NMR和13C-NMR图谱,发现它们的NMR信号十分相似,其1H-NMR主要差异在于化合物12中的3位次甲基信号 (δC 96.0,δH 6.03) 被化合物1中的季碳信号 (δC 106.8) 所取代,同时化合物1比化合物12多出了1个特殊的、具有高场碳化学位移和低场氢化学位移的亚甲基信号 (δC 15.4,δH 3.67)。通过仔细分析以上差异,结合相对分子质量信息,可推测该化合物是化合物12的3′位碳原子通过亚甲基相连而形成的查尔酮二聚体。以上推测可以合理地解释上述亚甲基信号的特殊性是由双取代苯基的顺磁屏蔽效应所导致,并可进一步通过HMBC谱中δ 3.67 (2H,s,H-7′) 和106.8 (s,C-3′,3′′′),163.0 (s,C-2′,2′′′) 以及164.3 (s,C-4′,4′′′) 之间的强相关信号所证实。在HMBC谱中,甲氧基信号δ 3.72 (6H,s,-OCH3) 和亚甲基信号δ 3.67 (2H,s,H-7′) 同时与δ 164.3 (s,C-4′,4′′′) 之间有显著相关,说明该甲氧基连接在C-4′,4′′′位;13.73 (2H,s,-OH) 和亚甲基信号δ 3.67 (2H,s,H-7′) 同时与δ 163.0 (s,C-2′,2′′′) 之间有显著相关,表明δ 13.73 (2H,s,-OH) 连接在C-2′,2′′′位。此外,由于芳香氢信号δ 6.06 (2H,s) 化学位移处于明显高场(邻二氧取代位置),并与δ 104.8 (s,C-1′,1),106.8 (s,C-3′,3′′′),160.4 (s,C-6′,6′′′) 和164.3 (s,C-4′,4′′′) 之间有强HMBC相关信号,可推测该质子处于5′,5′′′位,且δ 11.05 (2H,s,-OH) 必然位于C-6′,6′′′位置。综上所述,确定该化合物是以亚甲基为对称中心的二聚查尔酮,分子结构见图 1,为新化合物,命名为乌药双查尔酮。
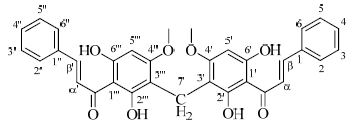 | 图 1 化合物1的化学结构 Fig.1 Structure of compound 1 |
化合物2:黄色粉末。1H-NMR (500 MHz,CDCl3) δ: 7.93 (1H,d,J = 15.8 Hz,H-7),7.59 (2H,dd,J = 8.0,1.7 Hz,H-10,14),7.51 (1H,d,J = 15.8 Hz,H-8),7.37 (3H,m,H-11~13),4.19 (3H,s,OMe),4.18 (3H,s,OMe),4.09 (3H,s,OMe)。上述数据与文献报道一致[9],故鉴定化合物2为乌药环戊烯二酮甲醚。
化合物3:黄色粉末。1H-NMR (500 MHz,CDCl3) δ: 11.55 (1H,s,OH),δ: 7.67 (1H,d,J = 15.9 Hz,H-7),7.63 (1H,d,J = 15.9 Hz,H-8),7.61 (2H,brd,J = 7.5 Hz,H-10,14),7.39 (3H,m,H-11,12,13),4.20 (3H,s,OMe),4.16 (3H,s,OMe)。上述数据与文献报道一致[10],故鉴定化合物3为乌药环戊烯二酮。
化合物4:黄色粉末。1H-NMR (400 MHz,CDCl3) δ: 13.93 (1H,s,OH),8.14 (1H,d,J = 15.6 Hz,H-β),7.86 (1H,d,J = 15.6 Hz,H-α),7.39~7.66 (5H,m,H-2~6),6.90 (1H,s,OH),6.10 (1H,s,H-3′),3.91 (3H,s,OMe),3.86 (3H,s,OMe)。上述数据与文献报道一致[11],故鉴定化合物4为帕夏查耳酮。
化合物5:白色粉末。1H-NMR (400 MHz,CDCl3) δ: 12.03 (1H,s,OH),7.44~7.46 (5H,m,H-2′~6′),6.06~6.09 (2H,s,H-6,8),5.43 (1H,dd,J = 12.8,2.8 Hz,H-2),3.09 (1H,dd,J = 16.8,12.8 Hz,H-3α),2.82 (1H,dd,J = 16.8,2.8 Hz,H-3β),3.81 (3H,s,OMe)。上述数据与文献报道一致[12],故鉴定化合物5为球松素。
化合物6:黄色粉末。1H-NMR (500 MHz,CDCl3) δ: 7.99/7.93 (1H,d,J = 15.8 Hz,H-7),7.59~7.62 (3H,m,H-8,10,14),7.37~7.41 (3H,m,H-11,12,13),5.92/5.93 (1H,s,H-5),4.20/4.19 (3H,s,OMe),3.93/3.92 (3H,s,OMe)。上述数据与文献报道一致[13],故鉴定化合物6为互变异构体甲基赤芝酮。
化合物7:白色粉末。1H-NMR (500 MHz,Acetone-d6) δ: 7.56 (2H,d,J = 7.6 Hz,H-2′,6′),7.45 (2H,dd,J = 7.6,7.2 Hz,H-3′,5′),7.39 (1H,dd,J = 7.2,7.2 Hz,H-4′),5.99 (1H,d,J = 2.0 Hz,H-8),5.96 (1H,d,J = 2.0 Hz,H-6),5.57 (1H,dd,J = 12.8,3.1 Hz,H-2),3.17 (1H,dd,J = 16.8,12.8 Hz,H-3α),2.80 (1H,dd,J = 16.8,3.1 Hz,H-3β)。上述数据与文献报道一致[14],故鉴定化合物7为松属素。
化合物8:白色粉末。1H-NMR (500 MHz,DMSO-d6) δ: 12.67 (1H,s,OH),10.51 (1H,s,OH),8.06 (2H,brd,J = 7.6 Hz,H-2′,6′),7.58~7.62 (3H,m,H-3′~5′),7.00 (1H,s,H-3),3.87 (3H,s,OMe),3.77 (3H,s,OMe)。上述数据与文献报道一致[15],故鉴定化合物8为5,7-二羟基-6,8-二甲氧基黄酮。
化合物9:黄色粉末。1H-NMR (500 MHz,CDCl3) δ: 7.76 (1H,d,J = 15.9 Hz,H-7),7.66 (1H,d,J = 15.9 Hz,H-8),7.64 (2H,m,H-10,14),7.40~7.43 (3H,m,H-11~13),5.85 (1H,s,H-5),3.96 (3H,s,OMe)。上述数据与文献报道一致[13],故鉴定化合物9为赤芝酮。
化合物10:黄色粉末。1H-NMR (500 MHz,CDCl3) δ: 8.04/7.98 (1H,d,J = 15.8 Hz,H-7),7.59~7.65 (3H,m,H-8,10,14),7.38~7.41 (3H,m,H-11~13),5.91/5.93 (1H,s,H-5),4.48/4.44 (2H,q,J = 7.2 Hz,-CH2CH3),3.93/3.92 (3H,s,OMe),1.47/1.46 (3H,t,J = 7.2 Hz,-CH2CH3)。上述数据与文献报道一致[13],故鉴定化合物10为互变异构体乙基赤芝酮。
化合物11:白色粉末。1H-NMR (500 MHz,CDCl3) δ: 7.79 (1H,d,J = 16.0 Hz,H-β),7.51~7.55 (2H,dd,J = 7.8,1.6 Hz,H-2,6),7.37~7.40 (3H,m,H-3~5),6.45 (1H,d,J = 16.0 Hz,H-α)。上述数据与文献报道一致[16],故鉴定化合物11为肉桂酸。
化合物12:黄色粉末。1H-NMR (400 MHz,Acetone-d6) δ: 12.06 (1H,s,OH),8.25 (1H,d,J = 15.8 Hz,H-β),7.79 (1H,d,J = 15.8 Hz,H-α),7.69 (2H,brd,J = 7.8 Hz,H-2,6),7.42~7.46 (3H,m,H-3~5),6.03 (2H,s,H-3′,5′),3.81 (3H,s,OMe);13C-NMR (125 MHz,Acetone-d6) δ: 192.7 (C = O),167.1 (C-2′),165.2 (C-4′),163.4 (C-1′),141.8 (C-β),135.5 (C-1),128.7 (C-3,4,5),128.3 (C-2,6),127.7 (C-α),105.1 (C-1′),96.0 (C-3′),91.5 (C-5′),55.4 (-OCH3)。上述数据与文献报道一致[17],故鉴定化合物12为球松素查尔酮。
化合物13:黄色粉末。1H-NMR (500 MHz,DMSO-d6) δ: 12.93 (1H,s,OH),10.41 (1H,s,OH),7.96 (2H,d,J = 8.0 Hz,H-2′,6′),6.92 (2H,d,J = 8.0 Hz,H-3′,5′),6.93 (1H,s,H-3),6.86 (1H,s,H-8),3.92 (3H,s,OMe),3.72 (3H,s,OMe);13C-NMR (125 MHz,DMSO-d6) δ: 164.0 (C-2),102.6 (C-3),182.2 (C-4),152.0 (C-5),131.9 (C-6),158.6 (C-7),91.6 (C-8),152.6 (C-9),105.0 (C-10),121.1 (C-1′),128.4 (C-2′,6′),116.0 (C-3′,5′),161.3 (C-4′),60.0 (-OCH3),56.4 (-OCH3)。上述数据与文献报道一致[18],故鉴定化合物13为蓟黄素。
化合物14:白色针晶(石油醚-丙酮)。与β-谷甾醇对照品对照,Rf值相同(石油醚-醋酸乙酯5∶1),故鉴定化合物14为β-谷甾醇。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 俞桂新, 王峥涛, 徐珞珊. 乌药的化学成分及药理作用[J]. 中国野生植物资源, 1999, 18(3):5-10. |
| [3] | 王军伟, 阮冰. 乌药的植化及药理研究概况[J]. 浙江中医杂志, 2006, 41(11):675-677. |
| [4] | 张朝凤, 孙启时, 赵燕燕. 乌药叶中黄酮类成分研究[J]. 中国药物化学杂志, 2001, 11(5):274-276. |
| [5] | Kozuka M, Yoshikawa M, Sawada T, et al. Alkaloids from Lindera strychnifolia[J]. J Nat Prod, 1984, 47(6):1063. |
| [6] | Gan L H, Zheng Y L, Zhou C X, et al. Sesquiterpenelactones from the root tubers of Lindera aggregata[J]. J Nat Prod, 2009, 72(8):1497-1501. |
| [7] | Wang F, Gao Y, Liu J K, et al. Bi-linderone, a highly modified methyl-linderonedimer from Lindera aggregata with activity toward improvement of insulin sensitivity in vitro[J]. Org Lett, 2010, 12(10):2354-2357. |
| [8] | Wang F, Gao Y, Zhang L, et al. A pair of windmill-shaped enantiomers from Lindera aggregata with activity toward improvement of insulin sensitivity[J]. Org Lett, 2010, 12(14):3196-3199. |
| [9] | Leong Y W, Harrison L J, Bennett G J, et al. Adihydrochalcone from Lindera lucida[J]. Phytochemistry, 1998, 47(5):891-894. |
| [10] | Kiang A K, Lee H H, Sim K Y, et al. The structure of linderone and methyl-linderone[J]. J Chem Soc, 1962, 11:4338-4345. |
| [11] | Ichino K, Tanaka H, Ito K, et al. Synthesis of helilandin B, pashanone, and their isomers[J]. J Nat Prod, 1988, 51(5):906-914. |
| [12] | Hodgetts K J. Inter-and intramolecular Mitsunobu reaction based approachesto 2-substituted chromans and chroman-4-ones[J]. Tetrahedron, 2005, 61(28):6860-6870. |
| [13] | Lee H H. The structure of lucidone and methyl-lucidone[J]. Tetrahedron Lett, 1968, 9(40):4243-4246. |
| [14] | 姜苗苗, 冯毅凡, 姚新生. 景洪哥纳香根的化学成分研究[J]. 中草药, 2011, 42(2):214-216. |
| [15] | HorieT, Kawamura Y, Yamashita K, et al. Synthesis of 5, 8-dihydroxy-6, 7-dimethoxyflavones and revised structures for some natural flavones[J]. Phytochemistry, 1995, 39(5):1201-1210. |
| [16] | 裴静, 沈建红, 秦向东. 肉桂酸的合成及其谱学研究[J]. 光谱实验室, 2001, 18(6):715-718. |
| [17] | Bail J L, Pouqet C, Faqnere C, et al. Chalcones are potent inhibitors of aromatase and 17β-hydroxysteroid dehydrogenase activities[J]. Life Sci, 2001, 68(7):751-761. |
| [18] | Hasrat J A, PietersL, Claeys M, et al. Adenosine-1 active ligands:cirsimarin, a flavone glycoside from Microteadebilis[J]. J Nat Prod, 1997, 60(6):638-641. |
 2016, Vol. 47
2016, Vol. 47


