人参Panax ginseng C. A. Mey. 是我国一类重要的特产资源,具有较高的商品价值和药用价值,然而人参根腐菌和人参锈腐菌作为人参生长过程中的重要土传病害,长期危害着人参的根或茎基部,且防治困难[1, 2]。有报道指出,人参在生长过程中,其根系会向周围环境分泌释放多种具有生物活性的物质,其中部分活性物质的长期积累对人参生长、发育以及抵御外界病原菌入侵等产生一定作用[3]。杨靖春等[4]首次从人参根系分泌物中发现人参皂苷的存在,并刺激了人参根际微生物青霉和黑曲霉群落的增长。Nicol等[5]从西洋参根系分泌物中也检测出了人参皂苷,并发现它能够促进根系周围疫霉菌和锈腐菌的生长,却对哈茨木霉菌的生长产生抑制作用。张爱华等[6]采用无土栽培技术收集人参根系分泌物,鉴定了其中含有5种人参皂苷。近年来,越来越多的实验证明人参皂苷作为主要的化感因子调节着人参与微生物种群间的关系。
趋向性是许多病原菌感受寄主植物信号并成功侵入寄主的重要方式[7, 8]。某种病原物具有的趋向潜在寄主移动或生长的能力,可以大大增加其成功接触寄主的机会[9]。人参根系分泌的人参皂苷被视为一种主要的化感因子调节着人参与根际土壤微生物种群间的关系。然而人参病害爆发流行时期是人参根系分泌物分泌最旺盛时期,这是否对人参主要土传病害的暴发流行起着某种作用,人参根系分泌物对人参主要病原菌是否有化学趋向性响应,对哪些病原菌有响应,其中的相关因素有哪些,作用机制是什么,如何调控人参根系分泌物对病害的发生等目前未见相关报道。本实验以人参总皂苷和人参、西洋参主要土传病害为材料和研究对象,探讨了人参根腐菌和人参锈腐菌对人参总皂苷的化学趋向性响应,以期为人参忌连作、人参主要土传病害的防治及拮抗菌株的筛选等研究提供参考。
1 材料与方法 1.1 材料 1.1.1 供试菌种样品均取自吉林省人参工程技术研究中心,经吉林农业大学高洁教授鉴定为人参根腐菌Fusarium solani (Mart.) App. et Wollenw. 和人参锈腐菌Cylindrocarpon destructans (Zinns.) Scholton。
1.1.2 供试药品采用超声波法从3年生人参根中分离提取得到人参总皂苷(质量分数为95%)。孟加拉红培养基,北京奥博星生物技术有限责任公司。
1.2 方法 1.2.1 菌液的制备取2种病原菌丝适量,加入到装有10 mL无菌水的EP管中,置于漩涡混合器上混匀,分别配制成浓度为1×106 CFU/mL的孢子悬浮液,备用。
1.2.2 人参总皂苷溶液的制备利用蒸馏水配制质量浓度分别为200、20、2、0.2 mg/L的人参总皂苷溶液,用0.22 μm滤膜滤过除菌,备用。
1.2.3 化学趋向性实验按图 1所示方法进行操作。使用打孔器(直径=6 mm)按由上至下的顺序在培养基上打3个孔,标记为A、B、C,每孔间距为20 mm,分别用25 mm×2 mm的滤纸条相连,再用移液枪分别吸取30 μL上述各溶液加入到相应孔中,每个处理重复3次。将人参根腐菌和人参锈腐菌置于25 ℃、黑暗条件下培养4 d。
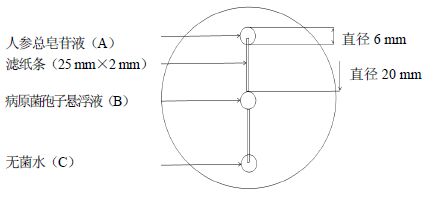
|
图 1 人参病原菌化学趋向性响应实验操作图 Fig. 1 Test operation map of chemotaxis response of ginseng pathogens |
移动距离标准定为以绝大多数菌丝移动的最远方,菌丝从孔B向孔A移动的距离为a,向孔C移动的距离为b,按公式计算病原菌趋化移动指数(chemotactic migration index,CMI)与趋化生长速率(chemotactic growth rate,CGR)。CMI=a/b,CGR=(a-b)/d(d为培养天数);当a/b>1时,所测物质对测定微生物具有正趋化性;当a/b<1时,所测物质对测定微生物具有负趋化性;当a/b=1时,所测物质对测定微生物不具有趋化性。根据公式测定病原菌孢子萌发率(spore germination rate,SGR)和病原菌菌丝生长量(mycelial growth,MG)。

将配制好的人参总皂苷溶液(200、20、2、0.2 mg/L)按“1.2.3”项的方法进行化学趋向性实验。
1.2.6 温度对人参根腐菌和人参锈腐菌化学趋向性的影响在不同温度(15、20、25、30 ℃)下按“1.2.3”项的方法进行化学趋向性实验,其中,培养人参根腐菌的人参总皂苷溶液质量浓度为2 mg/L;培养人参锈腐菌的人参总皂苷溶液质量浓度为20 mg/L。
1.2.7 pH值对人参根腐菌和人参锈腐菌化学趋向性的影响配制不同pH值(5、6、7、8)的人参总皂苷溶液(质量浓度分别为2和20 mg/L),按“1.2.3”项的方法进行化学趋向性实验(2种病原菌均在25 ℃条件下培养)。
1.2.8 最优趋化参数下人参根腐菌和人参锈腐菌对人参总皂苷的化学趋向性响应综合筛选出2种病原菌在上述3种情况下的最优趋化参数,按“1.2.3”项的方法进行化学趋向性实验。
1.2.9 最优趋化参数下人参根腐菌和人参锈腐菌SGR的测定采用孢子悬滴萌发法[10]测定培养12 h后2种病原菌孢子受此趋化影响的SGR。
1.2.10 最优趋化参数下人参根腐菌和人参锈腐菌菌丝CGR的测定测定2.5、3.0、3.5、4.0 d培养时间下2种病原菌丝受此趋化影响的CGR,按“1.2.3”项的方法进行化学趋向性实验。
1.2.11 最优趋化参数下人参根腐菌和人参锈腐菌MG的测定采用菌丝干重法[11]测定培养7 d后人参根腐菌和人参锈腐菌受此趋化影响下菌丝的MG。
1.2.12 最优趋化参数下人参根腐菌和人参锈腐菌初生菌丝的生长状况借助数码电子显微镜观察最优趋化参数下人参根腐菌和人参锈腐菌初生菌丝的生长状况。
1.2.13 数据分析数据采用Excel(2007版)软件进行处理,利用SPSS 18.0中的单因素方差分析(One-Way ANOVA 结合LSD)对统计结果进行显著性方差分析。
2 结果与分析 2.1 不同质量浓度的人参总皂苷对人参根腐菌和人参锈腐菌化学趋向性的影响人参根腐菌和人参锈腐菌分别对4种质量浓度的人参总皂苷表现出不同程度的化学趋向性响应,且都随着质量浓度的增加呈现先上升后下降的趋势(表 1)。其中,人参根腐菌对低、中质量浓度(0.2~20 mg/L)的人参总皂苷表现出正的趋化性,尤其在2 mg/L时的趋化性要显著高于其他组(P<0.05),CMI为1.339 0,当进行高质量浓度(200 mg/L)培养时,人参根腐菌则表现出负的趋化性响应;尽管人参锈腐菌对4种质量浓度(0.2~200 mg/L)的人参总皂苷均具有趋化性,但在20 mg/L时的趋化性最强且显著高于其他组(P<0.05),CMI为1.243 2。
|
|
表 1 人参总皂苷质量浓度、温度和pH值对人参根腐菌和人参锈腐菌化学趋向性的影响 (x±s,n = 3) Table 1 Effects of concentration of total ginsenosides,temperature,and pHvalue on chemotaxis response of F. solani and C. destructans (x±s,n = 3) |
不同温度培养条件下,人参根腐菌和人参锈腐菌对人参总皂苷的化学趋向性响应也不尽相同,但都随着温度的逐渐升高呈现先增强后减弱的趋势(表 1)。其中,在25 ℃培养条件下的人参根腐菌和人参锈腐菌分别对人参总皂苷表现出较强的化学趋向性响应,CMI分别为1.249 8和1.181 2,且显著高于同组其他试验组(P<0.05)。然而在进行30 ℃培养时,人参锈腐菌菌丝体失去活性,无法正常地生长,不存在化学趋向性响应。
2.3 pH值对人参根腐菌和人参锈腐菌化学趋向性的影响通过对人参根腐菌和人参锈腐菌进行不同pH值的人参总皂苷培养时发现,2种病原菌分别对其表现出了化学趋向性响应,且都随着pH值的逐级递增呈现由先增强后减弱的变化(表 1)。其中,人参根腐菌对偏弱酸性(pH 6)的人参总皂苷表现出较强的化学趋向性,CMI为1.233 0,显著高于其他组(P<0.05);而人参锈腐菌则对中性(pH 7)的人参总皂苷表现出较强的化学趋向性,CMI为1.249 4,显著高于其他组( P<0.05)。本实验中2种病原菌对人参总皂苷的最适趋化pH值都符合其生长pH值的范围。
2.4 最优趋化参数下人参根腐菌和人参锈腐菌对人参总皂苷的化学趋向性响应结果如图 2所示。人参根腐菌和人参锈腐菌在各自最优趋化参数下对人参总皂苷均表现出化学趋向性响应。其中,人参根腐菌对25 ℃、pH 6、质量浓度为2 mg/L的人参总皂苷表现出较强的化学趋向性,CMI为1.294 8;人参锈腐菌对25 ℃、pH 7、质量浓度为20 mg/L的人参总皂苷表现出较强的化学趋向性,CMI为1.255 6;这进一步表明2种病原菌的化学趋向性响应与其生长温度和pH值之间存在一定的偶联性和必然联系。
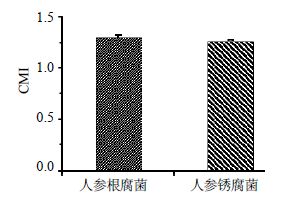
|
图 2 最优趋化参数下人参根腐菌和人参锈腐菌对人参总皂苷的化学趋向性响应 (x±s,n = 3) Fig. 2 Chemotaxis response of F. solani and C. destructans on total ginsenosides under optimal parameters (x±s,n = 3) |
在最优趋化参数下,人参根腐菌和人参锈腐菌病原孢子都能够进行正常萌发,且SGR均高于各自的对照组。其中,人参根腐菌和人参锈腐菌在各自对照试验组中的SGR分别为26%和25%,而在最优趋化试验组中孢子的SGR分别为66%和63%,结果如图 3所示。这说明低、中质量浓度的人参总皂苷能够诱导2种病原菌孢子的萌发,对孢子的生长具有促进作用。
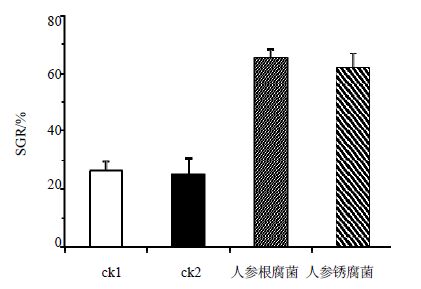
|
图 3 最优趋化参数下人参根腐菌 (对照组为ck1)和人参锈腐菌 (对照组为ck2)孢子的SGR (x±s,n = 3) Fig. 3 SGR of F. solani (control group ck1) and C. destructans (control group ck2) under optimal chemotaxis parameters (x±s,n = 3) |
人参根腐菌和人参锈腐菌在最优趋化条件下菌丝的CGR都随培养时间的增加而显著提高,且都在培养到第4天时达到最大生长指数,CGR分别为0.533和0.465,结果见图 4。然而2种病原菌在相同的培养时间里,其菌丝CGR的快慢关系是人参根腐菌>人参锈腐菌。通过以上现象的发生,认为2种病原菌对人参总皂苷的化学趋向性响应有助于菌丝的快速生长。
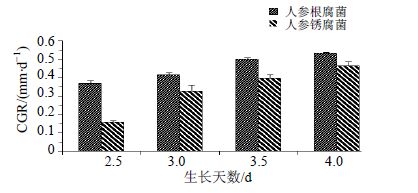
|
图 4 最优趋化参数下人参根腐菌和人参锈腐菌菌丝的CGR (x±s,n = 3) Fig. 4 Growth rates of F. solani and C. destructans under optimal parameters (x±s,n = 3) |
结果如图 5所示。人参根腐菌和人参锈腐菌分别在最优趋化参数培养下的MG都有所增加。其中,人参根腐菌和人参锈腐菌在试验组中的MG分别为0.522 0和0.449 4 mg/mL,而且滤过后溶液中的孢子数量也分别达到了5.75×107和3.75×107 CFU/mL,二者均显著高于各自对照组(ck1为0.111 3 mg/mL、1.25×107 CFU/mL;ck2为0.164 0 mg/mL、7.5×106 CFU/mL)。
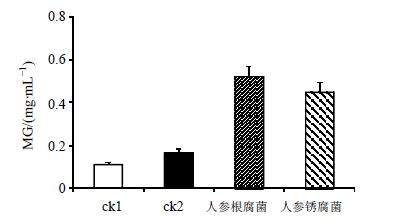
|
图 5 最优趋化参数下人参根腐菌 (对照组为ck1) 和人参锈腐菌 (对照组为ck2) 菌丝生长量 (x±s,n = 3) Fig. 5 MG of F. solani (control group ck1) and C. destructans (control group ck2) under optimal parameters (x±s,n = 3) |
图 6分别是人参根腐菌和人参锈腐菌在受到人参总皂苷的趋化作用下,其初生菌丝菌落边缘密度的显微鉴定。从图 6中可以看出,当2种病原菌初生菌丝由中心向两端生长时,由于受到人参总皂苷的趋化吸引,近实验组端的菌丝体生长较为密集,菌丝数量多、分枝多、密度高且坚挺饱满;然而近对照组端的菌丝体长势却较为稀疏,菌丝多细小、分枝少、密度低。这说明人参总皂苷能够调节菌丝体的活性,提高菌丝体对营养物质或水分的传输能力,从而诱导菌丝体积累丰富的营养物质促进自身的生长。

|
A1、B1实验组;A2、B2对照组 放大倍数:10倍目镜×10倍物镜,对称点取像 Test group: A1,B1; Control group: A2,B2. Magnification: 10x eyepiece multiplied by 10 ×objective lens,photograph of symmetry points 图 6 人参根腐菌 (A1、A2) 和人参锈腐菌 (B1、B2) 生长趋化性菌落边缘菌丝密度显微鉴定 Fig. 6 Microcosmic map of F. solani (A1,A2) and C. destructans (B1,B2) |
本实验进行了人参根腐菌和人参锈腐菌对人参总皂苷化学趋向性响应的研究,人参根腐菌对低质量浓度的人参总皂苷表现出较强的化学趋向性,CMI为1.294 8,SGR为66%,CGR为0.533,MG为0.522 0 mg/mL;人参锈腐菌则对中质量浓度的人参总皂苷表现出较强的化学趋向性,CMI为1.255 6,SGR为63%,CGR为0.465,MG为0.449 4 mg/mL,这说明低、中质量浓度的人参总皂苷对2种病原菌的化学趋向性响应具有促进作用,而且受此趋化影响下2种病原菌的SGR、CGR以及MG都有显著地增加。
植物通过主动释放和淀积多种有机物,为根际微生物提供碳源、能源和生长因子,同时还释放化多种感物质和信号物质。不同植物根系分泌物能够对土壤微生物种类、微生物区系、生理特性及其诱导抗性等产生一定影响。许多微生物的数量也与根系分泌物的积累呈正相关[12, 13]。目前,植物根系分泌物与病原菌的互作及其机制已引起不少学者的重视,许多微生物对根系分泌物都具有化学趋向性响应[14, 15, 16, 17]。人参皂苷对人参土传病害孢子萌发、生长以及菌落的形成均起着不同程度的化感作用,同时也影响着其他微生物的生长[5, 18, 19]。通过本实验研究发现,人参根腐菌和人参锈腐菌分别对低、中质量浓度的人参总皂苷表现出较强的化学趋向性响应,而且在最优趋化参数下2种病原菌的SGR、CGR以及MG等都得到了显著提高,但却随人参总皂苷质量浓度的升高而降低,尤其在进行高浓度培养时,人参根腐菌则表现出了负的化学趋向性响应,而人参锈腐菌仍然保持着正的化学趋向性响应。推测这可能是由于菌丝体细胞膜上编码信号转导蛋白的基因受到高浓度的人参总皂苷刺激发生突变,胞间信号传递受阻,失去感应外界环境刺激的能力,以至于菌丝体丧失化学趋向性响应;然而人参锈腐菌可能自身携带2个或多个同源编码信号转导蛋白的等位基因,即使个别基因发生突变,也不会影响胞间信号的传递,仍然对外界刺激产生化学趋向性响应,具体机制还有待进一步研究。
有研究指出,温度对微生物化学趋向性的影响可能与微生物细胞内膜上受体蛋白的甲基化和磷酸化有关,且都随温度的升高而增强,因为有酶参与了磷酸化和甲基化的过程,而酶的活性受温度的影响[20]。同样,本实验中的2种病原菌也都随着温度的改变对人参总皂苷表现出不同的化学趋向性响应,最适温度也恰好落在2种菌丝体的生长温度范围内,即存在一定的偶联性。与此同时,人参根腐菌和人参锈腐菌都对偏弱酸性和中性的人参总皂苷表现出了较强的化学趋向性响应,且都与各自的生长pH值相符,这说明菌丝体的化学趋向性与自身生物学特性之间有着必然联系。
| [1] | 傅俊范. 药用植物病理学[M]. 北京:中国农业出版社, 2007. |
| [2] | Lee S G. Fusarium species associated with ginseng(Panax ginseng) and their role in the root-rot of ginseng plant[J]. Res Plant Dis, 2004, 10(2):248-259. |
| [3] | 雷锋杰, 张爱华, 张秋菊, 等. 人参、西洋参化感作用研究进展[J]. 中国中药杂志, 2010, 35(17):2221-2226. |
| [4] | 杨靖春, 李治平, 酒井斐子. 人参根系分泌物及其对人参根际微生物作用的研究[J]. 东北师大学报:自然科学版, 1982, 12(1):71-77. |
| [5] | Nicol R W, Yousef L, Traquair J A, et al. Ginsenosides stimulate the growth of soilborne pathogens of American ginseng[J]. Phytochemistry, 2003, 64(1):257-264. |
| [6] | 张爱华, 彭洪利, 雷锋杰, 等. 人参根系分泌物的提取及鉴定[J]. 西北农林科技大学学报:自然科学版, 2014, 42(7):191-196. |
| [7] | 李燕, 牟伯中. 细菌化学趋向性研究进展[J]. 应用与环境生物学报, 2006, 12(1):135-139. |
| [8] | 华辰雷, 郑小波, 王源超. 大豆疫霉G蛋白α亚基调控游动孢子对大豆异黄酮的趋化性[A]//中国植物病理学会2008年学术年会论文集[C]. 广州:中国植物病理学会, 2008. |
| [9] | 孙思, 王军. 链格孢菌对银海枣的趋向性与其对寄主识别和侵染的联系[J]. 林业科学, 2009, 45(1):107-111. |
| [10] | 李勇, 刘时轮, 黄小芳, 等. 人参(Panax ginseng)根系分泌物成分对人参致病菌的化感效应[J]. 生态学报, 2009, 29(1):161-168. |
| [11] | 樊慕贞, 董金皋, 杨俊国, 等. 白菜黑斑病菌(Alternaria brassicae)菌丝生长和毒素产生条件的研究[J]. 河北农业大学学报, 1995, 18(4):21-27. |
| [12] | 史刚荣. 植物根系分泌物的生态效应[J]. 生态学杂志, 2004, 23(1):97-101. |
| [13] | Darrah P R. Models of the rhizosphere[J]. Plant Soil, 1991, 133(2):187-199. |
| [14] | Lakshmanan V, Kitto S L, Caplan J L, et al. Microbe-associated molecular patterns-triggered root responses mediate beneficial rhizobacterial recruitment in Arabidopsis[J]. Plant Physiol, 2012, 160(3):1642-1661. |
| [15] | 林辉锋. 不同水分条件下化感水稻根际功能微生物研究[D]. 福州:福建农林大学, 2010. |
| [16] | 林文雄. 化感水稻抑草作用的根际生物学特性与研究展望[J]. 作物学报, 2013, 39(6):951-960. |
| [17] | 林瑞余, 戎红, 周军建, 等. 苗期化感水稻对根际土壤微生物群落及其功能多样性的影响[J]. 生态学报, 2007, 27(9):3644-3654. |
| [18] | 张爱华, 雷锋杰, 许永华, 等. 人参皂苷对人参主要土传病害的化感作用[A]//中国第四届植物化感作用学术研讨会论文摘要集[C]. 青岛:中国植物保护学会植物化感作用专业委员会, 2009. |
| [19] | 赵智灵, 刘学周, 魏晓雨, 等. 人参可利用内生菌株的筛选和鉴定[J]. 中草药, 2015, 46(14):2143-2148. |
| [20] | Larsen M H, Blackburn M, Larsen J L, et al. Influences of temperature, salinity and starvation on the motility and chemotactic response of Vibrio anguillarum[J]. Microbiology, 2004, 150(5):1283-1290. |
 2016, Vol. 47
2016, Vol. 47


