铁皮石斛Dendrobium officinale Kimura et Migo,又名黑节草,多年生草本植物,为兰科第2大属植物。它是一种常用名贵中药[1],至今已有1 500多年药用历史。历代医著如《道藏》《神农本草经》《本草纲目拾遗》等均有记载[2]。《中国药典》2010年版中记载铁皮石斛具有益胃生津、滋阴清热的疗效,主要用于口干烦渴、胃阴不足、病后虚热不退、阴虚火旺、骨蒸劳热等症[3]。现代医学研究表明,铁皮石斛具有抗衰老、抗肿瘤、降血糖和提高免疫等作用[4]。十几年来,国内外学者对铁皮石斛化学成分进行了大量研究,发现铁皮石斛化学成分多样,包括生物碱、多糖、酚类、联苄、倍半萜类和糖苷等,主要药用成分是多糖和生物碱[5, 6],这些药用成分受到了人们极大的关注,具有很重要的药用价值。有研究表明石斛中的生物碱大多属于萜类吲哚生物碱[4, 7],此类生物碱起源于2条途径,莽草酸途径(吲哚途径)和萜类途径(MVA、MEP途径)。
4-羟基-3-甲基-2-E-丁烯基-1-焦磷酸合成酶(4-hydroxy-3-methylbut-2-en-1-yl diphosphate synthase,HDS)参与MEP途径中的倒数第2个反应,催化2-C-甲基赤藓醇-2,4-环焦磷酸生成4-羟基-3-甲基- 2-E-丁烯基-4-磷酸,HDS属于gcpE蛋白超家族,是一种铁硫蛋白。目前HDS基因已从毛果杨[8]、黄花蒿[9]、萝芙木[10]、银杏[11]、长春花[12]和拟南芥[13]等植物中克隆出来,但在铁皮石斛中的克隆仍未见报道。有研究表明,拟南芥HDS起到调控代谢流作用[13]和转录后相关调控作用[12, 14]。本实验以铁皮石斛为材料,采用RT-PCR和RACE等方法克隆铁皮石斛HDS(DoHDS)cDNA全长,并对其序列进行生物信息学分析、原核表达分析和不同组织的Real-Time PCR分析,为进一步研究MEP途径作用机制及HDS在萜类化合物合成中的作用提供理论依据。
1 材料与试剂 1.1 材料铁皮石斛组培苗取自安徽农业大学生命科学学院,由安徽农业大学蔡永萍教授鉴定为铁皮石斛Dendrobium officinale Kimura et Migo。
1.2 主要试剂总RNA提取试剂盒RNAprep Pure Plant Kit、FastQuant RT Kit购自北京Tiangen公司;RACE试剂盒、pMD18-T载体试剂盒、SYBR® Premix Ex TaqTM II均购自TaKaRa公司;EasyTaq Buffer、EasyTaq DNA Polymerase、dNTPs购自北京全式金公司。
2 方法 2.1 总RNA的提取与反转录取新鲜的铁皮石斛组培苗0.1 g,用灭菌水清洗去除残留培养基,并用滤纸吸干,液氮中迅速研磨成粉末,然后按照RNAprep Pure Plant Kit(Tiangen)说明书进行RNA提取。利用超微量分光光度计检测RNA浓度和质量。并以此为模板按照FastQuant RT Kit说明书进行RNA反转录成cDNA。
2.2 引物设计根据GenBank上已登录的HDS氨基酸序列,如拟南芥、毛果杨、黄花蒿、萝芙木、银杏、长春花等,利用DNAMAN软件比对氨基酸同源性,挑选两段高度保守区段序列设计简并引物(表 1)。
|
|
表 1 引物名称及序列 Table 1 Names and seqences of primers |
首先以反转录合成的cDNA为模板,利用引物HDS-S和HDS-R进行PCR扩增。PCR反应体系:上下游引物各1.5 μL,模板cDNA 2 μL,10×PCR Buffer 2.5 μL,dNTP(10 mmol/L)2 μL,Taq酶(5 U/μL)0.25 μL,最后用ddH2O补充至总体积25 μL;反应程序:94 ℃预热5 min,94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸1 min,35个循环,72 ℃再次延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,根据DNA胶回收试剂盒(生工)说明书回收目的片段,然后连接克隆载体pMD18-T,转化大肠杆菌DH5α感受态细胞,经氨苄固体培养基过夜培养后,挑取单菌落经菌液PCR鉴定后委托上海生工有限公司进行测序。
2.4 DoHDS的RACE扩增及全长cDNA序列的获得参照TaKaRa 3’-Full RACE Kit和5’-Full RACE Kit 说明书将铁皮石斛总RNA分别反转录成cDNA;按照TaKaRa 3’RACE和5’RACE试剂盒说明书,以及已得到的核心片段序列,使用Primer Premier 5.0设计3’RACE和5’RACE反应所需的巢式引物:HDS-3-OUT、HDS-3-IN、HDS-5-OUT、HDS-5-IN(表 1);分别对DoHDS的3’端和5’端进行巢式PCR扩增,PCR产物的回收、TA克隆与测序方法均同“2.3”项。将DoHDS的核心片段、3’端和5’端序列利用DNAMAN软件进行拼接,获得该基因的全长cDNA序列。根据拼接得到的全长序列,分别在5’端和3’端设计特异性引物HDS-CDS-S、HDS-CDS-R(表 1),进行PCR扩增得到目的基因,PCR产物的回收、TA克隆与测序方法均同上。
2.5 DoHDS生物信息学分析将获得的DoHDS编码的氨基酸序列在GenBank数据库中进行Blast比对分析,利用DNAMAN软件对已发表的其他植物的HDS编码的氨基酸序列进行同源性分析,并通过MEGA6.0软件中的Neighbor-Joining法构建系统进化树。在线网站分析,预测相对分子质量及等电点(http://web. expasy.org/protparam/),进行疏水性分析(http://web.expasy.org/protscale/),跨膜结构分析(http://www.cbs.dtu.dk/services/TMHMM/),预测信号肽(http://www.cbs.dtu.dk/services/SignalP),亚细胞定位分析http://www.cbs.dtu.dk/services/(TargetP-1.1/ output.php),蛋白质的二级结构分析(https://npsa-prabi. ibcp.fr/cgi-bin/npsa_ automat.pl?page=npsa_sopma.html)。
2.6 DoHDS的组织特异性表达分析采用RNAprep Pure Plant Kit试剂盒分别提取同一生长时期铁皮石斛原球茎、根、茎、叶的总RNA,用超微量分光光度计检测RNA浓度和质量。将上述总RNA按照1 μg的量用PrimeScriptTM RT reagent Kit(TaKaRa)反转录成cDNA。以持家基因β-actin[15](引物β-actin-RTS和β-actin-RTR,表 1)为内参;根据DoHDS的全长cDNA序列采用Primer Premier 5.0设计实时荧光定量PCR引物:HDS-RTS和HDS-RTR(表 1)。反应体系:10 μL SYBR® Premix Ex TaqTM II,2 μL cDNA,0.8 μL HDS-RTS和HDS-RTR,0.4 μL ROX,用ddH2O补至20 μL;反应程序:95 ℃、30 s,95 ℃、5 s,60 ℃、34 s,40个循环。实验进行3次重复;结果采用2-ΔΔCt法来计算DoHDS在不同组织的相对表达量。
2.7 DoHDS的原核表达分析 2.7.1 原核表达载体的构建根据目的基因DoHDS的核苷酸序列设计带有BamH I和Not I酶切位点的引物HDS-CDS-S和HDS-CDS-R(同全长引物,表 1)来扩增DoHDS的cDNA全长。PCR产物的胶回收、TA克隆等方法均同“2.3”项。测序验证正确后提取pMD18-T-DoHDS质粒,用BamH I和Not I酶将HDS-pMD18-T质粒和原核表达载体pET-28a (+) 质粒分别进行双酶切,胶回收后用T4连接酶于室温过夜连接,转化大肠杆菌DH5α过夜培养,挑取阳性单菌落进行菌液PCR鉴定后,提取质粒后进行酶切验证,获得原核表达载体pET-28a (+)-DoHDS。
2.7.2 原核蛋白的诱导将构建好的原核表达载体pET-28a(+)-DoHDS转化到表达菌株BL21(DE3)中,在含有50 mg/L卡那霉素的LB平板上过夜培养后,挑取阳性单菌落到5 mL含有50 mg/L卡那霉素的LB培养基中37 ℃震荡培养,培养一段时间后菌液A600值达到0.6~0.8,进行PCR鉴定,再加入0.2 mmol/L异丙基硫代半乳糖苷(IPTG)诱导蛋白表达,每隔1 h取1 mL菌液备用。空载质粒pET-28a (+) 和不加IPTG诱导DoHDS蛋白表达的操作同上。将上述收集的菌液12 000×g离心5 min后用5×Loading Buffer重悬菌体。然后100 ℃煮沸5 min,12 000×g离心2 min,收集上清液。取10 μL上清液进行SDS-PAGE电泳、染色、脱色。
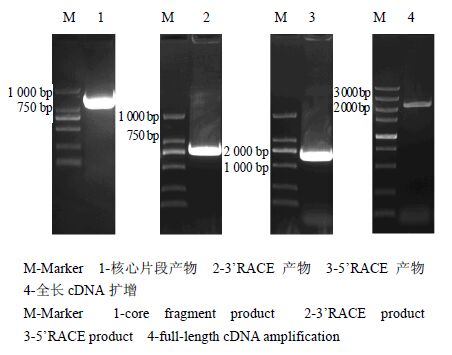
3 结果与分析 3.1 DoHDS全长的克隆以铁皮石斛cDNA为模板,用简并引物HDS-S、HDS-R(表 1)扩增得到1条约850 bp的PCR产物,扩增产物符合引物设计的大小(图 1)。胶回收产物经TA克隆和测序分析得到该基因中间片段,长度为821 bp,将该片段在NCBI的数据库中进行Blast比对分析,发现该序列与其他植物的HDS核酸序列相似度较高,推测此序列为DoHDS基因的核心片段。
|
图 1 DoHDS基因全长cDNA克隆 Fig. 1 Clone of full-length cDNA of DoHDS gene |
根据已经获得的DoHDS核心序列设计3’RACE 和5’RACE引物(表 1),进行巢式PCR扩增,获得HDS的3’端699 bp(图 1)和5’端1 572 bp(图 1),用DNAMAN软件拼接DoHDS cDNA全长,并设计全长引物(表 1),以铁皮石斛的cDNA为模板,进行PCR扩增,经测序得到一段大小为2 666 bp的片段(图 1)。将该片段再次在NCBI的数据库中进行Blast分析,进一步验证所得基因序列为DoHDS的cDNA完整序列。其中开放阅读框(ORF)长度为2 238 bp,5-UTR 149 bp,3-UTR 279 bp,编码745 个氨基酸,命名为DoHDS,并提交至NCBI数据库(GenBank 登录号KJ161312)。
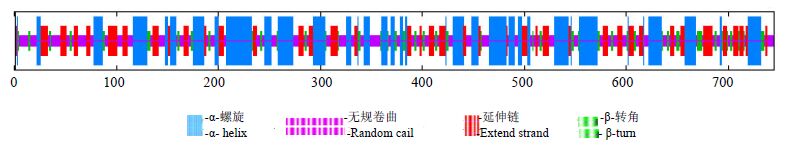
3.2 DoHDS生物信息学分析利用在线网站(http://web.expasy.org/ protparam/)预测DoHDS蛋白相对分子质量为82 700,等电点5.81,化学式C3646H5843N1015O1104S3。利用PBIL LYON-GERLAND信息库对DoHDS蛋白序列进行二级结构预测,分析可知DoHDS蛋白由α-螺旋、β-转角、伸展链和无规则卷曲组成。其中α-螺旋共261个,占总蛋白质的35.03%;β-转角81个,占总蛋白质的10.87%;伸展链172个,占总蛋白质的23.09%;无规卷曲231个,占总蛋白质的31.01%(图 2)。分析疏水性最小峰值为-3.056,在第210和211个氨基酸位置,疏水性最大峰值为2.522,在第680个氨基酸位置,分析可知DoHDS编码的蛋白质为亲水性蛋白。TMHMM跨膜结构分析表明,DoHDS蛋白无跨膜结构,分析得知DoHDS蛋白位于膜外。SignalP 4.1 Server 预测DoHDS蛋白无信号肽。亚细胞定位分析表明,DoHDS蛋白定位于叶绿体的机率为0.147,线粒体为0.026,其他细胞器为0.677。
|
图 2 DoHDS蛋白的二级结构预测 Fig. 2 Predicted second arystrueture of DoHDS protein in D. officinale |
通过DNAMAN软件对铁皮石斛DoHDS编码的氨基酸序列在NCBI上与多种植物进行氨基酸序列进行Blast比对(图 3),与拟南芥Arabidopsis thaliana (L.) Heynh、毛果杨Populus trichocarpa Torr. & Gray、丹参Salvia miltiorrhiza Bge.、茶树Camellia sinensis (L.) O. Ktze、萝芙木Rauvolfia verticillata (Lour.) Baill、银杏Ginkgo biloba L. 和长春花Catharanthus roseus (L.) G. Don等植物同源性高达89%。说明HDS在进化过程中较为保守。与其他植物氨基酸序列比对后发现,均含有多个保守半胱氨酸残基活性位点(图 3),这些活性位点可能参与催化底物还原过程中铁硫键的形成[16, 17]。利用MEGA 6.0软件中的Neighbor-Joining方法,将DoHDS蛋白与GenBank登录的11种植物的HDS蛋白构建系统进化树,进行聚类分析。结果表明(图 4),DoHDS蛋白与同为单子叶植物的海枣Phoenix dactylifera L. HDS蛋白聚为一类。

|
图 3 铁皮石斛与其他植物HDS氨基酸序列同源性比对 Fig. 3 Homologous comparison on HDS amino acid sequence in D. officinale and other plants |

|
图 4 铁皮石斛与其他植物HDS氨基酸的系统进化树 Fig. 4 Phylogenetic tree analysis of HDS in D. officinale and other plants |
以铁皮石斛的原球茎、根、茎、叶为研究材料,选择持家基因β-actin[15]为内参,利用实时荧光定量PCR仪检测不同组织中DoHDS的表达水平。结果显示在铁皮石斛各组织中DoHDS都有表达,且表达量依次为茎>根≈叶>原球茎(图 5);其中在茎中DoHDS表达量为原球茎的5倍。

|
图 5 DoHDS基因在铁皮石斛中的组织特异性表达分析 Fig. 5 Tissue-specific expression of DoHDS in D. officinale |
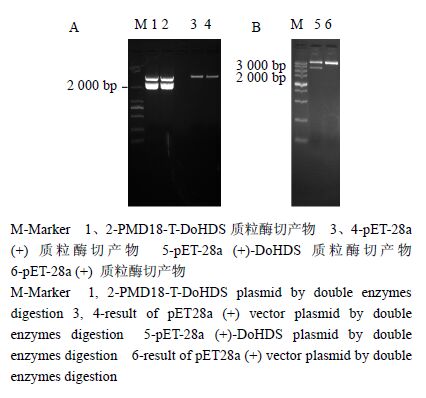
使用含有BamH I和Not I酶切位点的引物扩增DoHDS,经测序验证后,提取pMD18-T-DoHDS质粒,并使用BamH I和Not I同时进行双酶切pMD18-T-DoHDS质粒和pET28a (+) 质粒,琼脂糖凝胶电泳结果如图 6-A所示,形成单一的条带。结果表明酶切产物干净,没有拖带现象,说明酶切彻底。
|
图 6 DoHDS基因原核表达载体构建 Fig. 6 Construct DoHDS prokaryotic expression vector |
(+)-DoHDS重组质粒的鉴定 将上述的酶切产物胶回收后用T4连接酶连接,得到的重组质粒转化大肠杆菌DH5α,挑取阳性单菌落进行菌液PCR验证,然后挑选其中一个菌落进行扩大培养,提取质粒,进行酶切验证。由图 6-B显示pET-28a (+)-DoHDS重组质粒经双酶切后出现2条非常清晰的带,且一条与原片段大小一致,另一条与pET-28a (+)一致,说明pET-28a (+)-DoHDS重组质粒已经初步构建成功。
3.4.3 DoHDS蛋白的诱导表达与分析重组质粒pET-28a (+)-DoHDS转化大肠杆菌菌株BL21(DE3)后进行诱导表达,以空载pET-32a (+) 加IPTG与不加IPTG为对照,pET-28a (+)-DoHDS重组质粒在IPTG诱导1、2、3、4 h后,分离蛋白进行SDS-PAGE检测。结果如图 7所示,在80 000~120 000有不同于对照组的目的条带,显示诱导产物为一个相对分子质量(82 700)与理论值相符的融合蛋白,说明成功诱导表达了DoHDS蛋白,并发现不同时间的诱导对其表达量的影响不明显。

|
图 7 pET-28a (+)-DoHDS在大肠杆菌BL21中的诱导表达 Fig. 7 Expression of pET-28a (+)-DoHDS in E. coli BL21 |
铁皮石斛是我国兰科石斛属中珍稀濒危特有品种,具有重要的药用价值,其中生物碱是其主要药效成分之一。本研究从铁皮石斛中克隆出萜类化合物生物合成MEP途径上倒数第2个酶基因-DoHDS。HDS被认为在MEP途径中起着关键的调节代谢流的作用[13];而且其表达量的变化影响到萜类代谢物的产量。本研究表明,DoHDS cDNA全长2 666 bp,编码了745个氨基酸;序列比对分析结果表明DoHDS与长春花、银杏和拟南芥等HDS具有很高的同源性,保守结构域分析显示DoHDS蛋白为一多结构域蛋白,属gcpE蛋白家族成员,结构域中包括保守的半胱氨酸残基活性位点、底物结合位点和催化位点[18]。
本研究表明,在铁皮石斛的不同组织中DoHDS均有表达,但存在一定的表达差异。DoHDS在茎、根与叶的表达量分别为对照(原球茎)的5.1、1.69、1.68倍,在茎中表达量最高,而萝芙木[10]和茶树[18]中,HDS在叶片中的表达量均显著高于茎与根部。说明了同一基因在不同植物中,基因表达量不同;在同一植物不同组织中,基因表达量亦不相同。本实验构建了pET-28a (+)-DoHDS重组质粒,在大肠杆菌BL21成功诱导出DoHDS蛋白,其相对分子质量与预测一致,但不同时间的诱导对其表达量的影响不大。
总之,研究DoHDS在不同器官中的表达特征为探究DoHDS参与合成的萜类化合物代谢提供了理论依据;研究DoHDS在大肠杆菌中的表达情况为后续研究它的催化功能提供了一定的理论基础。
| [1] | 包雪声, 顺庆生, 陈立钻. 中国药用石斛[M]. 上海:上海医科大学出版社, 复旦大学出版社, 2001. |
| [2] | Ding G, Xu G, Zhang W, et al. Preliminary geoherbalism study of Dendrobium officinale food by DNA molecular markers[J]. Eur Food Res Tech, 2008, 227(4):449-456. |
| [3] | 中国药典[S]. 一部. 2010. |
| [4] | Guo X, Li Y, Li C, et al. Analysis of the Dendrobium officinale transcriptome reveals putative alkaloid biosynthetic genes and genetic markers[J]. Gene, 2013, 527(1):131-138. |
| [5] | 徐步青, 李振中, 张俊, 等. 不同培养条件对铁皮石斛类原球茎生物反应器培养的影响[J]. 中草药, 2014, 45(5):709-713. |
| [6] | Guevara-García A, San Román C, Arroyo A, et al. Characterization of the Arabidopsis clb6 mutant illustrates the importance of posttranscriptional regulation of the methyl-D-erythritol 4-phosphate pathway[J]. Plant Cell Online, 2005, 17(2):628-643. |
| [7] | 严亮. 中国传统兰科药用植物铁皮石斛基因组及其生物学特性研究[D]. 长春:吉林大学, 2014. |
| [8] | 刘立辉, 李成浩, 杨静莉, 等. 毛果杨1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合酶(HDS)基因的生物信息学分析[J]. 安徽农业科学, 2012(3):1300-1303. |
| [9] | 张祖荣, 廖志华, 彭梅芳. 黄花蒿HDS基因的克隆与功能分析[J]. 中草药, 2012, 43(1):148-154. |
| [10] | Chen Z Y, Yang M, Ming C X, et al. Cloning and characterization of MECS and HDS genes from Rauvolfia verticillata[J]. Plant Omics, 2011, 4(2):82-90. |
| [11] | Kim S M, Kim S U. Characterization of 1-hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate synthase(HDS) gene from Ginkgo biloba[J]. Mol Biol Rep, 2010, 37(3):973-979. |
| [12] | Oudin A, Mahroug S, Courdavault V, et al. Spatial distribution and hormonal regulation of gene products from methyl erythritol phosphate and monoterpene secoiridoid pathways in Catharanthus roseus[J]. Plant Mol Biol, 2007, 65(2):13-30. |
| [13] | Querol J, Campos N, Imperial S, et al. Functional analysis of the Arabidopsis thaliana GCPE protein involved in plastid isoprenoid biosynthesis[J]. Federation Eur Biochem Soc J Lett, 2002, 514:343-346. |
| [14] | Sauret-Gueto S, Botella-Pavia P, Flores-Perez U, et al. Plastid cues posttranscriptionally regulate the accumulation of key enzymes of the methylerythritol phosphate pathway in Arabidopsis[J]. Plant Physiol, 2006, 141(1):75-84. |
| [15] | Jin Q, Yao Y, Cai Y, et al. Molecular cloning and sequence analysis of a phenylalanine ammonia-lyase gene from Dendrobium[J]. PLoS One, 2013, 8(4):e62352. |
| [16] | Rekittke I, Nonaka T, Wiesner J, et al. Structure of the E-1-hydroxy-2-methyl-but-2-enyl-4-diphosphate synthase(GcpE) from Thermus thermophilus[J]. FEBS Lett, 2011, 585(3):447-451. |
| [17] | 吴秋菊, 武梅娟, 王翔, 等. 铁皮石斛1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸还原酶基因的克隆与表达分析[J]. 中草药, 2015, 46(3):405-411. |
| [18] | 蒋正中. 茶树MEP途径中HDS与HDR基因的cDNA全长克隆, 功能分析与表达特征研究[D]. 合肥:安徽农业大学, 2013. |
 2016, Vol. 47
2016, Vol. 47


