2. 浙江医药高等专科学校中药学院, 浙江 宁波 315100
2. Department of Chinese Materia Medica, Zhejiang Pharmaceutical College, Ningbo 315100, China
哮喘是一种严重影响人类健康的慢性呼吸道疾病,以气道间断性阻塞和可逆性气道高反应性为主要特征,是世界公认的医学难题,被世界卫生组织(WHO)列为四大顽症之一[1]。近20年来,随着全球范围内的空气污染和环境恶化,哮喘的发病率和死亡率呈现逐年上升态势,据统计,目前全球约有3亿人患有哮喘[2, 3]。哮喘的发病机制复杂,缺乏愈后良好的治疗药物,临床治疗哮喘的药物主要有抗炎的糖皮质激素类、β-受体激动剂类和抗白三烯类等,但这些药物都存在明显的不良反应,且易产生耐药性[4]。因此,寻找和发现新的抗哮喘药物及治疗靶点是当前研究的热点[5, 6, 7]。
近年来,Deshpande等[8]发现肺部气道存在苦味受体(bitter taste receptors,TAS2Rs),使用苦味物质刺激肺部气道TAS2Rs能从深处打开肺部气道,引起气道平滑肌舒张和支气管扩张,其效应甚至优于目前临床最好的哮喘治疗药物,并且与β-肾上腺素受体激动剂具有协同作用。TAS2R14是肺部TAS2Rs中表达最高的一种亚型,其编码基因位于12号染色体短臂,表达于人类呼吸道平滑肌细胞。TAS2R14受体的活化可导致细胞内钙离子浓度增加,促使位于细胞膜的钾离子通道开放,细胞膜超极化,平滑肌放松和支气管扩张[9]。因此,TAS2R14已成为哮喘治疗的新靶点。本研究拟建立特异性高表达受体TAS2R14的细胞模型,用于具有TAS2R14激动效应的中药及活性成分筛选,为研发治疗哮喘等慢性呼吸道疾病的新型药物提供依据。
1 材料 1.1 细胞、慢病毒载体系统及菌株人正常肺上皮细胞BEAS-2B细胞株、人胚肾细胞HEK293T细胞株,中国科学院上海细胞所;慢病毒载体系统(Tronolab)、大肠杆菌菌株DH5α,美国Invitrogen公司。
1.2 主要药物与试剂阳性药地芬尼多(批号20150321)和咖啡因(批号20150112),上海士锋生物有限公司;中药单体化合物:柠檬苦素(质量分数99.5%,批号20141225),芦丁(质量分数99%,批号20150224),奎宁(质量分数99.5%,批号20150118),购于西安开来生物工程有限公司;中药提取物由本实验室提取;MTT,美国Sigma公司;RPMI 1640培养液、胎牛血清(FBS),Hyclone公司;胰蛋白酶,Invitrogen公司;Axygen质粒抽提试剂盒,美国Omega Bio-Tek公司;引物合成,上海生工生物工程有限公司;阳性克隆测序,南京金斯瑞生物科技有限公司;Trizol,Invitrogen公司;基因组DNA提取试剂盒,TaKaRa公司;琼脂糖,赛百盛公司;T4 DNA连接酶,NEB公司;NucleoSpin RNA Clean-up试剂盒,MN公司;RT-PCR试剂盒,TaKaRa公司;其他试剂购自上海试剂公司。
1.3 仪器LSM-710激光扫描共聚焦显微镜(德国CarlZeiss公司);CO170S-230-1000型CO2培养箱(美国New Brunswick Scientific公司);Realplex.2s实时荧光定量PCR(RT-PCR)仪(美国Eppendorf公司);BMI 3000荧光倒置显微系统(Leica公司)。
2 方法 2.1 表达TAS2R14基因慢病毒载体的构建严格按照基因组DNA提取试剂盒说明书提取BEAS-2B细胞基因组DNA,用PCR法扩增得到TAS2R14基因的序列(序列号NM_181745),设计引物,上游引物为5’-CACTGGTGAACTGTATT- GACTGG-3’,下游引物为5’-GAGATTGCCAAAG- CAGTGAGGATGTGACCTGAG-3’。病毒包装系统为四质粒系统,组成为pRsv-REV、pMDlg-pRRE、pMD2G、Transfer Vector,其中Transfer Vector含有能表达绿色荧光蛋白(GFP)的片段。限制性内切酶Sal I、Sac II双酶切慢病毒载体和TAS2R14基因片段,使其带有黏性末端,DNA凝胶试剂盒回收。在T4 DNA连接酶的作用下进行慢病毒载体和TAS2R14基因的连接反应,反应体系为10×T4 DNA连接酶1.0 μL,慢病毒载体和TAS2R14基因DNA片段各1.0 μL,加ddH2O至10 μL,以上试剂混合后反应12 h。取连接产物转化DH5α感受态菌株,挑取单克隆菌落,RT-PCR法筛选阳性克隆。严格按照Axygen质粒抽提试剂盒说明书抽提重组质粒,送南京金斯瑞生物科技有限公司经测序鉴定构建成功。
2.2 慢病毒包装与转染HEK293T细胞接种于12孔板中,接种密度为1×104/mL,于37℃、5% CO2培养箱中培养过夜。当细胞密度达到80%左右时将慢病毒载体用CaCl2转染法共转染,同时加入10 μg/mL聚凝胺以增加感染效率。24 h后更换为完全培养基,荧光倒置显微镜下观察,选择荧光素酶表达较好的细胞,用有限稀释法挑选单克隆。
2.3 转染效率检测及激光共聚焦观察倒置显微镜下观察慢病毒感染HEK293T细胞GFP表达情况,在Fluo Star Optima荧光仪上测定荧光强度,设定激发光波长538 nm,测定对照组(转染空载体)和模型组(慢病毒转染)细胞荧光强度,计算相对荧光强度,采用激光扫描共聚焦显微镜检测pLVX-AcGFP1- N1-TAS2R14重组载体表达位置。
相对荧光强度=模型组荧光强度/对照组荧光强度
2.4 RT-PCR检测TAS2R14 mRNA表达对照组(转染空载体)和模型组(慢病毒转染)细胞分别以1×104/mL接种于6孔板中,待细胞长到90%左右时每孔加入1mL Trizol提取模型组和对照组细胞总RNA,NucleoSpin RNA Clean-up试剂盒纯化RNA,利用TaKaRa公司RT-PCR试剂盒将细胞总RNA逆转录成cDNA进行RT-PCR。引物序列:人TAS2R14上游引物为5’-CACTGGTGAA- CTGTATTGACTGG-3’,下游引物为5’-GAGATTG-CCAAAGCAGTGAGGAT-3’。人18 S上游引物为5’-GACTCAACACGGGAAACCTCAC-3’,下游引物为5’-CCAGACAAATCGCTCCACCAAC-3’。
RT-PCR反应参数设置:95 ℃、1 min;95 ℃、30 s;60 ℃、30 s;72 ℃、30 s;95 ℃、10 s;65 ℃、40 s;40 ℃、60 s。以人18 S为内参,检测目的基因相对内参基因的表达量。用2−ΔΔCt法计算模型组目的基因相对对照组的表达量。另以逆转录获得的cDNA为模板进行PCR扩增,取10 μL PCR扩增产物进行2%琼脂糖凝胶电泳分析,紫外线透射下拍照。
2.5 模型特异性和稳定性考察使用经典TAS2R14受体激动剂地芬尼多和咖啡因来刺激模型细胞,作为阳性对照组,阴性对照组则加入等体积的溶剂刺激模型细胞;选择国际公认的统计学参数Z′因子来判断高通量筛选模型稳定性,计算公式为:
Z′=1-3 (SDneg+SDpos)/|Mpos-Mneg|
Mpos阳性对照的平均荧光值,Mneg为阴性对照的平均荧光值,SDneg为阴性对照的标准偏差,SDpos阳性对照的标准偏差
当Z′<0.5时,分析条件不能用于高通量筛选,还需要进一步优化;如果Z′>0.5则表示筛选体系有良好的稳定性,可进行高通量筛选。
2.6 高通量筛选条件优化将慢病毒转染的HEK293T细胞以每孔1×104密度接种于96孔板,于37 ℃、5% CO2培养箱中培养4、8、12、24、36 h,检测荧光强度,确定最佳培养时间。将细胞分别以不同密度(每孔5×103、1×104、1.5×104、2.0×104、2.5×104、3.0×104个)接种于96孔板,于37 ℃、5% CO2培养箱中培养24 h后检测荧光强度,确定最佳细胞接种密度。
2.7 利用TAS2R14细胞模型筛选中药选用对数生长期贴壁的慢病毒转染的HEK293T细胞,胰酶消化后,用含10% FBS的RPMI l640培养基配成1×104/mL的细胞悬液,接种于96孔培养板中,每孔接种100 μL,37 ℃、5% CO2及饱和湿度培养。模型组加入PBS,以地芬尼多和咖啡因作为阳性对照,在Fluo Star Optima荧光仪上测定荧光强度,设定激发光波长为538 nm,24 h后测定细胞的荧光强度。初筛采用4复孔实验,共测试120个中药样品及单体化合物,样品平均孔荧光强度如大于模型组50%以上,则认为此样品为初筛阳性样品。设置药物浓度梯度(0、3、10、30、90 μmol/L)进行复筛,并设置相应浓度的药物溶液进行本底对照。复筛2次均呈阳性确定为阳性样品,并在荧光显微镜下观察候选药物对模型细胞荧光强度表达的影响。
采用MTT法检测复筛阳性样品对慢病毒转染的HEK293T细胞增殖活性的影响,具体操作步骤:选用对数生长期的贴壁细胞,以1×104/mL的细胞密度接种于96孔培养板,每孔接种100 μL,置CO2培养箱中过夜。给药组给予相应浓度药物,空白对照加入等体积的溶剂(无血清RPMI 1640培养基),37 ℃、5% CO2培养36 h。弃去上清液,每孔加入20 μL新鲜配制的含0.2 mg/mL MTT的无血清培养基,37 ℃继续培养4 h。小心吸去上清液,并加入150 μL DMSO,用微型超声振荡器混匀后,酶标仪检测570 nm处吸光度(A)值,参比波长为450 nm。
2.8 统计学分析结果以x±s表示,采用SPSS 19.0软件进行统计学分析,组间比较采用单因素方差分析(one-way ANOVA)。
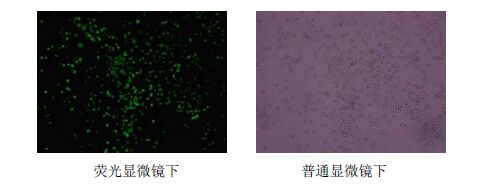
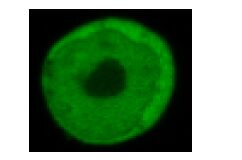
3 结果 3.1 荧光报告基因表达检测激发光波长为538 nm,慢病毒转染pLVX- AcGFP1-N1-TAS2R14重组载体后,模型组与对照组比较,相对荧光强度显著增强,结果见图 1。倒置荧光显微境下观察GFP的表达情况,模型组表达GFP的HEK293T细胞约占细胞总数的90%左右,证明慢病毒转染成功,结果见图 2。激光扫描共聚焦显微镜检测pLVX-AcGFP1-N1-TAS2R14重组载体表达位置,荧光主要表达于细胞膜及细胞质,结果见图 3。

|
图 1 转染pLVX-AcGFP1-N1-TAS2R14重组载体前后相对荧光强度 (x±s,n = 5) Fig. 1 Relative fluorescence intensity before and after transfection of pLVX-AcGFP1-N1-TAS2R14 recombinant vector (x±s,n = 5) |
|
图 2 慢病毒感染HEK293T细胞GFP表达情况 Fig. 2 GFP expression in lentivirus infected HEK293T cells |
|
图 3 激光共聚焦检测HEK293T细胞GFP表达位置 Fig. 3 Position of GFP expression in HEK293T cells detected by laser confocal microscope |
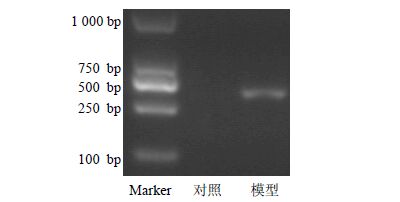
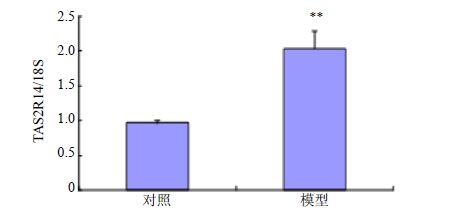
分别提取模型组和对照组HEK293T细胞株RNA,经反转录得到cDNA,PCR扩增获得的目的基因片段经凝胶电泳分离后出现特异性条带,与TAS2R14基因片段的理论相对分子质量基本一致,结果见图 4。RT-PCR结果显示,模型组与对照组比较,TAS2R14 mRNA表达水平升高2.3倍,差异显著,表明TAS2R14细胞筛选模型构建成功,结果见图 5。
|
图 4 TAS2R14产物凝胶电泳图 Fig. 4 Electrophoretogram of TAS2R14 product |
|
图 5 模型组与对照组TAS2R14 mRNA相对表达情况 (x±s,n = 3) Fig. 5 mRNA expression of TAS2R14 in control group and model group (x±s,n = 3) |
分别用地芬尼多和咖啡因刺激TAS2R14模型细胞,24 h后检测荧光强度,相对荧光强度与阳性药呈剂量依赖性增长,8 μmol/L的地芬尼多诱导倍数可达到4.9倍,8 μmol/L的咖啡因诱导倍数可达到3.8倍,结果见图 6。Z′因子反映了筛选体系的可靠性和稳定性,综合考虑了信号/噪音比和重复性等因素。Z′因子越接近1,筛选体系越稳定。阳性药地芬尼多和咖啡因刺激模型细胞24 h后检测荧光强度,计算得到的Z′因子分别为0.69和0.66,均大于0.5,模型的稳定性良好,符合高通量筛选要求。

|
图 6 咖啡因 (A) 和地芬尼多 (B) 对TAS2R14细胞模型的激动作用 (x±s,n = 4) Fig. 6 Agonistic actions of caffeine (A) and diphenidol (B) on TAS2R14 cell model (x±s,n = 4) |
激动剂与受体作用后产生的荧光强度与激动剂与受体相互作用时间相关,孵育时间为18~24 h时,荧光素酶有最高的表达量,因此,后续高通量筛选中确定孵育时间为24 h。细胞接种数目对测试结果有重要影响,随着细胞接种密度增加,荧光强度增加,基底值也增加,当细胞接种密度为每孔2×104个时,荧光响应值与基底值差值最大,适于筛选。结果见图 7。

|
图 7 孵育时间与信噪比的关系优化 (A) 和接种密度与信噪比的关系优化 (B) (x±s,n = 4) Fig. 7 Relationship between cultivating time and signal-to-noise ratio (A) and inculation density and signal-to-noise ratio (B) (x±s,n = 4) |
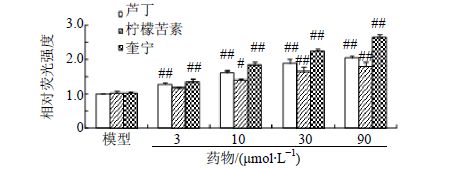
用构建好的TAS2R14报告基因系统对120种苦味中药提取物进行筛选,去掉由细胞毒引起的假阳性样品,筛选出白果、橙皮、鱼腥草的醇提物对TAS2R14细胞模型有明显的激动作用,相对荧光强度增加50%以上,结果见图 8。选取这3种苦味中药中的主要单体成分进行进一步的高通量筛选,结果发现芦丁、奎宁、柠檬苦素能促进模型细胞的荧光表达。随着芦丁、奎宁、柠檬苦素浓度的增加和作用时间的延长,对TAS2R14模型细胞激动率逐渐增加,呈明显的剂量和时间依赖效应,结果见图 9。与模型组比较,给予相同浓度(10 μmol/L)的芦丁、奎宁、柠檬苦素及咖啡因24 h后,TAS2R14报告基因系统荧光强度显著增强,结果见图 10。MTT实验结果显示,给药浓度下,芦丁、柠檬苦素、奎宁对HEK293T细胞增殖无明显影响,因此排除了细胞增殖对荧光强度的影响,结果见表 1。

|
图 8 苦味中药的初步筛选结果 (n = 5) Fig. 8 Results of primary screening of bitter herbs (n = 5) |
|
图 9 芦丁、柠檬苦素、奎宁对TAS2R14细胞模型的激动作用 (x±s,n = 4) Fig. 9 Agonistic actions of rutin,limonin,and quinine on TAS2R14 cell model (x±s,n = 4) |

|
图 10 芦丁、柠檬苦素、奎宁、咖啡因对TAS2R14细胞模型的荧光表达影响 Fig. 10 Agonistic actions of rutin,limonin,quinine,and caffeine on fluorescence expression of TAS2R14 cell model |
|
|
表 1 芦丁、柠檬苦素、奎宁对HEK293T细胞增殖的影响 Table 1 Effects of rutin,limonin,and quinine on proliferation of HEK293T cells |
TAS2Rs属于G蛋白偶联受体(GPCRs)超家族,主要表达于口腔味蕾的受体细胞[10]。近年来研究发现,TAS2Rs除了在味觉系统表达外,也可在其他组织器官中表达,说明TAS2Rs除了感知苦味物质外,在人体内可能还有其他未被发现的重要生理功能。Singh等[11]发现,在初级神经元细胞中存在TAS2R4的转录产物,此外,TAS2Rs在胃肠组织中也有表达[12]。最近研究发现,在哮喘患儿的白细胞检测到了TAS2Rs的高表达。TAS2R14在人类呼吸道平滑肌细胞及肺部高表达,接受苦味物质刺激后能引起气道平滑肌舒张和支气管扩张,效果显著,TAS2R14受体激动剂与β-肾上腺素受体药物联用能增强其疗效,并能降低其副反应,具有很高的临床应用价值[13]。
中医认为,哮喘属于中医“哮病”范畴,其病理因素以痰为根本,多因肺、脾、肾三脏功能失衡,以致水湿内聚为痰,伏藏于肺,“伏痰”遇诱因引触,痰气搏击而发出痰鸣气喘声。止咳平喘的苦味中药之所以能用于治疗咳喘病症,在于其味苦能降泄肺气,且兼燥湿化痰之功效,减少气道阻力的同时,也能抑制过度释放的痰液和炎症介质,减少内源性病理物质的产生,增强机体免疫力,从而扶正祛邪,全面恢复机体功能[14, 15]。而这一功效特点正与“苦味受体可从深处打开肺部气道,扩张支气管”的生物学作用相一致。常用中药中很多都具有苦味成分,主要化学成分大致可归为生物碱类、黄酮类、苷类和萜类等[16]。而苦味药物的活性与其化学结构与空间构型均有关系,值得深入研究。
本实验以苦味受体TAS2R14为切入点,采用地芬尼多和咖啡因为阳性对照,计算建立的TAS2R14激动剂高通量筛选模型Z′因子分别为0.69和0.66,符合高通量筛选要求。通过对中药提取物样品库的筛选,发现白果、橙皮、鱼腥草的醇提物对模型细胞具有显著的激动作用,进一步实验发现,陈皮中的苦味单体化合物柠檬苦素、白果中的苦味单体化合物芦丁以及奎宁可激动TAS2R14模型细胞,提示其具有潜在的抗哮喘作用。目前已知具有收缩气管作用的苦味受体药物主要有士的宁、氯喹等,但因其强烈的细胞毒性以及副作用,难以作为治疗哮喘的药物投入临床。本实验筛选出的柠檬苦素、芦丁、奎宁毒性较低,对人支气管平滑肌细胞杀伤作用小,且对支气管存在一定的保护作用,为新型抗哮喘药物的进一步研发提供了基础。
| [1] | Li Y, Hu G, Cheng Q. Implantation of human umbilical cord mesenchymal stem cells for ischemic stroke:perspectives and challenges[J]. Front Med, 2015, 9(1):20-29. |
| [2] | 陈薇, 胡玉英. 中医药治疗缺血性中风研究进展[J]. 中西医结合心脑血管病杂志, 2012, 10(4):474-475. |
| [3] | 王丹. 银杏健脑片质量研究[D]. 长春:吉林农业大学, 2014. |
| [4] | Latifpour M, Shakiba Y, Amidi F, et al. Differentiation of human umbilical cord matrix-derived mesenchymal stem cells into germ-like cells[J]. Avicenna J Med Biotechnol, 2014, 6(4):218-227. |
| [5] | 陈韵羽. 肾脑复元汤对局灶性脑缺血大鼠GDNF和NGF蛋白表达水平的影响[D]. 长沙:湖南中医药大学, 2014. |
| [6] | 范金花. 肾脑复元汤对缺血性脑损伤大鼠Brdu、Nestin及相关细胞因子的影响[D]. 长沙:湖南中医药大学, 2014. |
| [7] | Kuptsova K, Kvist E, Nitzsche F, et al. Combined enriched environment atipamezole treatment transiently improves sensory functions in stroke rats independent from neurogenesis and angiogenesis[J]. Rom J Morphol Embryol, 2015, 56(1):41-47. |
| [8] | Zhang L, Li Y, Zhang C, et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia[J]. Stroke, 2011, 42(5):1437-1444. |
| [9] | Lin Y C, Ko T L, Shih Y H, et al. Human umbilical mesenchymal stem cells promote recovery after ischemic stroke[J]. Stroke, 2011, 42(7):2045-2053. |
| [10] | 张忠伟, 胡国恒. 肾脑复原汤治疗脑梗死恢复期肾虚血瘀证30例疗效观察[J]. 湖南中医杂志, 2014, 30(4):11-13. |
| [11] | 胡国恒, 李映辰, 邹婷, 等. 肾脑复元汤对MCAO大鼠炎症因子及神经营养因子表达的影响[J]. 中药药理与临床, 2015, 31(2):81-85. |
| [12] | 黄文, 莫雪安, 张成, 等. BDNF体外诱导骨髓间充质干细胞对脑缺血大鼠神经缺失功能的作用[J]. 广西医科大学学报, 2012, 29(6):821-824. |
| [13] | Zhang Y, Pardridge W M. Blood-brain barrier targeting of BDNF improves motor function in rats with middle cerebral artery occlusion[J]. Brain Res, 2006, 11(11):227-229. |
| [14] | Sonmez A B, Castelnuovo J. Applications of basic fibroblastic growth factor(FGF-2, bFGF) in dentistry[J]. Dent Traumatol, 2014, 30(2):107-111. |
| [15] | Cai H, Xu X, Liu Z, et al. The effects of calcitonin gene-related peptide on bFGF and AQP4 expression after focal cerebral ischemia reperfusion in rats[J]. Pharmazie, 2010, 65(4):274-278. |
 2016, Vol. 47
2016, Vol. 47


