2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of Pharmaceutical Process New-tech for Chinese Medicine, Lianyungang 222001, China
复方红景天胶囊处方由红景天、玄参2味药材组成,主要用于治疗缺血性脑卒中[1]。据报道,红景天中主要含有红景天苷、酪醇、大花红天素、没食子酸、洛塞维等成分[2, 3]。红景天苷及其苷元酪醇为红景天已知有效成分[4, 5, 6, 7],大花红天素是红景天中特有成分,专属性好[2],药材中其量较高,对脑及肺微血管内皮细胞凋亡有调节作用[8, 9]。玄参中主要含有环烯醚萜类、苯丙素类、三萜皂苷类、有机酸类等成分,其中哈巴苷、哈巴俄苷、安格洛苷C为玄参主要活性成分[10]。原标准采用HPLC法分别测定了该制剂中红景天苷、酪醇、哈巴苷、哈巴俄苷、安格洛苷C;为更有效控制复方红景天胶囊的质量,本实验采用HPLC-UV-ELSD在同一色谱条件下,测定该制剂中大花红天素、没食子酸、红景天苷、酪醇、哈巴苷、哈巴俄苷、安格洛苷C、肉桂酸8个成分。结果表明,该方法良好,可为全面控制复方红景天胶囊内在质量提供参考。
1 仪器与试药ULtiMate 3000高效液相色谱仪,Thermo Fisher公司,DAD紫外检测器,SEDEX80 LT-ELSD检测器;BP211D、XP6电子天平,梅特勒-托利多国际股份有限公司。红景天苷(批号110818-201206,质量分数99.8%)、酪醇(批号111676-200401,质量分数100%)、没食子酸(批号110831-200803,质量分数90.1%)、肉桂酸(批号110786-200503,质量分数100%),均购自中国食品药品检定研究院;大花红天素,自制,批号20131210,质量分数99.89%;哈巴苷(批号MUST-15031105,质量分数99.88%)、哈巴俄苷(批号MUST-13071801,质量分数≥98%)、安格洛苷C(批号MUST-14120502,质量分数99.32%),成都曼斯特生物科技有限公司;复方红景天胶囊(批号140914、141015、141201、150311、150314、150316,规格:0.39 g/粒)由江苏康缘药业股份有限公司提供;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果 2.1 对照品溶液的制备取大花红天素、哈巴苷对照品适量,精密称定,加甲醇制成含大花红天素670.84 μg/mL、哈巴苷593.68 μg/mL的混合对照品储备液①。
取红景天苷、哈巴俄苷、安格洛苷C、没食子酸、酪醇、肉桂酸对照品适量,精密称定,加甲醇制成含红景天苷789.95 μg/mL、哈巴俄苷625.85 μg/mL、安格洛苷C 550.45 μg/mL、没食子酸114.10 μg/mL、酪醇196.25 μg/mL、肉桂酸68.95 μg/mL的混合对照品储备液②。
2.2 供试品溶液的制备取复方红景天胶囊内容物约0.2 g,精密称定,至50 mL量瓶中,加甲醇适量,超声处理30 min,放冷,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.3 阴性对照溶液制备依照复方红景天胶囊标准,由相关辅料制得复方红景天阴性胶囊,按照“2.2”项下方法制得空白对照溶液。
2.4 色谱条件色谱柱为KromasiL C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.3%冰醋酸水溶液[8],梯度洗脱程序为0~10 min,3%~10%乙腈;10~25 min,10%~25%乙腈;25~30 min,25%~50%乙腈;30~35 min,50%~80%乙腈;35~36 min,80%~3%乙腈;36~45 min,3%乙腈;体积流量1.0 mL/min,柱温30 ℃,进样体积10 μL;没食子酸、红景天苷、酪醇、哈巴俄苷、安格洛苷C、肉桂酸用紫外检测器检测,检测波长为275 nm;大花红天素、哈巴苷用蒸发光散射检测器检测,漂移管温度40 ℃,载气N2,压力为150 kPa。
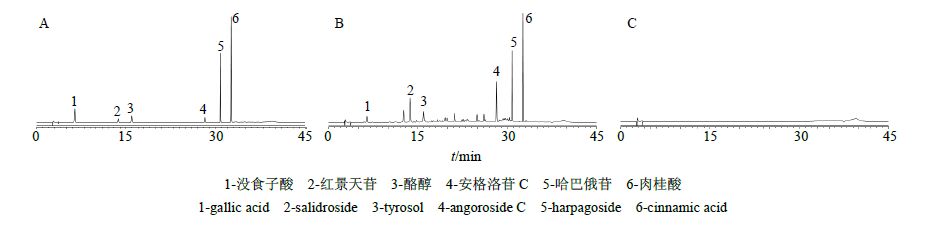
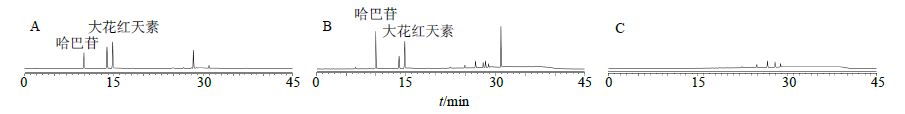
2.5 专属性考察分别精密吸取混合对照品溶液、供试品溶液和阴性对照溶液,按照“2.4”项下方法进样检测,结果表明供试品色谱图中呈现与对照品主峰保留时间一致的色谱峰,阴性对照无干扰。大花红天素、没食子酸、红景天苷、酪醇、哈巴苷、哈巴俄苷、安格洛苷C、肉桂酸与其相邻色谱峰的分离度均大于1.5,拖尾因子在1.00~1.10,理论塔板数以各色谱峰计均在10 000以上。结果见图 1~2。
|
图 1 混合对照品 (A)、复方红景天胶囊供试品 (B) 和阴性对照样品 (C) 的HPLC-UV色谱图 Fig. 1 HPLC-UVchromatograms of mixed reference substances (A),sample (B),and negative control sample (C) |
|
图 2 混合对照品 (A)、复方红景天胶囊供试品 (B) 和阴性对照样品 (C) 的HPLC-ELSD图谱 Fig. 2 HPLC-ELSD chromatograms of mixed reference substances (A),sample (B),and negative control sample (C) |
取“2.1”项下混合对照品储备液①,精密量取1.0、3.0、5.0、7.0、9.0、10.0 mL,分别置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,得系列混合对照品溶液。按“2.4”项色谱条件,分别精密吸取上述溶液各10 μL,测定峰面积,以质量浓度对数为横坐标(X),峰面积对数为纵坐标(Y)进行线性回归,结果表明,大花红天素、哈巴苷在相应质量浓度范围内呈良好线性关系,线性范围、回归方程、相关系数分别为大花红天素Y=1.030 8 X-1.590 7,R2=0.999 2,线性范围67.084~670.84 μg/mL;哈巴苷Y=1.007 6 X-1.756 8,R2=0.999 8,线性范围59.368~593.68 μg/mL。
取“2.1”项下混合对照品储备液②,精密量取1.0、2.0、4.0、6.0、8.0、10.0 mL,分别置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,得系列混合对照品溶液。按“2.4”项色谱条件,分别精密吸取上述溶液各10 μL,测定峰面积,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,结果表明,红景天苷、哈巴俄苷、安格洛苷C、没食子酸、酪醇、肉桂酸在相应质量浓度范围内呈良好线性关系,线性范围、回归方程、相关系数分别为没食子酸:Y=0.306 8 X+0.146 0,R2=0.999 4,线性范围11.410~114.100 μg/mL;酪醇:Y=0.053 9 X+0.035 4,R2=0.999 7,线性范围19.625~196.250 μg/mL;肉桂酸:Y=0.288 6 X+0.065 4,R2=0.999 8,线性范围6.895~68.950 μg/mL;红景天苷:Y=0.024 6 X-0.092 2,R2=0.999 6,线性范围78.995~789.95 μg/mL;哈巴俄苷:Y=0.432 2 X-0.684 7,R2=0.999 5,线性范围62.585~625.85 μg/mL;安格洛苷C:Y=0.097 1 X+0.132 6,R2=0.999 6,线性范围55.045~550.45 μg/mL。
2.7 精密度试验精密吸取“2.1”项下的混合对照品溶液,连续进样6次,按上述色谱条件测定峰面积,计算,求得大花红天素、哈巴苷、没食子酸、酪醇、肉桂酸、红景天苷、哈巴俄苷、安格洛苷C峰面积的RSD分别为0.39%、1.03%、0.37%、1.01%、0.86%、0.65%、0.58%、0.31%。
2.8 重复性试验取胶囊(批号140914)内容物,按照“2.2”项下方法制备6份供试品溶液,分别进样,测定峰面积,计算质量分数。结果大花红天素、哈巴苷、没食子酸、酪醇、肉桂酸、红景天苷、哈巴俄苷、安格洛苷C的平均质量分数的RSD分别为1.27%、0.97%、1.11%、0.57%、1.20%、1.56%、0.31%、0.23%。
2.9 稳定性试验取胶囊(批号140914)内容物,按照“2.2”项下方法制备供试品溶液,分别于2、4、8、12、16、24 h进样测定,记录峰面积。结果大花红天素、哈巴苷、没食子酸、酪醇、肉桂酸、红景天苷、哈巴俄苷、安格洛苷C峰面积的RSD分别为1.10%、1.84%、0.96%、1.91%、0.78%、1.33%、1.13%、1.85%。表明供试品溶液在24 h内稳定。
2.10 回收率试验取已测定的样品(批号140914,大花红天素、没食子酸、红景天苷、酪醇、哈巴苷、哈巴俄苷、安格洛苷C、肉桂酸分别为33.78、4.42、29.80、8.52、27.46、24.11、22.88、2.72 mg/粒)0.1 g,精密称定,置50 mL量瓶中,精密加入大花红天素对照品8.708 mg、红景天苷对照品7.827 mg、哈巴苷对照品7.212 mg、哈巴俄苷对照品6.332 mg、安格洛苷C对照品6.009 mg、没食子酸、肉桂酸、酪醇对照品溶液(1.162、0.714、2.238 mg/mL)各1 mL,采用“2.2”项下供试品溶液制备方法制备6份供试品溶液,进样测定,计算回收率。结果大花红天素、红景天苷、酪醇、没食子酸、哈巴苷、哈巴俄苷、安格洛苷C、肉桂酸的平均回收率分别为100.8%、100.1%、100.8%、98.9%、98.9%、99.6%、100.7%、99.2%,RSD分别为0.64%、0.35%、0.65%、0.56%、0.26%、0.58%、1.00%、0.64%。
2.11 样品测定分别取不同批号的复方红景天胶囊适量,按“2.2”项下方法制备供试品溶液,按“2.4”项下色谱条件测定,记录色谱图,计算8种成分质量分数。结果见表 1。
|
|
表 1 6批复方红景天胶囊样品中8种成分定量测定结果 (n = 3) Table 1 Detemination of six batches of samples in Compound Rhodiola Capsule (n = 3) |
复方红景天胶囊中大花红天素紫外无吸收,哈巴苷为末端吸收,故选用蒸发光散射检测器(ELSD)对2种成分进行分析。ELSD虽为通用型质量检测器,但灵敏度较紫外检测器低,同时测定该制剂中8种成分较困难,故选择紫外检测器对红景天苷、酪醇、没食子酸、哈巴俄苷、安格洛苷C及肉桂酸6种成分进行分析,所以本实验建立了UV检测器与ELSD串联同时测定复方红景天胶囊中8种成分[11, 12, 13]。
3.2 测定波长的选择分别取红景天苷、酪醇、没食子酸、哈巴俄苷、安格洛苷C及肉桂酸的甲醇溶液用PDA检测器在200~400 nm扫描,结果表明没食子酸、红景天苷、酪醇在275 nm处有最大吸收,哈巴俄苷、肉桂酸在280 nm处有最大吸收,安格洛苷C在275、330 nm处均有吸收,故选择275 nm波长下测定6种成分,各指标成分峰峰型良好,基线平稳,分离度高。
3.3 色谱条件的选择考察了0、0.1%、0.2%、0.3%、0.4%、0.5%冰醋酸体积分数对分离度的影响。结果不同醋酸体积分数对峰的保留时间影响较大,对峰型和分离度也有一定的影响,以0.3%冰醋酸体积分数为佳。
3.4 供试品制备方法考察以大花红天素、没食子酸、红景天苷、酪醇、哈巴苷、哈巴俄苷、安格洛苷C和肉桂酸的提取率为考察指标,考察了提取溶剂(甲醇及95%、70%乙醇)、提取方式(超声处理和回流提取)、提取溶剂用量(25、50、100 mL)、提取时间(15、30、45 min)的提取效果,结果表明采用甲醇50 mL超声处理30 min,提取收率最高。
| [1] | 伍小艳, 周军, 石伟, 等. 红景天玄参组合物对大鼠局灶性脑缺血再灌注损伤保护作用的研究[J]. 现代药物与临床, 2014, 29(4):353-358. |
| [2] | 王曙, 王锋鹏. 大花红景天化学成分的研究[J]. 药学学报, 1992, 27(2):117-120. |
| [3] | 刘青, 杜守颖, 多吉仁青, 等. HPLC法同时测定不同产地大花红景天中6种活性成分[J]. 中草药, 2015, 46(2):276-279. |
| [4] | 黄钰芳. 红景天活性成分及药理作用[J]. 中医药临床杂志, 2008, 20(5):528-530. |
| [5] | 张明发, 沈雅琴. 红景天苷抗痴呆药理作用研究进展[J]. 药物评价研究, 2015, 38(6):675-681. |
| [6] | 陈菲, 艾国, 盛柳青, 等. 浙贝母、天麻和红景天最细粉的稳定性研究[J]. 中草药, 2014, 45(23):3397-3401. |
| [7] | 郑明昱, 金哲悟, 朴红梅, 等. 红景天苷通过NF-κB/TGF-β1信号通路抑制哮喘小鼠气道重塑的实验研究[J]. 中草药, 2014, 45(17):2511-2516. |
| [8] | 钱睿哲, 张国平, 金惠铭, 等. 大花红天素对脑微血管内皮细胞凋亡的双相调节作用及机制[J]. 中国病理生理杂志, 2005, 21(11):2086-2090. |
| [9] | 张国平, 金惠铭, 王文健, 等. 大花红天素对大鼠肺微血管内皮细胞凋亡影响的实验研究[J]. 中国微循环, 2004, 8(5):272-273. |
| [10] | 胡瑛瑛, 黄真. 玄参的化学成分及药理作用研究进展[J]. 浙江中医药大学学报, 2008, 32(2):268-270. |
| [11] | 林夏, 胡军华, 崔培超, 等. HPLC同时测定大花红景天提取物中没食子酸、红景天苷、酪醇、对香豆酸的含量[J]. 中国实验方剂学杂志, 2013, 19(10):102-105. |
| [12] | 杨宪, 杨水平, 张雪, 等. HPLC-UV-ELSD同时测定玄参中5种成分的含量[J]. 中国中药杂志, 2009, 34(1):68-71. |
| [13] | 中国药典[S]. 一部. 2010. |
 2016, Vol. 47
2016, Vol. 47


