2. 咸阳职业技术学院医学院, 陕西 咸阳 712000
2. College of Medicine, Xianyang Vocational Technical College, Xianyang 712000, China
创伤性脑损伤(traumatic brain injury,TBI)是临床上常见的多发性疾病,尽管在脑损伤的诊治及相关基础研究方面取得了许多进展,但其致死率和致残率依然高居身体各部位损伤之首[1]。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是从茶叶的有效成分茶多酚中分离出的单体化合物,药理学研究表明[2, 3],EGCG对TBI具有保护作用。
血脑屏障(blood brain barrier,BBB)是在脑和脊髓内的毛细血管与神经组织之间存在的一个调节界面。由于BBB的存在,100%的大分子药物和98%的小分子药物不能透过BBB[4]。因此寻找克服BBB或促进药物透过BBB的方法成为增进脑部疾病治疗的关键。鼻黏膜在解剖生理上与脑部存在着独特的天然联系,部分药物经鼻腔给药后可以绕过BBB由嗅区吸收进入脑脊液,进入中枢神经系统,从而起到脑靶向作用,提高药物治疗效果。由于鼻腔黏膜带负电,因此带正电荷的药物或药物载体容易通过鼻黏膜吸收[5, 6, 7]。
壳聚糖(chitosan,CS)是甲壳素(chitin)脱乙酰基后的产物,是一种天然的带正电荷高分子聚合物,具有许多独特的物理化学特性、良好的生物相容性和生物降解性,已成为药物传递系统研究的热点和重点[8, 9, 10, 11, 12]。为了使EGCG透过BBB发挥药效,本研究以CS作为载体材料,采用离子凝胶化法[13]制备EGCG-CS纳米粒(EGCG-CS-NPs),并以粒径分布和包封率为评价指标,利用Box-Behnken设计-效应面法(BBD-RSM)优化EGCG-CS-NPs处方。通过对处方的优化,制备得到均匀圆整、释药缓慢的EGCG-CS-NPs,为进一步考察EGCG-CS- NPs在体内药动学行为奠定了基础。
1 仪器与材料1200型高效液相色谱系统,美国安捷伦科技公司;DF-101S集热式恒温加热磁力搅拌器,巩义市英峪予华仪器厂;RC-806溶出试验仪,天津天大天发科技有限公司;BP200型电子天平,德国赛多利斯集团公司;JEM-1200EX型透射电子显微镜,日本JEOL公司;ZetaSizer 2000HS激光粒度测定仪,英国Malvern公司;TGL-16G型台式离心机,上海安亭科学仪器厂;10K超滤离心管,美国Milipore公司;透析袋,截留相对分子质量(MW)14 000,斯百全化学上海有限公司。
CS,脱乙酰度为95%,MW:120 000~140 000、67 000~72 000、22 000~26 000,浙江玉环海洋生物化学有限公司;EGCG对照品,上海友思生物技术有限公司,批号130414,质量分数>99.5%;三聚磷酸钠(TPP),Sigma试剂公司;EGCG原料药,Sigma试剂公司,批号639218,质量分数>98.5%;冰醋酸,天津市博迪化工有限公司。
2 方法与结果 2.1 EGCG-CS-NPs及空白CS-NPs的制备采用离子凝胶化法[13]制备EGCG-CS-NPs。取处方量的CS加入到20 mL醋酸溶液(pH 4.5)中,室温条件下搅拌溶解;称取处方量的EGCG加入到上述溶液中,室温条件下搅拌溶解;在高速(3 500 r/min)磁力搅拌下,以一定的滴定速度,用注射器缓慢加入处方量的TPP溶液(1 g/L),室温条件下搅拌60 min,将EGCG-CS-NPs溶液用0.22 μm微孔滤膜滤过,即得。
空白CS-NPs制备参照EGCG-CS-NPs的制备方法,即:取处方量的CS加入到20 mL醋酸溶液(pH 4.5)中,室温条件下搅拌溶解,在高速(3 500 r/min)磁力搅拌下,以一定的滴定速度,用注射器缓慢加入处方量的TPP溶液(1 g/L),室温条件下搅拌60 min,将空白CS-NPs溶液用0.22 μm微孔滤膜滤过,即得。
2.2 EGCG-CS-NPs中EGCG的HPLC测定 2.2.1 色谱条件[14]色谱柱为Agilent Zorbax SB- C18柱(250 mm×4.6 mm,5 μm);流动相为1.0%醋酸水溶液-乙腈(13∶87),pH调为3.5;体积流量1.0 mL/min;检测波长280 nm;柱温25 ℃;进样量20 μL。
2.2.2 线性关系及方法学考察称取EGCG对照品10.0 mg,置50 mL量瓶中,加入流动相超声溶解,放冷至室温,作对照品贮备液(EGCG 200 μg/mL)。精密量取对照品贮备液0.5、1.0、2.0、5.0、10.0 mL,置于25 mL量瓶中,以流动相稀释成4.0、8.0、20.0、40.0、80 μg/mL的对照品溶液,摇匀,微孔滤膜滤过,精密吸取20 μL,按“2.2.1”项色谱条件测定。以EGCG质量浓度(C)对峰面积(A)作线性回归,得回归方程为A=18 165 C-8 454,r=0.999 9。由结果可知,EGCG在4.0~80.0 μg/mL药物质量浓度与峰面积线性关系良好。方法学考察表明,在本色谱条件下辅料对EGCG的测定无干扰,日内、日间精密度分别为RSD 1.83%(n=6)、1.51%(n=6),低、中、高(8.0、20.0、40.0 μg/mL)3个质量浓度的平均回收率为98.4%,RSD 1.88%(n=9)。
2.3 包封率测定取1.0 mL EGCG-CS-NPs溶液置于超滤离心管(截留MW 10 000)上端,5 000 r/min离心10 min,收集所有滤液至10 mL量瓶中,加入流动相,定容得溶液A;另取1.0 mL EGCG-CS-NPs溶液,加入1%的醋酸溶液,超声破坏10 min,定容得溶液B。分别取溶液A及溶液B的续滤液(过微孔滤膜),按照“2.2.1”项下色谱条件分别测得EGCG-CS-NPs溶液中未被包封的EGCG质量(W游离)和EGCG-CS- NPs溶液中EGCG的总质量(W总),计算包封率(包封率=1-W游离/W总)。
2.4 EGCG-CS-NPs处方单因素考察离子凝胶化法制备CS-NPs的原理为CS分子中带正电的氨基与TPP分子中带负电的磷酸基之间的静电作用,二者质量浓度不同会对NPs的形成有较大影响。因此需要考察不同质量浓度下CS、TPP和EGCG交联形成NPs的情况,据此得出较佳的质量浓度范围。
2.4.1 CS MW对NPs制备的影响CS作为药物载体具有生物相容性好、体内易降解和毒性低等特点,在新型给药系统中得到广泛应用。根据预试验结果发现CS MW对CS-NPs的制备成型性有较大影响,因此,本研究首先应确定CS的MW范围,分别选择120 000~140 000、67 000~72 000、22 000~26 000 3个MW范围的CS,按照“2.1”项下方法制备空白CS-NPs,考察不同MW的CS对NPs成型性的影响,结果见表 1。结果表明,TPP质量浓度在0.5~5.0 g/L,MW为22 000~26 000的CS质量浓度在1.0~2.5 g/L可以形成NPs;高MW的CS在上述质量浓度范围内形成的NPs区域较为狭窄,因此,本研究确定采用MW为22 000~26 000的CS作为制备EGCG-CS-NPs的载体。
|
|
表 1 CS MW筛选 Table 1 Screening of CS MW |
在预试验的基础上初步得到EGCG-CS-NPs处方的比例范围。固定处方中EGCG质量浓度为2.0 g/L,TPP质量浓度为1.0 g/L,按照“2.1”项下方法制备CS(MW 22 000~26 000)质量浓度分别为0.25、0.50、1.00、2.50、5.00、7.50 g/L的EGCG-CS-NPs。以CS-NPs的平均粒径、多分散指数(PDI)、Zeta电位、包封率为评价指标,筛选出合适的CS质量浓度,结果见表 2。结果表明,在固定EGCG和TPP质量浓度条件下,CS质量浓度对NPs的平均粒径和包封率有很大的影响。CS质量浓度在较低的条件下,相对过量的TPP可引发CS团聚成较大的颗粒而沉淀下来;随着CS质量浓度的增加,质量浓度在1.0~5.0 g/L,NPs的形成越来越容易,逐渐出现乳光,且随着CS质量浓度的增加平均粒径增大;但CS质量浓度增加到一定程度时,溶液中TPP量不足,难以与CS交联成NPs,为澄清状态。综合考虑选取CS质量浓度在1.0~5.0 g/L作进一步研究。
|
|
表 2 CS质量浓度筛选 Table 2 Screening of CS concentration |
固定处方中EGCG质量浓度为2.0 g/L,CS质量浓度为2.5 g/L,TPP质量浓度分别选择0.5、1.0、2.0、3.0、4.0、5.0 g/L作为离子交联剂,按照“2.1”项下方法制备EGCG-CS-NPs。以CS-NPs的平均粒径、PDI、Zeta电位、包封率为评价指标,筛选出合适的TPP质量浓度,结果见表 3。结果表明,在固定CS和EGCG质量浓度条件下,TPP质量浓度对NPs的平均粒径和包封率有很大的影响。TPP在质量浓度较低的条件下,CS相对过量,形成的NPs粒径较小,药物包封率也较低;TPP在质量浓度较高时,形成的NPs粒径较大。综合考虑选取TPP质量浓度在1.0~4.0 g/L作进一步研究。
|
|
表 3 TPP质量浓度筛选 Table 3 Screening of TPP concentration |
固定处方中CS质量浓度为2.5 g/L,TPP质量浓度为1.0 g/L,分别以EGCG质量浓度为1.0、2.0、4.0、6.0 g/L投药,按照“2.1”项下方法制备EGCG-CS- NPs。以CS-NPs的平均粒径、包封率为评价指标,考察EGCG质量浓度对NPs性质的影响,结果见表 4。结果表明,在固定CS和TPP质量浓度条件下,EGCG质量浓度变化对NPs的平均粒径影响不大,但对包封率有很大的影响。随着EGCG质量浓度的增加,CS-NPs的包封率呈下降趋势,这是由于EGCG为水溶性药物,当EGCG质量浓度增加时,CS-NPs不能对其有效地吸附和包裹,EGCG以游离状态的数量增加所致。综合考虑选取EGCG质量浓度在1.0~4.0 g/L作进一步研究。
|
|
表 4 EGCG质量浓度筛选 Table 4 Screening of EGCG concentration |
单因素考察结果表明,采用离子凝胶化法制备EGCG-CS-NPs的过程中,CS、TPP和EGCG质量浓度对EGCG-CS-NPs的性质都有显著影响。因此,采用CS质量浓度在1.0~5.0 g/L,TPP质量浓度在1.0~4.0 g/L,EGCG质量浓度在1.0~4.0 g/L,应用Box-Behnken效应面法进一步优化处方。
2.5 BBD-RSM优化EGCG-CS-NPs处方 2.5.1 试验设计及结果通过处方单因素考察,选取对EGCG-CS-NPs性质影响较显著的3个因素:CS质量浓度(X1)、TPP质量浓度(X2)、EGCG质量浓度(X3)为考察对象,以包封率(Y1,%)、平均粒径(Y2,nm)为评价指标,利用BBD-RSM优化EGCG-CS-NPs处方。因素水平见表 5,处方优化试验安排及结果见表 5。
|
|
表 5 BBD-RSM试验设计与结果 Table 5 Design and results of BBD-RSM test |
采用Design expert 7.0实验设计软件,对EGCG-CS-NPs处方优化所得数据进行处理,以评价指标(因变量)分别对各因素(自变量)进行多元二项式方程拟合。对二项式方程中的各项系数进行F检验,所得结果见表 6、7。
|
|
表 6 Y1的多元二项式方程中的各项系数 Table 6 Each regression coefficient of polynomial functions of Y1 |
|
|
表 7 Y2的多元二项式方程中的各项系数 Table 7 Each regression coefficient of polynomial functions of Y2 |
由表 6中数据结果可知R2=0.970 1(P<0.05),说明Y1采用多元二项式方程拟合是适合的。方程中X1、X2、X3、X1X2、X12对Y1影响较显著。在EGCG质量浓度固定时,Y1随着CS质量浓度的增加而增大,随着TPP质量浓度的增加而减小(图 1-A);在TPP质量浓度固定时,Y1随着CS质量浓度的增加而增大,随着EGCG质量浓度的增加而减小(图 1-B);在CS质量浓度固定时,Y1随着TPP和EGCG质量浓度的增加而降低(图 1-C)。
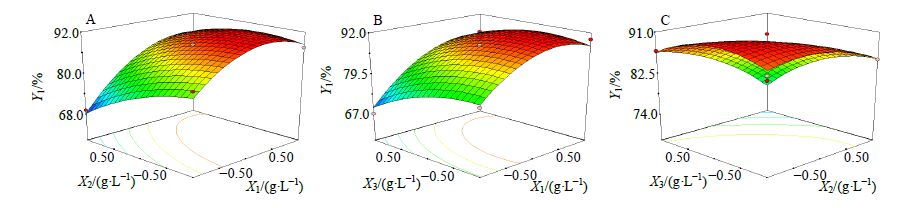
|
图 1 自变量X1、X2、X3与因变量Y1的3D效应面图 Fig. 1 Response surface plots (3D) of effects of X1,X2,and X3 on Y1 |
由表 7中数据结果可知R2=0.989 9(P<0.05),说明Y2结果采用多元二项式方程拟合是适合的。方程中X1、X2、X1X2、X12、X32对Y2影响较显著(P<0.05、0.01)。在EGCG质量浓度固定时,Y2随着CS质量浓度的增加而增大,随着TPP质量浓度的增加而增大(图 2-A);在TPP质量浓度固定时,Y2随着CS质量浓度的增加而增大,随着EGCG质量浓度的增加先降低后增大(图 2-B);在CS质量浓度固定时,Y2随着TPP质量浓度的增加而减小,随着EGCG质量浓度的增加先降低后增大(图 2-C)。
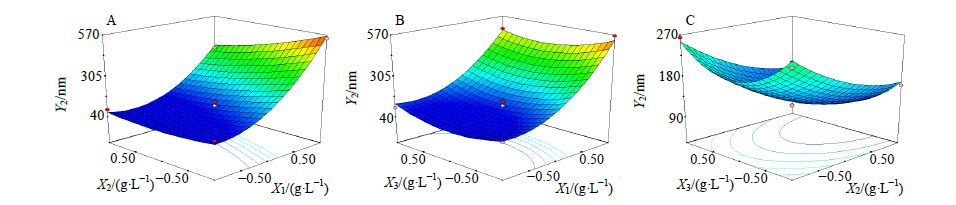
|
图 2 自变量X1、X2、X3与因变量Y2的3D效应面图 Fig. 2 Response surface plots (3D) of effects of X1,X2 and X3 on Y2 |
根据Design expert 7.0实验设计软件得EGCG-CS-NPs最优处方:CS质量浓度为2.6 g/L、TPP质量浓度为1.5 g/L、EGCG质量浓度为2.7 g/L。以优化的最优处方按照“2.1”项下方法制备3批EGCG-CS-NPs,按照“2.3”和“2.6”项下方法测定EGCG-CS-NPs Y1和Y2,实验观察值与模型预测值见表 8,可知,实验观察值和模型预测值比较接近,说明模型预测性良好。
|
|
表 8 EGCG-CS-NPs各指标预测值和观察值 Table 8 Predicted and observed response values for each indicator |
取EGCG-CS-NPs溶液适量,用蒸馏水稀释适量倍数,采用ZetaSizer 3000HS激光粒度测定仪测定EGCG-CS-NPs的粒径分布和Zeta电位,结果见图 3。EGCG-CS-NPs的平均粒径为(102.2±27.1)nm,PDI为0.193±0.019,Zeta电位为(25.5±4.1)mV。
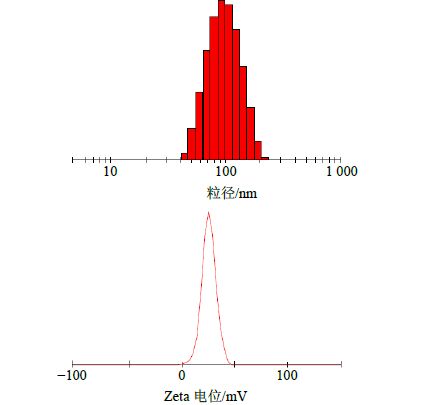
|
图 3 EGCG-CS-NPs粒径分布和Zeta电位 Fig. 3 Particle size distribution and Zeta potential of EGCG-CS-NPs |
取适量EGCG-CS-NPs滴在喷碳铜网表面,使液体尽量铺满整个铜网,加入重蒸馏水稀释适当倍数,保持15 min,用滤纸吸除大部分水分,滴加2.0%的磷钨酸水溶液,染色5 min,用滤纸吸去水分,将铜网取出,待干后用透射电镜观察EGCG-CS-NPs的形态结构。由图 4可见,EGCG-CS-NPs呈球形。

|
图 4 EGCG-CS-NPs透射电镜图 Fig. 4 TEM photogram of EGCG-CS-NPs |
采用透析法考察EGCG-CS-NPs在体外PBS(pH 4.5)中的释放行为。精密吸取2.0 mL EGCG- CS-NPs 3份,分别置于处理好的透析袋(截留MW 14 000)内,扎紧后置于溶出仪的桨叶底部。分别移取100 mL释放介质放入250 mL溶出杯中。恒温(32.0±0.5)℃,转速50 r/min,分别于0.25、0.5、0.75、l、2、4、6、8、12、16、24 h吸取1 mL释放介质(同时补加等量、同温的释放介质)。取出的释放介质用0.22 μm微孔滤膜滤过,按照“2.2.1”项下色谱条件测定EGCG的量。另取2 mL EGCG溶液置于透析袋内,同上进行释放试验,计算EGCG的累积释放率,结果见图 5。体外释放研究结果表明,EGCG溶液在1.0 h内基本释放完全;而EGCG-CS-NPs在释放初期有药物突释现象,这是可能由于EGCG-CS-NPs中的游离药物以及吸附在NPs表面的药物释放所致,随后药物释放较为缓慢,24 h累积释放率为(90.4±4.6)%,表明EGCG- CS-NPs有延缓药物释放的作用。
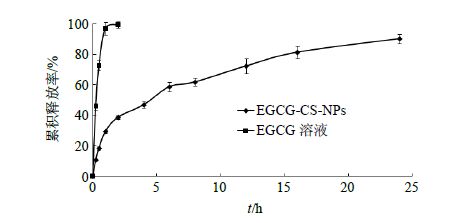
|
图 5 EGCG-CS-NPs与EGCG溶液体外释放曲线 Fig. 5 Release profile in vitro of EGCG-CS-NPs and EGCG solution |
鼻腔黏膜按照功能分为呼吸区和嗅觉区,其中嗅觉区仅仅占总面积的5%,但是嗅觉区却提供了从鼻腔入脑的一个直接通路[14]。由于鼻腔黏膜带负电,因此带正电荷的药物或药物载体容易通过鼻黏膜吸收。EGCG-CS-NPs表面带正电荷,因此能与鼻黏膜上皮细胞形成共价键结合,抵抗黏膜纤毛对药物的清除,保证药物的跨细胞膜传递;同时,CS能可逆性的、暂时性打开上皮细胞之间的紧密连接,增强黏膜对药物的吸收作用[15],从而实现药物的脑靶向性。
CS-NPs的制备方法有:复凝聚法[16]、共价交联法[17]、离子凝胶化法[13]、乳滴聚结法[18]等。离子凝胶化法是目前文献报道较多的制备载药CS-NPs的方法,其原理是利用CS分子中带正电的氨基与生物相容性较好的TPP分子中带负电的磷酸基之间的静电作用,并在外力作用下形成NPs。在磁力搅拌条件下,将TPP溶液缓慢滴加到pH值4~6的CS溶液中,通过磷酸根负离子与CS分子链上带正电的质子化氨基发生分子内和分子间交联凝胶化,便可迅速生成NPs。由于该实验条件温和,操作方便,不使用有机溶剂,因此在CS-NPs的制备中得到广泛的应用。
| [1] | 王忠诚. 神经外科学[M]. 武汉:湖北科学技术出版社, 2005. |
| [2] | Itoh T, Tabuchi M, Mizuguchi N, et al. Neuroprotective effect of(-)-epigallocatechin-3-gallate in rats when administered pre-or post-traumatic brain injury[J]. J Neural Transm, 2013, 120(5):767-783. |
| [3] | 王苗苗, 韩杰, 娄海燕. 表没食子儿茶素没食子酸酯对心脑血管缺血再灌注损伤保护作用机制的研究进展[J]. 中草药, 2014, 45(18):2732-2736. |
| [4] | Pardridge W M. Brain Drug Targeting[M]. Cambridge:Cambridge University Press, 1998. |
| [5] | Baltzley S, Mohammad A, Malkawi A H, et al. Intranasal drug delivery of olanzapine-loaded chitosan nanoparticles[J]. AAPS Pharm Sci Tech, 2014, 15(6):1598-1602. |
| [6] | Jafarieh O, Md S, Ali M, et al. Design, characterization, and evaluation of intranasal delivery of ropinirole-loaded mucoadhesive nanoparticles for brain targeting[J]. Drug Dev Ind Pharm, 2015, 41(10):1674-1681. |
| [7] | 卢浩扬, 林媛媛, 车俊秀, 等. 星点设计-效应面法优化芷芎散温敏凝胶的处方及其鼻黏膜渗透特性研究[J]. 中草药, 2014, 45(13):1845-1849. |
| [8] | 宋燕青, 张四喜, 尹一子, 等. 胰岛素纳米粒温敏凝胶的制备及体外释药性能[J]. 中国医院药学杂志, 2011, 31(2):116-120. |
| [9] | 张洪, 沈瑶, 闫士君, 等. 青蒿琥酯-壳聚糖纳米粒的制备及质量评价[J]. 中国医院药学杂志, 2013, 33(5):349-355. |
| [10] | 李纳, 汤丹丹, 王丽雯, 等. 喷雾干燥法制备姜黄素磷脂复合物壳聚糖微球干粉吸入剂及其表征[J]. 中草药, 2014, 45(17):2475-2481. |
| [11] | 张亚会, 李喜香, 包强, 等. 甘草次酸-壳聚糖纳米粒的制备及其质量评价[J]. 中草药, 2015, 46(15):2232-2237. |
| [12] | 周闻舞, 顾海铮. 壳聚糖微/纳米粒在定向给药系统中的应用研究[J]. 药物评价研究, 2010, 33(4):290-295. |
| [13] | Fazil M, Md S, Haque S, et al. Development and evaluation of rivastigmine loaded chitosan nanoparticles for brain targeting[J]. Eur J Pharm Sci, 2012, 47(1):6-15. |
| [14] | Illum L. Transport of drugs from the nasal cavity to the central nervous system[J]. Eur J Pharm Sci, 2000, 11(1):1-18. |
| [15] | Artursson P, Lindmark T, Davis S S, et al. Effect of chitosan on the permeability of monolayers of intestinal epithelial cells(Caco-2)[J]. Pharm Res, 1994, 11(9):1358-1361. |
| [16] | Fangueiro J F, Parra A, Silva A M, et al. Validation of a high performance liquid chromatography method for the stabilization of epigallocatechin gallate[J]. Int J Pharm, 2014, 475(1/2):181-190. |
| [17] | Hu Y, Jiang X Q, Ding Y, et al. Synthesis and characterization of chitosan-poly(acrylic acid) nanoparticles[J]. Biomaterials, 2002, 23(15):3193-3201. |
| [18] | Futoshi S, Hiroyuki T, Hideki I, et al. In vitro cellular accumulation of gadolinium incorporated into chitosan nanoparticles designed for neutron-capture therapy of cancer[J]. Eur J Pharm Biopharn, 2002, 53(1):57-63. |
 2016, Vol. 47
2016, Vol. 47

