二氢杨梅素(dihydromyricetin,DMY),又名蛇葡萄素,是蛇葡萄属Ampelopsis Michx植物显齿蛇葡萄Ampelopsis grossedentata (Hand. -Mazz.) W. T. Wang中的主要活性成分。DMY药理活性广泛,安全性好,极具开发价值[1]。但由于本身稳定性差、溶解度低和吸收代谢快等缺陷使其生物利用度低,成药性较差,限制了其临床应用。为了改善DMY的上述问题,近年来通过采用各种制剂新技术与新剂型提高DMY稳定性、溶解性和生物利用度的研究成为了热点。本文对DMY的各种制剂新技术和新剂型的研究进展进行综述,旨在为DMY进一步的研究提供有价值的参考。
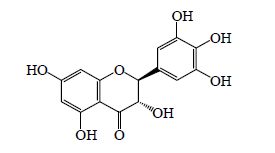
1 DMY理化性质与药动学DMY化学名称为3,5,7-三羟基-2-(3,4,5-三羟基苯基) 苯并二氢吡喃-4-酮,分子式为C15H12O8,相对分子质量为320.25,白色针状结晶,熔点为245~246 ℃,属于二氢黄酮醇类化合物,其结构见图 1。DMY成药性较差,可能原因在于:1)分子稳定性较差。DMY含有6个酚羟基,易被Fe3+、Al3+、Cu2+等金属离子、氧气以及光线氧化,化学性质不稳定,在低温弱酸性环境中较能稳定存在,随着pH值的增加,温度的升高会加速其氧化进程[2]。2)水溶性和脂溶性均较差。25 ℃时,DMY在水中溶解度为0.2 mg/mL,在正辛醇-水(pH 5.0)中的油水分配系数仅为0.45。3)生物利用度低。由于研究资料缺乏,目前未见DMY的体内生物利用度报道,仅有相关文献提到DMY在大鼠体内肠黏膜渗透率为9.3×10−6 cm/s,在人胃肠道内肠黏膜渗透率可能将低于10%,体内生物利用度低[3, 4]。以SD大鼠为研究对象,ig给予DMY 100 mg/kg,药动学结果显示DMY达峰时间为32.2 min,吸收相半衰期为13.2 min,消除相半衰期为17.9 min,表明DMY在体内半衰期短,吸收、代谢迅速[5]。
|
图 1 DMY的结构 Fig. 1 Structure of DMY |
近年来,利用现代药剂学新技术将DMY制成脂质体、微乳、微囊、固体分散体、包合物、纳米胶束等,以期达到改善DMY溶解性,提高其稳定性和生物利用度的目的。
2.1 脂质体(liposome)脂质体是由单层或多层类脂质双分子层组成,内部为水相的封闭球形囊泡。脂质体对包裹的药物具有保护作用,能增加药物的稳定性,提高药物生物利用度及靶向性,同时兼具包裹水溶性、脂溶性和两亲性药物的特点。
考虑到DMY在水中的稳定性较差,影响其进一步开发利用,齐娜等[4]采用薄膜超声法制备了DMY脂质体。最佳处方条件下制备的脂质体呈球形或近球形小囊泡,平均粒径200 nm左右,包封率为58.1%,DMY的量为1.02 mg/mL。DMY制备成脂质体能显著增加其在溶液中的稳定性,并具有一定的缓释作用。4 ℃下避光放置30 d,DMY脂质体中药物量为加入量的96.57%,而同样条件下DMY溶液剂中药物量仅为加入量的64.71%。以磷酸盐缓冲液(pH 5.8)-乙醇(80∶20)作溶出介质,DMY脂质体48 h累积释放率为76.29%。
为了进一步提高DMY脂质体的稳定性,何志峰等[6]研究了DMY脂质体冻干粉的制备工艺。优化工艺条件后,制备的脂质体呈粒径相近、分布均匀的椭圆形微球,脂质体混悬液中DMY的量为(16.69±0.06)mg/mL,包封率为62.3%。考察DMY脂质体及其冻干粉在25 ℃下第50 d的包封率,结果显示脂质体混悬液包封率下降了19.9%,而脂质体冻干粉包封率仅下降了1.2%,表明在常温下,与脂质体混悬液相比,脂质体冻干粉更加稳定,适合制备成注射剂。
复方脂质体将2种或2种以上的药物包封于磷脂双分子层中,可起到改善药物性质、协同治疗、降低毒性、提高疗效的作用。赵莉莎等[7]研究了5-氟尿嘧啶-DMY(DMY-5-Fu)复方脂质体的制备工艺,从薄膜超声法、逆向蒸发法和乙醇注入超声法中优选出薄膜超声法制备复方脂质体。采用葡聚糖凝胶(Sephadex G-100)色谱柱分离脂质体和游离药物,紫外分光光度法测定复方脂质体中DMY和5-氟尿嘧啶(5-Fu)的量,计算两者的包封率分别为(75.47±0.91)%和(44.79±1.55)%,载药总量为(6.02±0.51)%。以磷酸盐缓冲液(pH 7.4)作为溶出介质,体外溶出实验表明,与DMY-5-Fu物理混合液相比,DMY-5-Fu脂质体具有明显的缓释作用,持续释放时间达到120 h,有效地延长了药物在体内的作用时间。
脂质体可对包裹于其中的DMY提供保护,避免外界因素将其破坏,增加DMY的稳定性,使DMY在体内缓慢释放,延长其作用时间。另外,将脂质体作为抗癌药DMY的载体,可能将增加其肝、脾靶向性和淋巴定向性,使DMY作用于病变部位或靶细胞,减少药物毒副作用,提高DMY解酒护肝、治疗肝癌的作用[8, 9, 10]。
2.2 微乳(microemulsion)微乳是由油相、水相、表面活性剂和助表面活性剂组成的一种热力学性质稳定、外观透明、各相同性的胶体分散体系。微乳作为一种新的药物转运系统,具有增加药物的溶解性,改善吸收,保护药物避免外界环境的破坏等优点[11, 12]。微乳与其他的载药系统相比,最突出的特点是对药物的增溶作用。DMY水溶性和脂溶性均较差,将其制备成微乳将大大改善其溶解特性。
为了增加DMY在水中或油中的溶解度,可将其制备成O/W或W/O型微乳[13, 14]。Solanki等[13]以辛葵酸单甘油酯和双甘油酯的混合物(capmul MCM)为油相,聚氧乙基代蓖麻油(cremophor EL)为表面活性剂,二乙二醇单乙基醚(transcutol P)为助表面活性剂,采用滴定法制备的O/W型微乳。25 ℃时,DMY在水中的溶解度由0.2 mg/mL增加到175.2 mg/mL,极大地改善了DMY在水中的溶解度。在磷酸盐缓冲液(pH 6.8)中,体外释放实验显示,与普通制剂相比,DMY微乳具有更快的体外释放速度。将DMY制备成O/W微乳后,微乳中的药物分布在油相和油水界面上,避免了与水的接触,有效增加了DMY的稳定性。由于微乳的隔水作用,若将微乳进一步制备成口服和注射剂型,也可避免药物与胃液、肠液和体液的直接接触,减少药物降解和被破坏,降低局部及血管的刺激性,提高药物的生物利用度。
自乳化系统(SEDDS)是由油相、表面活性剂和助表面活性剂组成的透明液体,可作为疏水性、难溶性和易水解药物的载体,其基本特征是可在胃肠道内或环境温度适宜(通常指体温37 ℃)及温和搅拌情况下,自发乳化形成O/W型乳剂。齐娜等[15]制备的DMY自乳化制剂呈澄清透明的淡黄色液体,平均粒径2.58 μm,DMY量为9.51 mg/mL,相比于DMY在水和油酸中的溶解度,分别提高了约130倍和3.56倍。DMY自乳化制剂和相同浓度的DMY乙醇溶液在常温避光条件下放置30 d,乙醇溶液中DMY量降低了 55.8%,自乳化制剂中DMY的量仅降低了0.4%,且平均粒径无明显变化,表明DMY在自乳化介质中稳定性良好。将9.5 mg/mL DMY自乳化制剂制备成软胶囊,每粒含DMY 9.5 mg,按同法取相同量的DMY装入软胶囊中作为对照,在人工胃液中DMY SEDDS软胶囊溶出速度较快,60 min药物累计溶出达90%,溶出速度及溶出百分率均明显高于DMY软胶囊。因此,将DMY制备成自乳化制剂有利于提高其稳定性,显著增加DMY的溶解度和释放度,SEDDS在胃肠液的作用下自发形成O/W型小乳滴,不仅增加药物吸收的表面积,而且可促进DMY通过淋巴系统吸收,从而增加DMY的生物利用度。
2.3 微囊(microcapsule)微囊是利用天然或合成的高分子材料作为囊壳,将固态或液态药物包裹在直径为1~250 μm囊壳内而成。选择不同囊材制备的微囊具有不同的特性,药物微囊化后,对于药物的一些理化性质具有改良作用,如增加药物的溶解性、提高药物的稳定性和生物利用度[16]。将DMY微囊化,能够增加DMY的稳定性,延缓或控制药物的释放,减少胃肠道刺激,提高其靶向性,对提高DMY生物利用度具有重要意义。
制备微囊的方法较多,目前已报道的制备DMY微囊的方法有3种,分别是单凝聚法、溶剂挥发法和喷雾干燥法。叶勇等[17]以明胶为囊材,单凝聚法制备DMY微囊,选择Na2SO4作为凝聚剂可降低金属离子对DMY稳定性的影响,制备的微囊包封率为66.1%。黄继红等[18]以阿拉伯胶和麦芽糊精为囊材,喷雾干燥法制备DMY微囊,包封率为95%。刘德育等[19]以乙基纤维素(EC)为囊材,二氯甲烷为溶剂,适当配比的聚乙烯醇(PVA)和十二烷基硫酸钠(SDS)水溶液为分散介质,溶剂挥发法制备DMY微囊。优化工艺后,制备的微囊包封率为86.7%,表面光滑圆整,分散状态良好,平均粒径为105 μm。DMY微囊在人工胃液中12 h累积溶出度为58.97%,表明其具有一定的缓释作用。DMY微囊化,有利于保护和包裹药物,增加药物的稳定性,延长药物在体内的作用时间。
2.4 固体分散体(solid dispersion)固体分散体是将药物高度分散在适宜的载体材料中形成的固态物质。制备固体分散体的意义在于将难溶性的药物高度分散,从而提高药物的溶解能力。将DMY制备成固体分散体可以提高其溶解度和溶出速度,增加DMY的稳定性,有利于提高药物的口服吸收和生物利用度。
Ruan等[3]利用2种常见的水溶性载体材料聚乙二醇6000(PEG 6000)和聚维酮K30(PVP K30)将DMY制备成固体分散体。对比了2种材料在25 ℃和37 ℃时对DMY的增溶作用,结果显示,以PEG 6000和PVP K30制备的DMY固体分散体溶解度均得到了提高,并且随着载体材料量的增加,溶解度增大,呈一定的线性关系(r2>0.9),PVP K30增溶效果大于PEG 6000。以水为溶出介质,2种载体材料制备的固体分散体和相应的药物-载体混合物体外溶出度均增加,且固体分散体溶出速度更快。因此,将DMY制备成固体分散体增加了其溶解度、溶出度和溶出速率,进而提高了生物利用度。
固体分散体能够增加DMY稳定性,提高其溶解度、溶出度和溶出速度,是因为DMY高度分散在载体材料中可有效防止DMY聚集,DMY与载体分子之间由于氢键、络合等作用,使其晶核的形成和生长受到抑制,DMY以分子或无定形态存在于载体材料中,有利于药物的释放;另一方面,PVP类或PEG类载体材料对DMY具有一定的增溶能力和润湿性。在溶出过程中,首先载体材料迅速溶解形成载体材料溶液,随后对药物产生增溶作用,促进药物与水的接触、润湿,使药物快速溶出[20]。
2.5 包合物(inclusion compound)包合物则是将药物全部或部分包合于另一种分子的空穴结构内形成的复合物。药物分子借范德华力形成包合物后,溶解度增大,稳定性提高,可调节释放速率,提高药物的生物利用度。Ruan等[3]利用β-环糊精(β-CD)和羟丙基-β-环糊精(HP-β-CD)研制了DMY包合物。β-CD形成的包合物在25 ℃和37 ℃时溶解度为2.8和9.6 mg/mL,分别增加了14倍和11倍,HP-β-CD对DMY的增溶作用与β-CD基本一致。白秀秀等[21]考察了不同温度下不同摩尔浓度的HP-β-CD对DMY的增溶作用,在制剂学容许的HP-β-CD用量范围内,于常温(25~35 ℃)下,溶解度即可达到原来的10~30倍。2种包合材料大大增加了 DMY水溶性,且增溶作用大于PVP K30和PEG 6000。以水为溶出介质,5 min时,DMY-HP-β-CD包合物和DMY-β-CD包合物的累积溶出度为92.6%和94.4%,DMY与HP-β-CD混合物和DMY与β-CD混合物的累积溶出度为58.8%和59.1%,DMY粉末溶出度为50.4%,表明包合材料对DMY具有一定的增溶作用,经包合之后,能显著增加DMY的溶出速度。
将DMY制备成包合物后,其抗氧化能力也随之增加。分别将未被包合的DMY与包合后的DMY溶液在40 ℃下用0.1 mol/L KClO3氧化6 h,DMY浓度分别减少了25.12%和15.28%;在60 ℃下用0.1 mol/L KClO3氧化6 h,DMY浓度分别减少了26.58%和22.79%。不同温度下,包合物溶液中DMY减少量均小于未包合溶液。氧化反应动力学实验表明,DMY及其包合物的氧化反应属于一级反应,未被包合的DMY溶液的氧化反应速率常数大于包合后的DMY溶液,DMY被氧化的速率较其包合物快。DMY经过CD包合之后,其稳定性有了一定的增加[22]。
DMY形成包合物的过程是药物分子借助分子间力进入包合材料分子空穴的物理过程,不发生化学反应,通常与包合材料形成1∶1的分子络合物。包合物增加了DMY水溶性和稳定性,使药物快速溶出,提高了其生物利用度。
2.6 纳米胶束(nanomicelle)纳米胶束是当聚合物载体的浓度超过临界胶束(CMC)浓度后自发形成的热力学稳定体系,对难溶性药物具有良好的增溶作用。胶束的疏水性内核将药物包裹其中,而亲水性外壳可避免载药系统在网状内皮系统(RES)中被非特异性吞噬,延长药物在体内循环时间,有利于提高药物生物利用度。为了克服DMY水溶性较差,体内生物半衰期短的缺点,黄仁杰等[23]采用薄膜分散法制备了DMY纳米胶束。实验结果显示,DMY纳米胶束平均包封率为80.4%,平均粒径为(25.6±0.5)nm。DMY在纳米胶束中的质量浓度约为3.2 mg/mL,相比于其在纯水中的溶解度0.2 mg/mL,增加了16倍。将DMY制备成纳米胶束,增加了其水溶性和稳定性,延长了其在体内的作用时间,进而能够提高DMY的生物利用度。
3 新剂型胃内漂浮型制剂依据流体动力学平衡原理设计,服用后可在胃内环境的作用下体积膨胀,使其密度小于胃内容物的密度而在胃液中呈漂浮状态,从而延长药物在胃内的滞留时间,增强部分药物的稳定性[24]。由于DMY在弱酸性环境中能稳定存在,并且在体内半衰期短,吸收代谢快,将其制成胃漂浮型制剂有利于提高其稳定性,延缓和控制DMY的释放,增加其在胃肠道的吸收,提高其生物利用度。黄仁杰[25]以乙基纤维素(EC)为载体材料,采用乳化-溶剂扩散法制备DMY胃漂浮小球。最佳处方和工艺参数条件下制得的胃漂浮小球平均粒径为883 μm,跨距为0.63,包封率为57.78%,小球制得率为68.84%。体外漂浮实验结果显示,小球在含0.02%聚山梨酯80的人工胃液中,24 h内漂浮率达100%,3 d内漂浮率>95%。王金玲等[26]以羟丙基纤维素K4M(HPMC K4M)为亲水凝胶骨架材料,聚乙烯吡咯烷酮K30(PVP K30)为膨胀剂,碳酸氢钠为起漂剂,乳糖为填充剂,采用粉末直接压片法研制DMY胃内漂浮缓释片。漂浮片在37 ℃的人工胃液中立即起漂,药物释放曲线符合一级动力学模型,12 h释放>90%,持漂时间>10 h,表明该漂浮缓释片具有良好的漂浮能力和药物释放过程。胃漂浮制剂增加DMY在胃内的滞留时间,提高了药物的稳定性,从而增加药物在胃肠道的吸收,进而提高药物的生物利用度,以增强其解酒保肝、降血糖、调血脂等药理作用。
药物在体内的溶出速度是影响药物的起效时间、作用强度和实际疗效的限速因素。为了改善DMY溶出度,刘颢等[27]制备了DMY分散片,其平均崩解时限为69 s。以水为溶出介质,体外溶出实验显示,分散片在15 min内溶出度达90%以上,能达到速释要求。在压片前,对主药和辅料微粉化处理,能进一步增加分散片的溶出速度。
黄德福等[28]考虑到DMY自身性质不稳定,而在油相中稳定性相对较好,选用同样具有外用功效的茶油作油相,制备水包油型乳凝胶剂。加入二甲基亚砜(DMSO)可增加DMY在茶油中的溶解度。药物透皮吸收、制剂稳定性与刺激性实验将是该剂型下一步的研究方向。
4 存在问题包封率不高是DMY制剂新技术与新剂型研究面临的重要问题。已报道的脂质体包封率主要在58.1%~75.5%[4, 6, 7],单凝聚法制备的微囊包封率为66.1%[17],胃漂浮小球包封率也仅有57.78%[25],均小于80%,不符合《中国药典》要求。制剂新技术对DMY的增溶效果差异显著,水中药物浓度最高能达到175.2 mg/mL,而最低的仅为1.02 mg/mL,绝大部分制剂溶液中DMY的质量浓度为1~10 mg/mL,还有待进一步提高。包封率和药物浓度是影响制剂质量和疗效的重要因素,过低将不利于提高生物利用度。
稳定性研究对脂质体、胶束、微乳、自乳化系统来说也至关重要,存放时间越长,药物发生泄漏的可能性就越大,同样不利于DMY的稳定性和生物利用度的提高。有报道显示,脂质体的泄漏率较高,25 ℃下保存,30 d药物泄漏率为(13.9±1.3)%,50 d药物泄漏率为(19.4±2.2)%[6]。纳米胶束在制备过程中,水化介质的体积是影响纳米胶束包封率与粒径的关键因素,水化介质的体积越大,药物越易渗漏,导致纳米胶束的包封率降低[24]。固体分散体在储藏期内可能发生老化,尤其是当储藏的温度过高,湿度过大,存放时间太长,都可能使固体分散体出现变色、硬度变大、析出结晶或药物溶出度和生物利用度降低的情况。研究如何提高DMY制剂的稳定性十分必要。
胃漂浮型制剂延长了DMY在胃内作用时间,提高DMY的稳定性,但其溶解性并未见提高,是否有利于提高其生物利用度,以及漂浮片中加入了碳酸氢钠使片剂中的DMY处于偏碱性环境,是否对DMY稳定性造成影响都有待进一步探究。
DMY制剂新技术和新剂型均缺乏体内药动学研究。目前各种制剂新技术和新剂型主要集中于制备和表征,缺乏体内药动学的研究,难以确切说明制剂新技术和新剂型能够提高DMY溶解性、稳定性和生物利用度。因此,生物药剂学和药动学将是DMY下一步研究的重要方向。
5 前景展望DMY在自然界中量丰富,易于提取,且药理活性强,特别是在抗肿瘤、解酒护肝、抗菌消炎、抗氧化等方面的作用使其具有较大的开发利用价值[1]。了解DMY发挥某项药理作用所需的剂量范围以及毒性剂量在制剂开发中十分重要,亟待进一步的研究。DMY分子中含有2个手性碳原子,理论上存在4种构型,其光学活性是否对成药性有影响,4种构型中哪一种具有更强的体内药理活性,还可以进一步的探究。晶体结构可能会对DMY溶解度、溶出度、稳定性和机械性质等方面产生影响,探究晶体结构对DMY稳定性和生物利用度的影响也将成为有价值的研究方向[29]。
应用制剂新技术与新剂型在一定程度上解决了DMY溶解性差、稳定性不好和生物利用度低的问题,为成药性的研究奠定了基础。然而,目前也存在着不少的问题,如制剂包封率低、载药量小、稳定性差等。因此,在未来的研究中,需要不断探索解决这些问题的办法,同时也需要不断尝试其他改善DMY性质的方法,以获得最佳的效果。磷脂复合物作为一种新型的药物制剂,能显著地增加母体药物的脂溶性,促进药物的吸收,提高药物生物利用度。探究DMY磷脂复合物的制备可能将有利于改善DMY的脂溶性[30/span>]。此外,对DMY进行结构修饰,也是改善其溶解性和稳定性的重要方式。
随着DMY制剂新技术与新剂型研究的不断深入,生物药剂学和体内药动学机制的不断阐明,应用制剂新技术与新剂型不仅能够增加DMY溶解性、稳定性和生物利用度,而且通过进一步的剂型研究还能更好的服务于患者治疗的需要。
| [1] | 侯小龙, 王文清, 施春阳, 等. 二氢杨梅素药理作用研究进展[J]. 中草药, 2015, 46(4):603-609. |
| [2] | 何桂霞, 裴刚, 李斌, 等. 二氢杨梅素的稳定性研究[J]. 中国新药杂志, 2007, 16(22):1888-1890. |
| [3] | Ruan L, Yu B, Fu G, et al. Improving the solubility of ampelopsin by solid dispersions and inclusion complexes[J]. J Pharm Biomed, 2005, 38(3):457-464. |
| [4] | 齐娜, 黄凤香, 廖迎, 等. 二氢杨梅素脂质体的处方优化及性质考察[J]. 世界科学技术-中医药现代化, 2014, 16(6):1427-1433. |
| [5] | Zhou J, Zeng P, Tu H H, et al. Development and application of high-performance liquid chromatography for the study of ampelopsin pharmacokinetics in rat plasma using cloud-point extraction[J]. J Sep Sci, 2011, 34(2):160-168. |
| [6] | 何志峰, 刘德育, 曾飒, 等. 蛇葡萄素脂质体的制备研究[J]. 中国中药杂志, 2008, 33(1):27-30. |
| [7] | 赵莉莎, 刘德育. 5-氟尿嘧啶-蛇葡萄素复方脂质体的制备[J]. 中国现代应用药学, 2013, 30(2):158-163. |
| [8] | Huang H, Hu M, Zhao R, et al. Dihydromyricetin suppresses the proliferation of hepatocellular carcinoma cells by inducing G2/M arrest through the chk1/chk2/cdc25c pathway[J]. Oncol Rep, 2013, 30(5):2467-2475. |
| [9] | Shen Y, Lindemeyer A K, Gonzalez C, et al. Dihydromyricetin as a novel anti-alcohol intoxication medication[J]. J Neurosci:Official J Soc Neurosci, 2012, 32(1):390-401. |
| [10] | Immordino M L, Dosio F, Cattel L. Stealth liposomes:review of the basic science, rationale, and clinical applications, existing and potential[J]. Int J Nanomed, 2006, 1(3):297-315. |
| [11] | Lawrence M J, Rees G D. Microemulsion-based media as novel drug delivery systems[J]. Adv Drug Deliv Rev, 2000, 45(1):89-121. |
| [12] | Furlanetto S, Cirri M, Piepel G, et al. Mixture experiment methods in the development and optimization of microemulsion formulations[J]. J Pharm Biomed, 2011, 55(4):610-617. |
| [13] | Solanki S S, Sarkar B, Dhanwani R K. Microemulsion drug delivery system:For bioavailability enhancement of ampelopsin[J]. ISRN Pharm, 2012, 2012:1-4. |
| [14] | 张一, 吴春. 二氢杨梅素微乳对油脂的抗氧化活性研究[J]. 哈尔滨商业大学学报:自然科学版, 2010, 26(5):622-625. |
| [15] | 齐娜, 刘广, 刘春艳, 等. 二氢杨梅素自乳化系统的设计与质量评价[J]. 医药导报, 2014, 33(7):940-944. |
| [16] | Bysell H, Månsson R, Hansson P, et al. Microgels and microcapsules in peptide and protein drug delivery[J]. Adv Drug Deliv Rev, 2011, 63(13):1172-1185. |
| [17] | 叶勇, 欧贤红, 黄秋洁. 正交法优选二氢杨梅素微囊的制备工艺[J]. 时珍国医国药, 2012, 23(9):2251-2252. |
| [18] | 黄继红, 姚茂君. 二氢杨梅素微胶囊化壁材的优化研究[J]. 现代食品科技, 2007, 23(6):35-37. |
| [19] | 刘德育, 邓健杏, 王炜, 等. 蛇葡萄素微囊的制备[J]. 中药材, 2003, 26(5):355-357. |
| [20] | Vasconcelos T, Sarmento B, Costa P. Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs[J]. Drug Discov Today, 2007, 12(23/24):1068-1075. |
| [21] | 白秀秀, 夏广萍, 赵娜夏, 等. 羟丙基-β-环糊精对二氢杨梅素的增溶作用[J]. 中国实验方剂学杂志, 2013, 19(9):12-14. |
| [22] | 欧阳玉祝, 麻成金, 李志平, 等. 二氢杨梅素-β-环糊精包络物抗氧化稳定性及其动力学研究[J]. 食品与发酵工业, 2006, 32(10):37-40. |
| [23] | 黄仁杰, 鄢雪梨, 狄万鹏, 等. 蛇葡萄素纳米胶束含量与包封率的测定[J]. 药物分析杂志, 2015, 35(2):261-265. |
| [24] | Singh B N, Kim K H. Floating drug delivery systems:an approach to oral controlled drug delivery via gastric retention[J]. J Controlled Release, 2000, 63(3):235-259. |
| [25] | 黄仁杰. 蛇葡萄素胃漂浮小球的处方工艺优化[J]. 中国药师, 2008, 11(10):1194-1196. |
| [26] | 王金玲, 阎雪莹, 李春燕. 二氢杨梅素胃内漂浮片处方研究[J]. 中国现代应用药学, 2014, 31(2):182-186. |
| [27] | 刘颢, 郁建平. 二氢杨梅素分散片制备工艺及质量控制[J]. 山地农业生物学报, 2014, 33(1):24-27. |
| [28] | 黄德福, 黄仁杰. 蛇葡萄素乳凝胶剂的制备及其质量控制[J]. 福建医药杂志, 2012, 34(1):70-72. |
| [29] | Blagden N, De M M, Gavan P T, et al. Crystal engineering of active pharmaceutical ingredients to improve solubility and dissolution rates[J]. Adv Drug Deliv Rev, 2007, 59(7):617-630. |
| [30] | 郝海军, 张红芹, 贾幼智, 等. 采用制剂新技术提高中药磷脂复合物的溶出度和生物利用度研究进展[J]. 中草药, 2013, 44(17):2474-2479. |
 2016, Vol. 47
2016, Vol. 47


