柚皮素(naringenin,NRG)是一类天然二氢黄酮类化合物,该类物质广泛存在于葡萄和柑橘类水果中,现代药理学研究表明,其具有抗炎、抗氧化、抗纤维化、降低血糖等作用[1]。NRG是一种疏水性化合物,口服生物利用度低(约5.8%),因而制约了柚皮素的进一步推广使用[2]。为了改善其口服生物利用度,有研究者进行了NRG自微乳给药系统[3]和新型纳米结构脂质载体[4]等剂型的探索。
固体脂质纳米粒(SLN)以天然或合成的脂质作为骨架材料制成的纳米给药系统,具有较好的生理相容性,将药物包裹于脂质中或分散在纳米粒表面形成的新型纳米给药体系,最大限度地避免药物与外界环境及水溶液接触。既增加了药物的稳定性,延长了药物的半衰期,也解决了药物水溶性差的难题,进而提高了药物的生物利用度。同时SLN又具有纳米粒药物的泄露少、毒性低、操作简单等优点,可广泛应用于大规模生产的纳米给药系统[5]。本实验通过乳化蒸发-低温固化法制备柚皮素固体脂质纳米粒(NRG-SLN)冻干粉,筛选冻干保护剂并进行质量评价。为了进一步探索NRG新剂型治疗急性肺损伤(ALI)的效果,本实验结合疾病治疗的特点,选择肺部给药系统进行研究,采用气管注入方式肺部给药,比较NRG-SLN和NRG原料药溶液在大鼠体内的药动学行为,以探讨其肺部给药的可行性[6]。
1 仪器与材料JEM-1010透射电镜,日本电子株式会社;2500 PC X射线衍射仪,Rigaku Corporation;AL204电子天平,梅特勒-托利多仪器有限公司;DSC-60差示扫描量热仪,日本岛津公司。
NRG,质量分数≥98%,批号20140129,西安瑞迪生物科技有限公司;聚山梨酯-80(Tween-80,以下简称T80,批号201320604),天津市永晟精细化工有限公司;泊洛沙姆188(Pluronic F68,以下简称F68,批号20140219),天津市博迪化工股份有限公司;无水乙醇(分析纯);透析袋,截留相对分子质量8 000~14 000,批号20141108,美国联合碳化公司;葡聚糖凝胶50(Sephadex G-50),批号20141220,上海蓝季科技发展有限公司。
2 方法和结果 2.1 NRG-SLN的制备方法采用乳化蒸发-低温固化法制备NRG-SLN[7]。精密量取适量NRG、单硬脂酸甘油酯和卵磷脂溶于6 mL的无水乙醇中,于80 ℃恒温水浴锅加热使其充分溶解,构成有机相。另取适量F68和T80溶于18 mL水中构成水相,在80 ℃条件下将有机相在1 000 r/min搅拌下缓慢注入水相中,之后将得到的NRG-SLN混悬液于80 ℃下持续搅拌1~2 h除去残留的有机溶剂并浓缩至10 mL,将所得乳液在1 000 r/min搅拌下迅速倒入0~2 ℃的10 mL水中,冷冻固化2 h,得到半透明带淡蓝色乳光的NRG- SLN混悬液,过0.45 μm微孔滤膜,即得样品,4 ℃下保存,备用。
空白SLN除不加药物外,其他方法同上。
2.2 NRG-SLN中NRG的测定 2.2.1 检测波长的选择[8]参考相关文献,NRG- SLN经无水乙醇适当稀释后的最大吸收波长为288 nm,而此波长下空白SLN无干扰,因此确定检测波长288 nm。
2.2.2 线性关系及方法学考察精密称取NRG 1 mg,置10 mL量瓶中,用无水乙醇稀释得0.1 mg/mL储备液。取该储备液适量,用无水乙醇分别稀释成NRG质量浓度为1、3、5、7、9、11 μg/mL的对照品溶液,并在288 nm处测定各溶液的吸光度(A)值,以A值对质量浓度(C)进行线性回归,得回归方程:A=0.162 3 C+1.150 4,r=0.999 7,溶液在1~11 μg/mL内线性关系良好。
低、中、高质量浓度(1、7、11 μg/mL)NRG对照品溶液日内、日间精密度RSD的平均值分别为0.36%、0.47%(n=3);低、中、高样品的平均回收率分别为100.58%、101.06%、99.48%(n=3);取NRG质量浓度为7 μg/mL同一供试品溶液,分别于1 d内每隔2 h测定1次,记录A值,计算NRG质量浓度的RSD为0.78%,表明供试品溶液在24 h内稳定;取NRG-SLNs样品6份,平行配制供试品溶液进行测定,连续测样6次,记录A值,计算NRG质量浓度的RSD为0.61%,表明该方法的重复性好。
2.3 包封率和载药量测定方法的建立 2.3.1 色谱柱的制备选择Sephadex G-50色谱柱(20 cm×1.5 cm)分离NRG-SLN和游离NRG,取Sephadex G-50适量,置于烧杯中100 ℃煮3 h,在蒸馏水中放置冷却,将其缓慢倒入色谱柱中,适量蒸馏水冲洗,放置备用[9]。
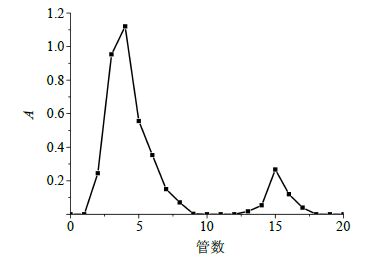
2.3.2 洗脱曲线的建立精密吸取NRG-SLN混悬液0.5 mL上样,以蒸馏水为洗脱液,洗脱体积流量为1 mL/min,收集洗脱液1 mL/管,总共20管,分别用无水乙醇稀释至5 mL,涡旋1 min并于288 nm测定其A值,得到洗脱曲线(图 1)。其中3~8管为有淡蓝色乳光的溶液,A值较大,是NRG-SLN混悬液,9~12管为蒸馏水,13~17管应为洗脱下来的游离药物NRG,NRG-SLN和游离NRG分离较好。
|
图 1 NRG-SLN洗脱曲线 Fig. 1 Elutioncurveof NRG-SLN |
精密吸取0.5 mL NRG-SLN混悬液上样,以蒸馏水为洗脱液,收集带乳光的部分,无水乙醇定容至10 mL,再精密吸取1 mL,无水乙醇定容至5 mL;另精密吸取NRG- SLN混悬液0.5 mL,无水乙醇直接定容至10 mL,精密吸取1 mL,无水乙醇定容至5 mL,使用紫外分光光度仪测定2种样品,利用外标一点法测定。利用公式计算包封率及载药量:包封率=W包/W总,载药量=W包/W脂质(W包为NRG-SLN通过Sephadex G-50色谱柱的NRG量,W总为NRG-SLN乙醇破乳后NRG的总量,W脂质为单硬脂酸甘油酯的量,忽视其他成分的干扰)。
2.4 单因素考察初选制备条件在预试验的基础上按照“2.1”项下制备方法进行单因素考察。单因素考察时固定因素的具体参数为10 mg NRG、100 mg单硬脂酸甘油酯、200 mg卵磷脂、6 mL无水乙醇,100 mg F68、200 mg T80、18 mL水、80 ℃乳化温度,冷冻固化2 h,搅拌速率为1 000 r/min。
2.4.1 搅拌速率的选择分别选择搅拌速率为500、1 000、1 500、2 000、2 500 r/min制备NRG- SLN,以其包封率为指标进行考察,结果1 000 r/min时效果最好。
2.4.2 乳化温度的选择分别选择乳化温度65、70、75、80、85 ℃制备NRG-SLN,以其包封率为指标进行考察,结果70、75、80 ℃包封率结果均较好,需要进一步优化。
2.4.3 冷冻固化时间的考察分别选择冷冻固化时间15、30、50、70、90、120 min制备NRG-SLN,以包封率为指标进行考察,在(0±2)℃的冰浴条件下,结果包封率随着冷冻固化时间延长而增大,90 min以后包封率几乎不再增加。
2.4.4 有机相(O)与水相(W)的体积比考察分别选择有机相和水相的体积比为1∶2、1∶3、1∶6、1∶9、1∶12制备NRG-SLN,以包封率为指标考察,结果1∶3时包封率最高。
2.4.5 药脂比(NRG与单硬脂酸甘油酯质量比)的选择分别选择药脂比为1∶5、1∶7、1∶10、1∶14、1∶25制备NRG-SLN,以包封率为指标考察,结果差异不规则,需要进一步考察优化。
2.4.6 脂质比(单硬脂酸甘油酯与卵磷脂投料比)的选择分别选择脂质比为1∶2、3∶4、1∶1、5∶4、2∶1制备NRG-SLN,以包封率为指标考察,结果脂质比为1∶2时,包封率最高。
2.4.7 F68与T80质量比的选择分别选择F68(100 mg)与T80质量比为1∶1、1∶3、1∶4、1∶6、1∶9制备NRG-SLN,以包封率为指标考察,结果1∶1、1∶3、1∶4时包封率差异不明显,需要进一步考察优化。
2.4.8 混合表面活性剂(F68和T80)用量的选择固定F68与T80质量比1∶1,分别选择混合表面活性剂用量为0.5%、0.875%、1.25%、1.75%、2.5%制备NRG-SLN,以包封率为指标考察,结果1.25%和1.75%时包封率差异不大,需要进一步优化。
2.5 NRG-SLN的处方优化设计根据预试验和单因素考察,筛选出乳化温度(A,℃),药脂比即药物和单硬脂酸甘油酯的质量比(B),混合表面活性剂(T80和F68)用量(C,%)及混合表面活性剂F68与T80质量比(D)为4个主要影响因素,每个因素又选取3个水平,以包封率、粒径为评价指标,L9(34) 正交试验法(表 1)优化NRG-SLN的制备工艺,筛选最佳处方。应用加权分析法对正交试验结果进行综合分析[7, 10],平均粒径(y1)和包封率(y2)分别按55%和45%的系数积分,综合评分(y)=55(1-y1/103.9)+45×y2/81.5。试验设计结果见表 1,方差分析见表 2。根据R值大小D>C>B>A,参考各因素的结果,得出最佳处方为A3B2C2D2,即药脂比1∶10,温度80 ℃,F68-T80(1∶2),混合表面活性剂用量为1.5%。
|
|
表 1 L9(34) 正交试验设计与结果 Table 1 Design and results of L9(34) orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
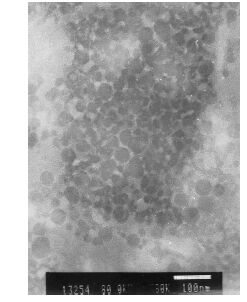
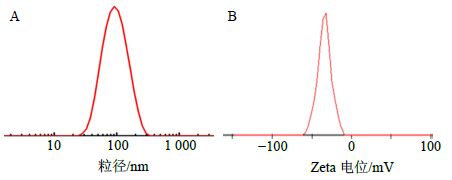
以最佳处方制备3批NRG-SLN,测定包封率及载药量。样品的包封率分别为82.22%、81.89%、79.16%,其平均值为(81.09±1.37)%,载药量分别为8.31%、8.27%、8.32%,其平均值为(8.30±0.04)%,表明本实验方法制备的NRG-SLN包封率较高,载药量较大。用蒸馏水适当稀释NEG-SLN混悬液,滴于铜网上,2%磷钨酸染色,空气中自然晾干,在透射电镜下观测纳米粒的形态(图 2),呈球形及类球形实心粒子。另取NEG-SLN混悬液,蒸馏水稀释20倍,激光粒度仪测定粒径(图 3-A)及Zeta电位(图 3-B)。本方法制备的纳米粒大小分布比较均匀,3批样品的粒径分别为94.81、96.71、101.55 nm,其平均值为(97.69±2.84)nm;PDI分别为0.218、0.207、0.198,其平均值为0.207±0.010;Zeta电位分别为−25.6、−26.7、−26.3 mV,其平均值为(−26.20±0.45)mV。
|
图 2 NRG-SLN的透射电镜图 Fig. 2 Transmission electron microscope of NRG-SLN |
|
图 3 NRG-SLN的粒径分布 (A) 和Zeta电位图 (B) Fig. 3 Particle size distribution (A) and Zeta potential (B) of NRG-SLN |
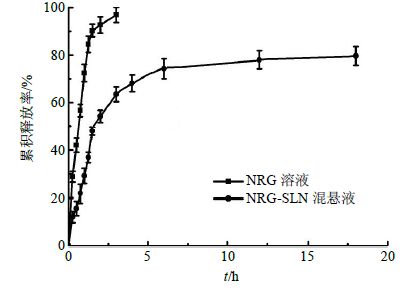
分别取2 mL NRG-SLN混悬液(含2 mg NRG)和2 mL NRG溶液(1 mg/mL的乙醇溶液)置透析袋中,扎紧两端,置锥形瓶,释放介质为含0.5% T80的磷酸盐缓冲液(pH 7.4),释放体积为50 mL,转速为150 r/min,温度为(37.0±0.5)℃进行试验。在预定的时间点0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0、8.0、12.0、24.0、36.0 h取样0.5 mL,同时补充等体积同温的释放介质。根据“2.2”项下方法采用外标一点法测量并计算各时间点NRG的释放量,以累积释放率为纵坐标,取样时间为横坐标绘制释放曲线(图 4)。NRG溶液在6 h的累积释放率达到了90%以上,而NRG-SLN混悬液约50%,24 h达到了80%。从结果中分析得出,固体脂质纳米粒载药系统可以延长药物的释放,达到缓释效果。
|
图 4 NRG溶液与NRG-SLN混悬液的体外药物释放曲线 (n = 3) Fig. 4 In vitro release of NRG solution and NRG-SLN (n = 3) |
分别加入2%、5%、10%的冻干保护剂(乳糖、甘露醇、蔗糖)于NRG-SLN混悬液中,涡旋混匀,分别移取2 mL于西林瓶中,−80 ℃冰箱预冻24 h后,冷冻干燥即可,得到淡白色疏松冻干粉,以外观、色泽、再分散性为考察指标,评分标准见表 3。实验结果(表 4)表明,以5%甘露醇为冻干保护剂效果最好,得到的冻干粉外形饱满,色泽均匀,再分散性好。
|
|
表 3 指标评分标准 Table 3 Score standard of indexes |
|
|
表 4 冻干保护剂的筛选 Table 4 Screening of lyophilized protective agents |
5%甘露醇为冻干保护剂制得的冻干粉,测得休止角为35°,流动性较好,量筒法测得冻干粉堆密度为0.3 g/mL。将冻干粉置于4 ℃,30 d后取样观察,冻干粉外观仍为淡白色,表面光滑平整,未见明显变化,加入适量蒸馏水复溶后,混悬液为淡蓝色带有乳光,再分散性好,测得平均粒径、Zeta电位、包封率分别为(111.5±14.5)nm,(−20.5±1.2)mV,(79.2±3.1)%。可见,5%甘露醇为冻干保护剂,冻干粉的稳定性较好,4 ℃下可长期贮存,有利于大规模生产应用。
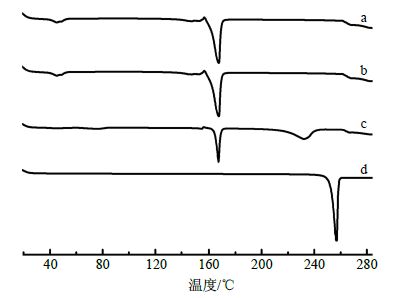
2.10 NRG-SLN冻干粉的理化性质研究将NRG、空白SLN冻干粉、NRG与空白SLN物理混合物、NRG-SLN冻干粉进行DSC分析,氧化铝(Al2O3)为参比物,升温范围18~285 ℃,以10 ℃/min的速率升温扫描,以NRG、空白SLN冻干粉,处方比例的物理混合物,NRG-SLN冻干粉为样品,分析结果见图 5。NRG原料药和物理混合物在168 ℃都有吸收峰,而NRG-SLN冻干粉在168 ℃的吸收峰消失,说明NRG以无定形状态存在SLN载体中。
|
图 5 NRG-SLN (a)、blank-SLN (b)、NRG与空白SLN物理混合物 (c) 和NRG (d) 的DSC图 Fig. 5 DSC analysis on NRG-SLN (a),blank-SLN (b),physical mixture of NRG and blank-SLN (c) and NRG (d) |
取健康的SD大鼠12只,随机分成2组,实验过程中严格遵守动物伦理委员会的规定。实验前禁食至少12 h,自由饮水,按照4 mg/mL NRG质量浓度配置NRG-SLN混悬液(冻干粉用双蒸水复溶,临用现配)和NRG原料药(分散在0.5%羧甲基纤维素溶液中,临用现配)进行肺部给药。肺部给药方法为注射器气管注入,给药前用0.3%戊巴比妥钠(10 mL/kg)腹腔注射麻醉。然后将大鼠固定在一倾斜约80°的木板上,大鼠自主呼吸,用喉镜使大鼠开口,镊子轻轻拉出舌头,慢慢将通气导管一端插入大鼠气管,预先装好样品的注射器(含NRG 4 mg,1 mL溶液)连接导管另一端并注入肺部,给药后维持鼠板倾斜80° 1 min,再呈水平放置。按剂量20 mg/kg给药后,分别于0.5、1.0、2.0、4.0、6.0、8.0、12.0、24.0 h眼眶取血0.5 mL,置于加有肝素钠的离心管中,8 000 r/min离心15 min,分离血浆,置−20 ℃冰箱中储存待分析。
2.11.2 大鼠血浆中NRG定量测定方法及血浆样品处理[2]通过高效液相测定大鼠血浆中NRG的质量浓度,测定条件:色谱柱为Hypersil BDS-C18柱(200 mm×4.6 mm,5 μm);流动相为甲醇-水(7∶3);体积流量为1 mL/min;检测波长为289 nm;进样量为20 μL;柱温30 ℃。
取200 μL血样,加入2%甲酸50 μL,涡旋2 min,再加入1.2 mL醋酸乙酯萃取血样,涡旋5 min。12 000 r/min离心10 min,上清液转移至离心管中,置真空离心浓缩干燥机挥干,残留物用50 μL流动相复溶,涡旋5 min,上层有机层被转移到新的EP管,40 ℃、34.475 kPa(5 psi)氮气压下浓缩。150 μL流动相(甲醇-水7∶3)复溶,取20 μL,进样。在该色谱条件下,最低检测限为1 ng/mL(信噪比为3∶1),NRG的保留时间为(4.500±0.105)min,峰形良好,血浆对柚皮素的测定无干扰,NRG在125~50 000 ng/mL线性关系良好,以待测物质量浓度为横坐标(C),峰面积为纵坐标(A),得到标准曲线方程A=63.69 C+26 803.05,r=0.999 67。
分别配制低、中、高质量浓度(500、10 000、50 000 ng/mL)的NRG空白血浆标准溶液,按血浆样品的处理方法操作,计算回收率,测定日内与日间(3 d内)精密度。结果低、中、高3个质量浓度样品的平均回收率分别为103.25%、99.40%、101.25%,日内精密度RSD值分别为3.11%、2.63%、2.53%(n=3),日间精密度的RSD值分别为3.30%、3.92%、4.12%(n=3)。该方法符合体内生物样品测定要求。
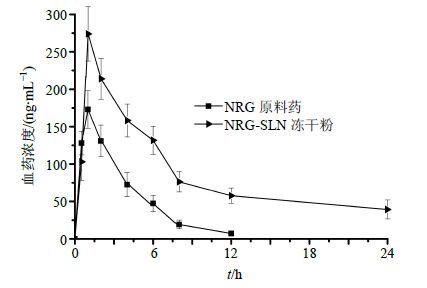
2.11.3 血浆样品测定结果按照“2.11.2”项方法进样,计算血浆样品中的药物浓度,绘制药物浓度-时间曲线(图 6)。药动学参数的求算以及处理大鼠血浆药物浓度数据均采用PK Solver 2.0软件进行处理[14],求得各药动学参数并对各给药组的主要药动学参数用SPSS 18.0软件进行独立样本t检验,P<0.05有统计学意义(表 5)。NRG-SLN肺部给药的相对生物利用度(AUC0-∞)远远高于NRG原料药,提高了约2.47倍(P<0.05)。
|
图 6 NRG原料药和NRG-SLN冻干粉肺部注入后药物在大鼠体内的平均药时曲线 (x,n = 6) Fig. 6 Concentration-time curve for NRG suspension and NRG-SLN (x,n = 6) |
|
|
表 5 NRG原料药和NRG-SLN冻干粉的主要药动学参数 (n = 6) Table 5 Pharmacokinetic parameters of NRG suspension and NRG-SLN (n = 6) |
本实验在预试验的基础上,以包封率、平均粒径大小为考察指标,正交试验法优化处方制备优化,结果发现以单种表面活性剂制备的NRG-SLN分散性不好,粒径较大,有絮状物的出现,呈乳白色,而以T80和F68组成的混合表面活性剂成型性好,稳定性高。
SLN有很多的制备方法,高压均质法是工业化、大规模生产的主要方法,制得的纳米粒粒径均匀性较好,但对设备的要求较高;薄膜-超声分散法制备过程容易控制,但制备过程中可产生微米级粒子,易产生金属污染,且成膜不均匀;溶剂注入法操作简单,不需要加热,但是制备中通常需要使用有机溶剂,导致残留的溶剂不易除去,潜在毒性较大。本研究采用乳化蒸发-低温固化法[4]制备NRG- SLN,具有制备设备简单,成本较低,制备出的纳米粒粒度分散较均匀,尤其适合实验室小规模研究使用。本实验考虑到单硬脂酸甘油酯的熔点为70~80 ℃,乙醇的沸点为78.3 ℃,乳化温度应有利于乳化,且有机溶剂易挥发完全,最终确定乳化温度为80 ℃。表面活性剂的使用不但降低了乳液的表面张力,而且增加了药物在脂质中的溶解度,单一表面活性剂时,在乳化过程中乳化不彻底,包封率较低且稳定性不高;而混合表面活性剂的使用,可显著提高包封有效降低了粒径,减少纳米粒的聚集,大大增加了药物的溶解度和稳定性[15]。
载药纳米粒和游离药物的分离是测定包封率和载药量的关键,本实验曾考虑采用超速离心法,以18 000 r/min离心30 min后仍未见分层,其原因可能是SLN粒径比较小,脂质材料相对密度比较接近。透析法单个样品在室温条件下的处理时间约24 h,比较耗时;超滤法和葡聚糖凝胶柱法成本较高;而葡聚糖凝胶色谱柱法能将不易进入凝胶内部的固体脂质纳米粒大分子先洗脱下来,易进入凝胶内部的小分子游离药物后洗脱下来而达到分离,且该法重现性好、快速有效、成本低,故本实验选择葡聚糖凝胶色谱柱法测定包封率[14]。
低温冷冻固化时,必须降温迅速,否则易导致纳米粒具有一定的软黏性,易粘连,粒径增大且易沉降,稳定性不好。搅拌速率也是影响粒径的重要因素,过低时粒径具有增大的趋势,稳定性较差;过快则易产生较多泡沫,易外溅,影响了表面活性剂的乳化效果,本实验采取1 000 r/min较为适宜[16]。根据双分子层理论,Zeta电位的大小与纳米粒体系的稳定性密切相关,Zeta电位在−20~−35 mV内,纳米粒相对较为稳定。本实验所制NRG-SLN的平均Zeta电位为(−26.20±0.45)mV,负电荷,斥力较强,稳定性较好。加入冻干保护剂后,冷冻干燥,可以阻止与纳米粒的直接接触,纳米粒不容易破裂,药物及脂质的氧化、水解速度降低,外层的表面活性剂与冷冻保护剂分子间发生氢键缔合,起到了“伪水化层”的作用,与水形成了低共融物或玻璃状物质,抑制了晶型的生长,使冰晶以微晶或无定型形态存在,降低其对纳米粒的挤压和机械损伤作用,可防止冻干过程中粒子的聚集,有效地抑制了药物的泄漏[17]。
与NRG原料药相比,NRG-SLN的t1/2延长,其原因可能是药物被包封在脂质载体中,有效地减缓了药物释放;Cmax和AUC0-t值分别为原料药的1.65倍和3.648倍,表明NRG-SLN能够显著提高肺部给药药物的生物利用度,其原因可能是NRG是含有酚羟基的黄酮类化合物,水溶性差,不易透过组织生物膜屏障,肺部的吸收率较低,而NRG- SLN将药物包埋在脂质载体材料中,一方面提高了体内的稳定性,增强其脂溶性,与肺泡表面更好融合,有助于SLN通过肺泡壁进入毛细血管,使其有效的血药浓度时间延长;另一方面可使NRG在体内具有缓释性能,从而延长药物在系统循环中的滞留时间,有利于提高肺部给药药物的生物利用度。此外,制剂中的表面活性剂,如T80和卵磷脂,有助于增加肺泡壁的渗透性或改进的脂质颗粒和肺泡壁之间的亲和性,表现出较好的生物黏附性;NRG嵌入固体脂质矩阵,可以减少了与细菌接触以及吸收过程中的酶降解,减少药物的降解和清除。
由图 4可知,游离的NRG溶液在6 h内累积释放率大于90%,而NRG-SLN释放了约50%,之后持续缓慢释放至24 h达到了80%。SLN起始时释放较快的原因可能是SLN外表面的有一定量的药物快速释放和较小的颗粒具有较大的比表面积而增加初始药物的释放速率。SLN通常有3种包封药物模型:(1)固溶体模型;(2)核-壳模型,药物丰富的壳中;(3)核-壳模型,药物丰富的核心。本实验制备的NRG-SLN最符合核-壳模型。
至今国内外仍无NRG制剂用于临床,而纳米载药系统具有很好的应用前景,SLN具有良好的肺部耐受性,但不稳定、药物易泄漏,如果将其制备成冻干粉吸入剂,不仅可以提高其稳定性,而且使用方便。本实验为NRG-SLN肺部给药系统的进一步研究提供了理论依据和实验基础。
| [1] | 季鹏, 赵文明, 于桐. 柚皮素的最新研究进展[J], 中国新药杂志, 2015, 24(12):1382-1387. |
| [2] | Khan A W, Kotta S, Ansari S H, et al. Enhanced dissolution and bioavailability of grapefruit flavonoid Naringenin by solid dispersion utilizing fourth generation carrier[J]. Drug Dev Ind Pharm, 2015, 41(5):772-779. |
| [3] | 王章姐, 胡容峰, 王国凯, 等. Box-Behnken设计-效应面法优化柚皮素自微乳给药系统[J]. 中草药, 2014, 45(17):2461-2466. |
| [4] | 李静静, 贾运涛, 田睿, 等. 柚皮素纳米结构脂质载体的处方优化和初步评价[J]. 中草药, 2015, 46(2):211-215. |
| [5] | Ren J G, Zou M J, Gao P, et al. Tissue distribution of borneol-modified ganciclovir-loaded solid lipid nanoparticles in mice after intravenous administration[J]. Eur J Pharm Biopharm, 2013, 83(2):141-148. |
| [6] | 张天柱, 马春华, 樊湘泽. 柚皮素对脂多糖诱导小鼠急性肺损伤的保护作用研究[J]. 中药药理与临床, 2013, 29(6):29-31. |
| [7] | 于桐, 吴超, 季鹏, 等. 黄芩素固体脂质纳米粒冻干粉的制备及体外释药性质的研究[J]. 中草药, 2015, 46(18):2720-2727. |
| [8] | 季鹏, 赵文明. 柚皮素固体脂质纳米粒的制备及体内外初步评价[J]. 中国新药杂志, 2015, 24(18):2147-2152. |
| [9] | 夏爱晓, 宋倩倩, 孙渊, 等. 硫酸长春新碱固体脂质纳米粒的制备及其性质考察[J]. 中国现代应用药学, 2013, 30(2):163-169. |
| [10] | 张晓娟. 淫羊藿苷隐形固体脂质纳米粒冻干粉制备及质量控制[J]. 中国医院药学杂志, 2014, 34(9):732-734. |
| [11] | Parveen R, Ahmad F J, Iqbal Z, et al. Solid lipid nanoparticles of anticancer drug andrographolide:formulation, in vitro and in vivo studies[J]. Drug Dev Ind Pharm, 2014, 40(9):1206-1212. |
| [12] | 季鹏, 赵文明. 柚皮素脂质体冻干粉的制备及其药效学评价[J]. 中国医学科学院学报, 2015, 37(2):208-214. |
| [13] | Yang X Y, Liu Y J, Liu C X, et al. Biodegradable solid lipid nanoparticle flocculates for pulmonary delivery of insulin[J]. J Biomed Nanotechnol, 2012, 8(5):834-842. |
| [14] | 季鹏, 赵文明. 柚皮素脂质体的制备及大鼠肺部给药药动学研究[J]. 中成药, 2015, 37(8):1699-1704. |
| [15] | Jose S, Anju S S, Cinu T A, et al. In vivo pharmacokinetics and biodistribution of resveratrolloaded solid lipid nanoparticles for brain delivery[J]. Int J Pharm, 2014, 474(1/2):6-13. |
| [16] | Zhang Y, Huo M R, Zhou J P, et al. PKSolver:An add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel[J]. Comput Methods Programs Biomed, 2010, 99(3):306-314. |
| [17] | Fan Y P, Liu J G, Wang D Y, et al. The preparation optimization and immune effect of epimedium polysaccharide-propolis flavone liposome[J]. Carbohydr Polym, 2013, 94(1):24-30. |
 2016, Vol. 47
2016, Vol. 47


