毒品是指出于非医疗目的而反复连续使用能够产生依赖性(即成瘾性)的药品。毒品的泛滥会直接危害人们的身心健康,并给经济发展和社会进步带来巨大的威胁。据中国禁毒网官方报道,自对吸毒人员实行网络注册登记以来,统计数据显示,我国吸毒人数逐年递增,形势严峻,见图 1。
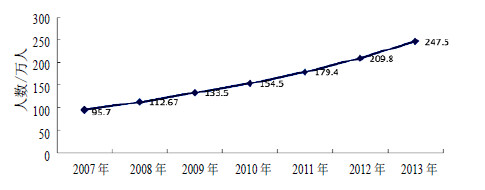 | 图 1 2007—2013年注册吸毒人数Fig.1 Number of registered drug addicts from 2007 to 2013 |
中药作为常用的3类治疗吸毒的药物之一,具有多靶点作用、无成瘾性等的特点。早在1833年何其伟就在其戒烟专著《救迷良方》中记载了中药方剂“补正丸”“忌酸丸”等的使用方法和戒毒理论,流传甚广[1, 2]。随着社区戒毒、家庭戒毒模式被越来越多的患者接受,中药戒毒显示出巨大的优势。为此,本文就近几年来对中药戒毒机制以及在治疗稽延性症状和防复吸上的研究进行回顾性总结,为研发更为安全有效的中药戒毒药提供一定的参考。
1 中药戒毒的现状自1995年7月7日卫生部颁发了第一个国家级中药戒毒药——福康片的批准证书以来,中药戒毒药的研制获得了国内外的广泛关注。中药戒毒药多靶点作用且无成瘾性,有望打破化学药戒毒的现状,改变“一日染毒、终生戒毒”的通常状况。截止2015年1月21日,获得国家食品药品监督管理总局(SFDA)批准的中药戒毒药已有9种,见表 1。
| 表 1 SFDA已批准上市的中药戒毒药 Table 1 Detoxification medicines of CMM approved by SFDA |
戒毒是指吸毒人员戒除吸食、注射毒品的恶习及毒瘾。对吸毒者进行戒毒治疗,一般应包括3个阶段:脱毒、康复和重新步入社会的辅导。目前常用的戒毒方法有3种:自然戒断法、药物及非药物戒断法。其中又以药物戒断法(又称药物脱毒治疗,是指给吸毒者服用戒断药物,以替代、递减的方法,减缓、减轻吸毒者戒断症状的痛苦,逐渐达到脱毒的戒毒方法)最为重要。常用戒毒药物又可分为3类:阿片类化学药、非阿片类化学药、中药。中药戒毒的方法相较于目前最为常用的美沙酮(阿片类化学药)替代疗法具有顺应性好、无成瘾性[3]、对稽延性症状疗效确切[4]、操守率(吸毒者戒毒后不再复吸的比例)高[5]等特点。随着国家把家庭戒毒确立为对吸毒人员实行“强制戒毒、劳教戒毒和自愿戒毒”3种方式的补充和延伸,中药戒毒药因其无成瘾性,可凭医生处方在药店直接购买,在让吸毒人员摆脱毒瘾,回归社会过程中发挥着越来越重要的作用。
2 戒毒中药的研究从9种戒毒中成药中单味药使用频数来看,发现延胡索、洋金花、人参、附子、丹参、白芍、黄连出现的频次较多。对中药有效成分的戒毒作用研究有利于阐明中药戒毒药发挥治疗作用的机制,有利于中药戒毒药的复方创新以及质量标准的科学制定,进而促进中药戒毒制剂的现代化和国际化[6]。已有研究表明,延胡索、附子能明显降低戒断大鼠身体晃动、头部和四肢颤抖;洋金花能明显减少肢体伸展、面部颤抖、腹泻、多尿及异样姿势;人参可防止吗啡耐受性和成瘾性,并有适应原样作用,还可调节人体状态,缓解戒断症状。然而对成瘾及戒断症状产生治疗作用的中药有效成分的研究还十分有限。目前有效成分研究比较透彻的戒毒中药主要有延胡索、人参、黄芪、丹参等。
2.1 延胡索延胡索具有活血、行气、镇痛的功效,一直是中医戒毒的常用药。现代研究表明其具有良好的镇痛、镇静、催眠、安定的药理作用[7]。延胡索中已经鉴定的成分主要有延胡索乙素(L- tetrahydropalmatine,L-THP,又称四氢巴马汀)、紫堇碱(corydaline)、去氢紫堇碱(de-hydrocorydaline)等。L-THP是延胡索中主要的有效成分,具有镇痛、镇静和安定的作用[8]。条件性位置偏爱(conditioned placepreference,CPP)实验是目前评价药物精神依赖性的经典实验模型,其可以评价对成瘾物质精神依赖的程度。有研究表明,不同浓度的L-THP能加速吗啡CPP效应的消退,而且研究证实其原因之一为L-THP具有多巴胺(DA)受体阻滞剂功能,当进入中枢后,可优先阻滞脑内如纹状体、伏隔核等DA受体最丰富的脑区的D2受体亚型,逆转DA神经元的损伤和对多巴胺受体的阻滞作用,降低吗啡成瘾产生的欣快感,减轻吗啡的奖赏效应,从而导致CPP效应的消退。CPP效应消退的同时L-THP亦能逆转实验大鼠下调的多巴胺转运体(dopamine transporter,DAT)和多巴胺D2受体(D2R)的表达。提示L-THP治疗精神依赖的机制与下调其升高的DA递质水平,以及上调DAT和D2R的表达有关[9]。郭萍[10]的研究同样也发现L-THP能加速吗啡CPP效应的消退,而且认为其可能的机制之一是逆转了中脑腹侧被盖区-伏核-前额叶皮质(VTA-NAc- PFC)环路中升高的谷氨酸量和下调了N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptor,NMDA)受体NR2B亚基的表达。
2.2 丹参丹参具有祛瘀止痛、活血通经、清心除烦之功效。现代研究表明丹参对中枢神经系统具有生理病理多功能调节的作用,表现为丹参具有中枢神经系统镇静、改善记忆、中枢镇痛、增加脑组织ATP水平、改善大脑微循环和抗癫痫等作用[11]。丹参主要含有脂溶性和水溶性2类成分。脂溶性成分主要有丹参酮(tanshinone)、丹参醇I(tanshinolA)、隐丹参酮(cryptotanshinone)等;水溶性成分主要有丹参素、原儿茶酚醛、原儿茶酸等。丘宏强[11]用甲醇对丹参的主要成分进行提取得到丹参甲醇提取物(SmM),药效实验显示一定剂量的SmM能够在一定程度上缓解吗啡依赖小鼠的戒断症状。为进一步筛选活性成分,用不同的有机溶剂对SmM里不同极性物质进行分离,得到石油醚提取物(SmP)、乙醚提取物(SmE)、醋酸乙酯提取物(SmA)。药效实验显示,只有用SmE处理的吗啡依赖小鼠与对照组有显著性差异,具有统计学意义,提示SmE为SmM中抗小鼠吗啡戒断的主要有效组分。继续对丹参乙醚提取物进行硅胶柱色谱,洗脱分离得到3种主要物质,分别为SmE1、SmE2和SmE3。3种物质的药效实验结果提示SmE中主要抗吗啡依赖小鼠戒断的物质为SmE2。薄层色谱法(TLC)对SmE2的初步鉴定显示SmE2并非丹参酮IIA,推测可能是以隐丹参酮为主的丹参酮类物质。后续研究还证明了SmE2不存在自身依赖性,SmE2具有治疗阿片类药物依赖的潜力,其中枢作用机制可能是降低脑内NO水平病理性的升高。蔡萍等[12, 13]研究证明了隐丹参酮具有一定的抗吗啡依赖作用。同时也说明了隐丹参酮的抗吗啡依赖作用可能与在中枢改变小鼠大脑皮质NO递质水平有关。
2.3 人参人参具有补气、固脱、安神、益智的功效,被誉为“百草之王”。它能调节中枢神经系统兴奋过程和抑制过程的平衡、影响学习记忆、抗疲劳等[14]。人参的主要成分为人参皂苷Ra、Rg、Re和人参烯(panacen)等[15]。目前研究己经明确,人参抗阿片类依赖的有效成分就是其中的人参皂苷类成分,它既能减轻吗啡引起的躯体依赖,又可抑制吗啡引起的精神依赖[16]。成瘾本身是一种记忆,是一种畸形记忆。药物成瘾不仅是一种慢性复发性的脑病,而且是一种病理性学习记忆过程[17]。海马是大脑中重要的学习与记忆结构,参与了吗啡慢性身体依赖和心理依赖的形成,并诱导复吸,且是慢性吗啡成瘾过程中的重要中心环节。人参皂苷A,即人参皂苷Rgl,是人参的标志性成分[18],能改善记忆全过程[19]。钙离子对细胞功能起着重要的调节作用。人参皂苷Rgl本身并不能引起正常海马神经元细胞内 [Ca2+]i的改变,但能显著缓解吗啡慢性给药引起的海马神经元细胞 [Ca2+]i的升高,防止吗啡引起细胞内的钙超载,减少海马神经元细胞凋亡或死亡,从而改善记忆,其作用呈剂量依赖性。人参对学习记忆的影响还具有双向性,可能与不同的人参皂苷成分和剂量对学习记忆的作用不尽相同有关。另有研究认为人参皂苷类成分可能通过对DA、γ-氨基丁酸、5-HT等神经递质的调节和对细胞信号转导的作用拮抗阿片类药物成瘾作用[16]。
2.4 黄芪黄芪具有益气固表、脱毒、增强机体免疫功能的功效,其主要化学成分有多糖、黄酮类及皂苷类等[20]。研究表明,黄芪醇提物能显著抑制吗啡诱导的小鼠CPP的形成,说明黄芪中含有具有缓解吗啡精神依赖作用的活性成分[21]。对黄芪醇提物中各极性部位进一步提取分离,发现只有正丁醇提取物能显著对抗吗啡依赖小鼠CPP的形成。继续对正丁醇提取物的主要成分黄芪总苷(astragalosides,AST)柱色谱分离得到AST1、AST2、AST3、AST4 4种物质。药效实验显示,AST3为AST中抗吗啡位置偏爱的主要物质。薄层色谱法定性鉴别AST3,显示AST3含有黄芪甲苷,高效液相色谱法进一步测定AST3,确定AST3中的主要成分为黄芪甲苷。药效实验显示AST3可降低吗啡依赖小鼠大脑皮质NO水平,抑制脑内cAMP水平的升高,这可能是AST3缓解吗啡精神依赖的中枢作用机制之一[22]。
2.5 酸枣仁酸枣仁具有宁心、安神、敛汗的功效,现代药理学研究表明酸枣仁还具有增强免疫、镇静、抗焦虑等的作用。此外,对小鼠学习功能的实验表明,酸枣仁在镇静安眠时,对小鼠的学习记忆功能还有一定的加强作用[23]。酸枣仁的主要化学成分有皂苷类、黄酮类、三萜类等[24]。药效实验表明,一定剂量的酸枣仁乙醇提取物可较明显抑制小鼠吗啡诱导的CPP效应的形成。提示该提取物中含有某些活性成分发挥了此作用。分离酸枣仁乙醇提取物不同极性部位,并分别进行药效实验,发现有效活性成分可能分布于醋酸乙酯提取物和正丁醇提取物中。酸枣仁正丁醇提取物主要含黄酮类化合物(flavanoid,FLA),对其进一步分离提纯,确定FLA主要物质为斯皮诺素(spinosin),药效实验结果显示其对小鼠吗啡诱导产生的CPP效应形成有较明显的拮抗作用。酸枣仁FLA抑制吗啡精神依赖的形成机制可能与其降低吗啡依赖小鼠脑内NO水平有关[25]。另有研究表明,酸枣仁可降低小鼠脑内DA水平[26],从而起到拮抗阿片类药物奖赏效应形成的作用;还能抑制谷氨酸诱导的神经元细胞内Ca2+浓度的升高,阻断兴奋性氨基酸介导的兴奋性神经信号传递[27],这是否与斯皮诺素降低NO水平有关还需进一步研究证明。
2.6 青风藤青风藤含有青藤碱(sinomenine)[28]、尖防己碱(acutumine)[29]、胡萝卜苷[30]等化学成分,其具有镇痛、镇静、调节免疫等药理作用[31]。青藤碱是青风藤中的主要成分,最高量可达2%,同时也是其戒毒作用的主要有效成分。研究表明青藤碱对吗啡依赖戒断症状具有治疗作用。它能调节纳洛酮催促戒断后吗啡成瘾大鼠脑内单胺类神经递质的量,抑制吗啡依赖神经细胞钙浓度的升高,抑制吗啡慢性作用引起的小鼠脑内cAMP水平[32]。另有研究表明,青藤碱还能有效缓和小鼠各脑组织中神经性NO合酶(nNOS)活性和nNOS mRNA水平[33, 34],使脊髓与小脑中因慢性吗啡用药发生不同程度异常上调的人类血红素氧合酶(HO2)和sGCα1基因的mRNA水平恢复正常[35]。
2.7 钩藤钩藤中主要生物碱成分是钩藤碱,具有镇静、镇痛、抗癫痫等药理作用[36]。在小鼠依赖模型上,钩藤碱能抑制吗啡的大部分戒断症状。其可能的机制是阻滞外Ca2+内流和内Ca2+释放、大脑皮质神经元L型钙通道和电位依赖性钙通道,抑制脑缺血损伤神经元内钙超载[37, 38, 39, 40, 41, 42],从而对抗吗啡依赖产生的戒断症状。陈晋[43]的研究表明钩藤碱能通过对NMDA-AMPA受体通路的复杂调控对抗氯胺酮成瘾。
2.8 洋金花洋金花中主要的生物碱成分是东莨菪碱(scopolamine),亦称天仙子碱(hyoscine),约占总生物碱的85%。在大鼠吗啡CPP激活模型中,不同剂量东莨菪碱均可抑制吗啡诱发的吗啡依赖大鼠CPP重现效应,这可能与东莨菪碱阻断乙酰胆碱能受体,进而阻断吗啡依赖大鼠成瘾记忆有关。免疫组化实验结果显示,吗啡激活大鼠CPP形成后,大鼠的杏仁核中磷酸化cAMP反应元件结合蛋白(phospho-cAMP response element bindingprotein,p-CREB)、即刻早基因(c-Fos)表达升高,而东莨菪碱处理组大鼠杏仁核中p-CREB、c-Fos表达减少,提示东莨菪碱阻断吗啡诱发的吗啡依赖性CPP效应的重现还可能与抑制杏仁核中p-CREB、c-Fos的表达有关[44]。王黎光等[45]研究发现东莨菪碱可能是通过阻断IP3-Ca2+途径,降低细胞内Ca2+浓度,进而提高痛阈、减轻躯体依赖和戒断症状来发挥抗吗啡依赖作用。另外,东莨菪碱能抑制滥用药物诱导的行为敏感化(动物对成瘾药物反应增强的外在表现)的发展,可能是因为其阻断胆碱能系统对海马和皮层的刺激作用,进而通过破坏学习记忆实现的[46]。
2.9 其他附子具有回阳救逆、散寒止痛的功效,主要化学成分为乌头碱(aconitine)、中乌头碱(mesaconitine)、苯甲酰乌头胺(benzoylaconine)等。现代药理学研究表明,附子具有镇痛、免疫调节、抗炎等药理作用[47]。附子能抑制吗啡诱导的CPP形成,具有抗成瘾作用,其机制可能是增加大鼠脑伏隔核强啡肽的浓度,从而激动κ受体[48]。此外,附子汤对吗啡依赖大鼠戒断症状也有一定的治疗作用,其机制可能是抑制中枢神经系统单胺类神经递质释放和维持、调节细胞内游离Ca2+浓度[49]。
茶色素一般是从红茶、绿茶直接提取而得到,主要成分为茶黄素类(theaflavins,TFs)、茶红素类(thearubigins,TRs)。茶色素能抑制吗啡依赖小鼠体质量下降、跳跃次数增加等催促戒断症状,还能对抗吗啡所致的免疫功能低下,其戒毒作用可能与其抗脂质过氧化、清除氧自由基以及增强机体免疫功能有关[50]。刘广宣等[51]研究表明茶色素对吗啡依赖小鼠戒断作用可能与其下调下丘脑中去甲肾上腺素(NE)、DA的量和下调大脑皮质内β-EP量有关,且下丘脑NE、DA的变化与大脑皮质β-EP量的变化有某种相互依存关系。
茉莉根主要含挥发油和脂肪酸2类成分,其浸膏能抑制戒毒过程中出现的焦虑、烦躁、失眠、疼痛等主要戒断症状及迁延症状[52];其石油醚、氯仿和丙酮提取物也能明显对抗由吗啡引起的依赖催促戒断症状[53]。
对附子、茉莉根、茶色素中发挥戒毒作用的有效成分及其戒毒机制尚有待进一步研究。
3 中药戒毒机制的研究在正常人的脑内和体内一些器官,存在着内源性阿片肽和阿片受体。在正常情况下,内源性阿片肽作用于阿片受体,调节着人的情绪和行为。人在吸食海洛因等毒品或长期、过量使用具有依赖性潜力的药物后,抑制了内源性阿片肽的生成,逐渐形成在依赖性药物作用下的平衡状态,引起奖赏效应(一旦停用就会出现不安、焦虑、忽冷忽热、起鸡皮疙瘩、流泪、流涕、出汗、恶心、呕吐、腹痛、腹泻等),最后形成毒瘾。阿片类药物滥用是形成毒瘾的主要原因,对其依赖的形成涉及多重机制。
3.1 对伏隔核的影响伏隔核(NAcc)是基底前脑的一个较大的核团,是一组波纹体中的神经元,在大脑的奖赏、笑、成瘾以及安慰剂效果等活动中起重要作用。有研究表明,DA神经元集中的中脑腹侧被盖区(VTA)是奖赏系统神经元通路的起始部位,其主要投射区NAcc被认为是阿片依赖相关的主要核团[54, 55, 56],也就是说VTA、NAcc在形成依赖中起到关键作用。谌红献等[57]以NAcc为研究靶点,以前阿黑皮素原(POMC)基因表达为研究重点,探求安君宁戒毒治疗作用的生物学机制。采用原位杂交技术测定中药戒毒药安君宁干预组与干预对照组NAcc内POMCmRNA水平。结果表明安君宁能促进吗啡依赖大鼠伏隔核内POMC表达的恢复。而阿片依赖状态的动物脑内β-EP水平下降,POMC mRNA表达水平下降,而强啡肽的水平升高。这可能是安君宁能减轻稽延期海洛因依赖患者的渴求的原因。另外,安君宁能降低成瘾时VTA内增高的胶质原纤维酸性蛋白(GFAP)水平,促使其恢复正常。这可能是安君宁促进吗啡成瘾所导致得大鼠VTA内的一些可塑性损伤的原因[58]。
3.2 对免疫系统的影响吸毒能破坏人的免疫系统,导致患者免疫力低下,抵抗力下降。王宇华等[59]以剂量递增法建立吗啡依赖动物模型,分别观察了中药戒毒药济泰片对吗啡损伤小鼠免疫器官质量、单核-巨噬细胞功能、迟发性变态反应(DTH)、血清溶血素量的影响。结果显示,剂量为0.30 g/kg和0.60 g/kg能显著抑制慢性吗啡所引起的小鼠胸腺和脾脏萎缩(P<0.05、0.01),能显著增强吗啡损伤小鼠单核-巨噬细胞吞噬功能、增加吗啡损伤小鼠耳DTH和吗啡损伤小鼠血清溶血素的生成(P<0.01),说明济泰片能改善患者的免疫功能损伤。向晓辉等[60]研究证明了新生戒毒胶囊在体液免疫和细胞免疫2方面提高海洛因依赖小鼠的机体免疫力。谌红献等[61]研究表明,安君宁能促进吗啡依赖大鼠依赖相关脑区前脑啡肽原(PENK)表达的恢复。前脑啡肽原经酶加工成为脑啡肽(enkephalin,ENK),具有免疫调节作用[62]。
3.3 对血清NO的影响吗啡能诱导大脑的氧化应激反应,增加活性氧的形成,进而使谷氨酸能系统过度活跃[63, 64]。谷氨酸是中枢神经系统主要的兴奋性神经递质,它的释放增加在吗啡耐受,依赖和戒断症状的形成过程中发挥着重要作用[65]。NMDA受体是离子型谷氨酸受体的一个亚型,是谷氨酸的一个主要受体,其参与了吗啡镇痛耐受和依赖的形成[66, 67]。NMDA受体介导很多谷氨酸行为,是由一氧化氮合成酶(NOS)的激活和NO的形成所介导[68]。研究表明,多种非竞争性和竞争性的NMDA受体拮抗剂、一氧化氮合成酶抑制剂能够抑制吗啡的耐受和依赖[69]。长期应用成瘾药物还可上调胞内Ca2+浓度水平,进而通过Ca2+-NOS-NO-cGMP和Ca2+-CaM-CaMK-CREB通路参与药物成瘾的形成[22]。
在阿片戒断状态时兴奋性氨基酸如精氨酸、谷氨酸生成增多,NMDA-NO-cGMP通路被激活,从而介导适应性变化[70]。杨琼芳等[71]首先采用剂量递增法,建立海洛因依赖大鼠模型,然后注射纳洛酮进行催促戒断,再ig给予高、低剂量华清合剂30 d,观察大鼠稽延性戒断症状的抑制效果,并检测实验大鼠血清NO水平。结果显示华清合剂能明显抑制海洛因依赖大鼠的戒断反应,显著降低血清NO水平。提示NO可能在介导戒断反应发生的过程中发挥关键作用。另外,该研究还发现在上述实验条件下,华清合剂抑制稽延性戒断症状的作用随剂量增大而增强,高剂量药物组的作用与低剂量药物组比较差异有显著性。而且在药物依赖动物的体质量变化上,高剂量药物组的体质量变化具有统计学意义。
3.4 对单胺类神经递质的影响单胺类神经递质是含有芳乙胺结构的神经递质,主要包括DA、5-羟色胺(5-HT)、NE等。研究表明,药物成瘾涉及DA、NE、5-HT、乙酰胆碱(Ach)等多种神经递质系统[72, 73, 74, 75, 76, 77]。向仕平等[78]用荧光分光光度法检测56例海洛因依赖者(注射组35例、烫吸组21例)治疗前后和23例正常人血浆及血小板5-HT、5-HIAA、DA和NE的量。结果显示海洛因依赖者血浆5-HT、5-HIAA、DA和NE的量均高于对照组(P<0.01),经舒通安胶囊治疗后血浆5-HT、5-HIAA、DA和NE的量显著降低(P<0.01),烫吸组NE高于注射组(P<0.05)。说明舒通安胶囊可调节海洛因依赖者外周单胺类递质水平。
4 中药戒毒药临床研究戒毒包括第1阶段脱毒,第2阶段康复,最后回归社会。脱毒阶段以美沙酮为代表的药物替代疗法对控制症状有良好的效果,且不良反应小。但因美沙酮本身也算毒品,具有成瘾性,尽管在脱毒上具有速效的特点,但却在戒毒上具有明显的局限性即脱毒易、戒断难。据报道,这种“以小毒替大毒”的替代疗法复吸率高达95%以上。中药戒毒无成瘾性,其对稽延性症状和复吸问题的突出效果有望打破化学药无法彻底戒毒的局面。
4.1 治疗稽延性症状稽延性戒断症状是指许多依赖者在急性戒断综合征消退之后,仍有各种各样的不适症状,常见者为浑身无力、失眠、食欲低下、怕冷、易激惹、情绪恶劣等,且可持续达数月甚至1~2年之久。无法忍受稽延性症状带来的折磨是导致复吸率居高不下的重要原因。中药在治疗稽延性症状方面具有独特的优势。黄德彬等[79]研究结果表明,半夏厚朴汤加味可改善海洛因依赖脱毒后稽延性戒断症状,并且早期用药似有降低复吸率的趋势。据有关学者研究,海洛因依赖者92.4%有便秘。便秘的患者常出现头痛、乏力、食欲不佳、腹胀、消化不良等稽延性症状。陶继武等[80]研究证明番泻叶浸剂是治疗阿片类物质所致便秘的有效药物。王卓[4]发现复方中药安君宁在治疗海洛因依赖稽延性戒断症状时,可以有效缓解巩固期睡眠障碍。汤真清等[81]发现在治疗抑郁症状方面,济泰片能改善患者的抑郁症状,且效果略优于美沙酮。
4.2 防复吸精神依赖是造成复吸的首要原因。军事医学科学院杨征教授的初步研究发现,延胡索的提取物左旋四氢帕马汀在脱毒后期具有优势,尤其是降低吸毒者对毒品的渴求,具有天然“鸡尾酒”样效应。研究表明,安君宁、济泰片、益安回生口服液单用即能有效控制稽延性症状[4, 82, 83]。玄夏祛毒胶囊合并小剂量丁丙诺啡能有效地控制海洛因依赖者的急性戒断症状和对成瘾物质的渴求[83],疗效与美沙酮基本相当。济泰片可以抑制精神依赖产生的觅药行为,对阿片类物质的复吸有一定的预防作用[84]。
5 展望中药戒毒历史悠久,具有无成瘾性、多靶点治疗,在治疗稽延性症状和防复吸方面疗效显著的特点。对单味中药的活性成分及其戒毒机制进行研究有利于中药戒毒药的应用和开发。阿片成瘾、戒断症状、复吸等问题涉及脑内多个部位,机制复杂,中药戒毒复方能充分发挥其多靶点,综合治疗的优势,高通量筛选技术和天然产物的快速分离技术的日益成熟也有望解决中药戒毒复方有效成分筛选的难题,但目前大多中药戒毒复方都是在传统戒毒古方的基础上演变而来,有效活性成分多而复杂,其戒毒机制比较模糊,药理和毒理方面的研究也相对较少,限制了中药戒毒复方的科学化、标准化和国际化。对中药戒毒复方多种有效成分的药理、毒理研究的全面观察和评价任重而道远,本文对中药戒毒有效成分和机制进行了归纳和总结,以期为后续中药戒毒药的药理、毒理等研究提供参考。相信在中医戒毒理论指导下和中药现代研究的基础上定能研制出更加安全、有效的新型中药戒毒药,为人类健康做出贡献。
| [1] | 刘 悦. 清代鸦片烟毒与中医戒烟研究的历史考察 [D]. 北京: 中国中医科学院, 2008. |
| [2] | 高学敏, 顾慰萍. 中医戒毒辑要 [M]. 北京: 人民卫生出版社, 1997. |
| [3] | 郑保主, 韦克诚, 胡克翠, 等. 中医药脱毒临床和实验研究进展 [J]. 中国药物依赖性杂志, 2012(5): 333-338. |
| [4] | 王 卓. 复方中药安君宁治疗海洛因依赖稽延性戒断症状临床研究 [J]. 中国药物滥用防治杂志, 2013, 19(5): 251-255. |
| [5] | 杜万君, 贾少微, 尹述贵, 等. 君复康胶囊门诊用于海洛因成瘾人员脱毒的临床研究 [J]. 中国药物滥用防治杂志, 2008(3): 147-149. |
| [6] | 王海南. 中药有效成分研究与中药新药研发 [J]. 中华中医药杂志, 2007, 22(5): 268-270. |
| [7] | 鲁春梅, 张春森, 姜立勇. 延胡索化学成分及药理作用研究进展 [J]. 中国现代药物应用, 2011, 5(15): 126-127. |
| [8] | 王殊秀. 延胡索乙素对大鼠慢性神经病理性疼痛镇痛作用及机制的研究 [D]. 兰州: 兰州大学, 2012. |
| [9] | 白威峰. 延胡索及其有效成分抗吗啡成瘾多巴胺系统作用机制研究和效果比较 [D]. 遵义: 遵义医学院, 2014. |
| [10] | 郭 萍. 延胡索与l-THP对大鼠吗啡CPP效应、VTA-NAc-PFC神经环路谷氨酸和NR2B的影响及比较 [D]. 遵义: 遵义医学院, 2012. |
| [11] | 丘宏强. 丹参抗吗啡身体依赖有效成分筛选及有效成分作用机制初步探讨 [D]. 福州: 福建医科大学, 2005. |
| [12] | 蔡 萍. 隐丹参酮抗小鼠吗啡奖赏效应的作用及对小鼠全脑一氧化氮含量的影响 [D]. 福州: 福建医科大学, 2010. |
| [13] | 蔡 萍, 陈少雅, 陈崇宏. 侧脑室注射隐丹参酮单体对吗啡诱导的小鼠条件性位置偏爱效应形成和一氧化氮含量的影响 [J]. 中国药物依赖性杂志, 2010, 19(6): 472-475. |
| [14] | 刘 郁, 刘连新. 人参功效再认识 [J]. 时珍国医国药, 2006, (2): 289. |
| [15] | 黎 阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展 [J]. 中草药, 2009, 40(1): 164-166. |
| [16] | 齐冬梅, 张 超, 刘南萍. 人参皂苷对阿片类药物作用影响的研究进展 [J]. 山东中医药大学学报, 2010(1): 89-91. |
| [17] | 陈海生. 人参皂苷Rg1对吗啡慢性作用的SK-N-SH细胞的影响及机制研究 [D]. 沈阳: 沈阳药科大学, 2009. |
| [18] | 揭荣荣. 人参皂苷Rg1对吗啡依赖海马神经元胞内游离钙离子浓度的影响 [D]. 广州: 南方医科大学, 2009. |
| [19] | 李 鹏. 人参皂苷与药物依赖的相关性研究 [D]. 北京: 北京中医药大学, 2014. |
| [20] | 邱勇波, 刘 锦, 武 飞. 黄芪化学成分及药理作用研究进展 [J]. 中国疗养医学, 2011, 20(5): 435-436. |
| [21] | 黄 迪, 余 涓, 陈崇宏. 黄芪醇提物对小鼠吗啡条件性位置偏爱的影响 [J]. 福建医科大学学报, 2006, 40(4): 353-356. |
| [22] | 黄 迪. 黄芪有效成分抗吗啡诱导的小鼠位置偏爱效应研究 [D]. 福州: 福建医科大学, 2007. |
| [23] | 马 骁. 浅析酸枣仁药理作用研究 [J]. 生物技术世界, 2013(2): 87. |
| [24] | 谭云龙, 孙 晖, 孙文军, 等. 酸枣仁化学成分及其药理作用研究进展 [J]. 时珍国医国药, 2014, 25(1): 186-188. |
| [25] | 余惠敏. 酸枣仁有效成分抗吗啡诱导的小鼠条件性位置偏爱效应研究 [D]. 福州: 福建医科大学, 2009. |
| [26] | 张家俊, 陈文为. 中药酸枣仁、龙齿、石菖蒲对小鼠脑组织单胺类神经递质及代谢物的影响 [J]. 北京中医药大学学报, 1995, 18(6): 64-661. |
| [27] | Park J H, Lee H J, Koh S B, et al. Protection of NMDA-induced neuronal cell damage by methanol extract of zizyphi spinosi semen in cultured rat cerebellar granule cells [J]. J Ethnopharmacol, 2004, 95(1): 39-451. |
| [28] | 曹吉慧, 赵桂森, 冯延江. 青风藤的化学成分与药理作用 [J]. 国外医药: 植物药分册, 2008, 23(2): 62-66. |
| [29] | 黄筑艳, 张援虎, 周 岚. 等. 青风藤化学成分的研究 (II) [J]. 中草药, 2009, 40(2): 193-196. |
| [30] | 班小红, 黄筑艳, 李 焱, 等. 青风藤化学成分的研究 [J]. 时珍国医国药, 2008, 19(8): 1831-1832. |
| [31] | 李 影. 中药青风藤药理作用及临床应用 [J]. 中国医药指南, 2011, 9(16): 321-322. |
| [32] | 王彩云. 青风藤及青藤碱抗吗啡依赖作用的研究 [D]. 广州: 第一军医大学, 2002. |
| [33] | 刘 珍, 郑济芳, 杨露青, 等. 青藤碱对吗啡依赖与戒断小鼠小脑与脊髓NO/nNOS系统的影响 [J]. 生理学报, 2007, 59(3): 285-292. |
| [34] | 刘 珍, 郑济芳, 胡 弼, 等. 青藤碱对吗啡依赖与戒断小鼠脑组织nNOS活性的影响 [J]. 中国应用生理学杂志, 2007, 23(3): 297-299. |
| [35] | 郑济芳, 刘 珍, 朱允华, 等. 青藤碱对吗啡依赖小鼠脊髓与小脑中HO2、sGCα1和sGCα2基因mRNA表达的影响 [J]. 中国药理学通报, 2008, 24(8): 1044-1048. |
| [36] | 王章姐, 孙维矿. 钩藤的化学成分及药理作用研究进展 [J]. 现代企业教育, 2010, 24 (8): 197-198. |
| [37] | 唐省三, 马亚珍, 陈冬娥. 钩藤碱抑制小鼠吗啡戒断症状的探讨 [J]. 军事医学科学院院刊, 2004, 28(1): 97-99. |
| [38] | 蔡水敏. 最新中药药理与临床应用 [M]. 北京: 华夏出版社, 1999. |
| [39] | 开 丽, 王中峰, 肖家思, 等. 钩藤碱对大鼠大脑皮层神经元L-型钙通道的阻滞作用 [J]. 中国药理学与毒理学杂志, 1997, 11(3): 186-187. |
| [40] | 黄燮南, 石京山, 谢笑龙, 等. 钩藤碱和异钩藤碱对Ca2+转运的影响 [J]. 中国药理学通报, 1993, 9(6): 428-430. |
| [41] | 开 丽, 王中峰, 薛春生. 钩藤碱对缺血-再灌注大鼠脑NOS变化的作用 [J]. 中国现代应用药学, 1999, 16(3): 10-12. |
| [42] | 李 娜, 丁伯平, 黄 华, 等. 钩藤碱阻滞钙离子通道的药理作用研究进展 [J]. 现代药物与临床, 2014(9): 1073-1076 |
| [43] | 陈 晋. 氯胺酮成瘾机制及钩藤碱的干预作用 [D]. 广州: 南方医科大学, 2009. |
| [44] | 方正梅, 李晓红, 邵晓霞, 等. 东莨菪碱对吗啡诱发CPP重现大鼠海马p-CREB及c-Fos表达的影响 [J]. 中国医院药学杂志, 2009, 29(14): 1153-1156. |
| [45] | 王黎光, 郭新华, 刘凌云, 等. 东莨菪碱抗吗啡依赖作用与海马细胞内钙的关系 [J]. 中国应用生理学杂志, 2006, 22(3): 307-309. |
| [46] | 李新旺, 徐爱红, 于 斌, 等. 东莨菪碱对吗啡诱导的大鼠行为敏感化的影响 [J]. 心理学报, 2007, 39(2): 299-305. |
| [47] | 陈荣昌, 孙桂波, 张 强, 等. 附子及其复方中药的药理作用研究进展 [J]. 中草药, 2014, 45(6): 883-886. |
| [48] | 吴贵云, 黄文起, 舒海华, 等. 修治附子在吗啡诱导的大鼠条件性位置偏爱上的作用 [J]. 中国病理生理杂志, 2011, 27(5): 911-915. |
| [49] | 于丽秋. 附子汤对吗啡类依赖动物戒断综合征治疗作用机制的探讨 [D]. 济南: 山东中医药大学, 2007. |
| [50] | 徐志立, 孙慧君, 韩国柱, 等. 茶色素对吗啡依赖小鼠和大鼠的戒毒作用 [J]. 中国临床康复, 2006, 10(15): 67-69. |
| [51] | 刘广宣, 徐 峰, 张 莹, 等. 茶色素对吗啡成瘾小鼠脑内去甲肾上腺素、多巴胺、5-羟色胺和β-内啡肽的影响 [J]. 中国医院药学杂志, 2012, 32(2): 127-129. |
| [52] | 王振学, 王 惕, 胡凌歌, 等. 中药茉莉根戒毒效果前期研究 [J]. 中国药物滥用防治杂志, 2002(2): 41-42. |
| [53] | 马洪波, 姜艳霞, 雷钧涛. 茉莉花根提取物对吗啡依赖性小鼠戒断作用的研究 [J]. 时珍国医国药, 2009, 20(5): 1084-1085. |
| [54] | 李一欣, 梁文妹. 海洛因依赖对大鼠中脑腹侧被盖区和伏隔核内DβH和CCK 表达的影响 [J]. 神经解剖学杂志, 2013, 29(2): 199-203. |
| [55] | Camí J, Farré M. Drug addiction [J]. New Engl J Med, 2003, 349: 975-986. |
| [56] | Kelley A E. Ventral striatal control of appetitive motivation: role in ingestive behavior and reward-related learning [J]. Neurosci Biobehav Rev, 2004, 27(8): 765-776. |
| [57] | 谌红献, 郝 伟, 刘铁桥, 等. 安君宁对吗啡依赖大鼠伏隔核内前阿黑皮素原表达的影响 [J]. 中国临床心理学杂志, 2006, 14(2): 212-214. |
| [58] | 谌红献, 郝 伟, 蔡 溢, 等. 安君宁对吗啡依赖大鼠脑内酪胺酸羟化酶和胶质原纤维酸性蛋白表达的影响 [J]. 中国行为医学科学, 2006(5): 423-425. |
| [59] | 王宇华, 陶奕敏, 陈 洁, 等. 济泰片对吗啡损伤小鼠免疫功能的影响 [J]. 中国药物依赖性杂志, 2011, 20(1): 22-25. |
| [60] | 向晓辉, 张宏伟, 刘军翔, 等. 新生戒毒胶囊对海洛因依赖小鼠免疫力影响的实验研究 [J]. 上海中医药杂志, 2006, 40(2): 49-51. |
| [61] | 谌红献, 郝 伟, 刘铁桥, 等. 安君宁对吗啡依赖大鼠脑内前脑啡肽原表达的影响 [J]. 中国行为医学科学, 2005, (12): 1063-1065. |
| [62] | 邵智星, 吴海琴. 脑啡肽研究进展 [J]. 卒中与神经疾病, 2013(1): 56-58. |
| [63] | Alekseenko A V, Kolos V A, Vasim T V, et al. Glutamate induces the formation of free radicals in rat brain synaptosomes [J]. Biofizika, 2009, 54(5): 876-880. |
| [64] | Ibi M, Matsuno K, Matsumoto M, et al. Involvement of NOX1/NADPH oxidase in morphine-induced analgesia and tolerance [J]. J Neurosci, 2011, 31(49): 18094-18103. |
| [65] | Wen Z H, Chang Y C, Cherng C H, et al. Increasing of intrathecal CSF excitatory amino acids concentration following morphine challenge in morphine-tolerance rats [J]. Brain Res, 2004, 995(2): 253-259. |
| [66] | Noda Y, Nabeshima T. Opiate physical dependence and N-methyl-D-aspartate receptors [J]. Eur J Pharmacol, 2004, 500(1/3): 121-128. |
| [67] | Murray, Harrison N J, Grimwood S. Nucleolus accumbens NMDA receptor subunit expression and function is enhanced in mophrine-dependent rats [J]. Eur J Pharmacol, 2007, 562(3): 191-197. |
| [68] | Kone B C, Kuncewicz T, Zhang W, et al. Protein interactions with nitric oxide synthases: controlling the right time, the right place and the right amount of nitric oxide [J]. Am J Physiol, 2003, 285(285): F178-F190. |
| [69] | Huang Y N, Tsai R Y, Lin S L, et al. Amitriptyline attenuates astrocyte activation and morphine tolerance in rats: Role of the PSD-95/NR1/nNOS/PKCy signaling pathway [J]. Behav Brain Res, 2012, 229(2): 401-411. |
| [70] | 马 赛, 马骏雄, 仝 黎, 等. 阿片成瘾机制研究进展 [J]. 中华神经外科疾病研究杂志, 2007, 6(5): 563-564. |
| [71] | 杨琼芳, 张力华, 张晓飞, 等. 华清合剂对海洛因依赖模型大鼠血清一氧化氮的影响 [J]. 医药导报, 2010, 29(17): 844-846. |
| [72] | Ozdemir E, Baqcivan, Gursoy S. Role of D1/D2 dopamin receptors antagonist perphenazine in morphine analgesia and tolerance in rats [J]. Bosnian J Basic Med, 2013, 13(2): 119-25. |
| [73] | Ozdemir E, Gursoy S, Bagcivan I. The effects of serotonin/norepinephrine reuptake inhibitors and serotonin receptor agonist on morphine analgesia and tolerance in rats [J]. J Physiol Sci, 2012, 62(4): 317-323. |
| [74] | Ozdemir E, Baqcivan I, Durmus N. The nitric oxide- cGMP signaling pathway plays a significant role in tolerance to the analgesic effect of morphine [J]. Can J Physiol Pharm, 2011, 89(2): 89-95. |
| [75] | 张 力, 李积胜. 阿片类物质成瘾机制研究进展 [J]. 国际精神病学杂志, 2007(4): 218-221. |
| [76] | 刁秋霞, 李积胜. 阿片依赖相关神经递质研究进展 [J]. 武警医学院学报, 2008, 17(2): 152-154. |
| [77] | 刘建亮, 闫俊红. 阿片依赖及戒断的信号转导机制 [J]. 现代生物医学进展, 2010, 10(13): 2581-2583. |
| [78] | 向仕平, 朱成全. 舒通安胶囊对海洛因依赖者血单胺类递质的影响 [J]. 药物滥用防治杂志, 2006, 12(5): 274-276. |
| [79] | 黄德彬, 余昭芬, 傅 琳. 半夏厚朴汤加味治疗海洛因依赖稽延性戒断症状135例疗效观察 [J]. 中医杂志, 2005, 46(6): 130-132. |
| [80] | 陶继武, 钱玉龙, 王 浩. 番泻叶浸剂在治疗阿片类物质所致便秘的效果 [J]. 中国民康医学, 2007, 19(23): 1058. |
| [81] | 汤真清, 张丽娟, 江海峰, 等. 济泰片与美沙酮治疗社区戒毒人员抑郁症状的疗效比较 [J]. 中国初级卫生保健, 2014, 28(6): 107-109. |
| [82] | 卢玉堂, 徐华中, 周金文. 益安回生口服液对海洛因依赖者稽延性戒断症状的疗效观察 [J]. 中国药物依赖性杂志, 2009, 18(6): 470-473. |
| [83] | 陈中国, 柴景蕊, 蒋利和, 等. 济泰片对阿片类物质觅药行为和复吸的治疗作用 [J]. 中国药物依赖性杂志, 2011, 20(5): 346-349. |
| [84] | 盛小奇, 郝 伟. 玄夏祛毒胶囊合并小剂量丁丙诺啡对海洛因依赖戒断症状的疗效观察 [J]. 中华医学杂志, 2004, 84(23): 62-64. |
 2016, Vol. 47
2016, Vol. 47


