2. 右江民族医学院临床医学院, 广西 百色 533000;
3. 广西中医药大学, 广西 南宁 530001
2. College of Clinical Medicine, Youjiang Medical University for Nationalities, Baise 533000, China;
3. Guangxi University of Traditional Chinese Medicine, Nanning 530001, China
姜黄Curcuma longa L. 为姜科(Zingiberaceae)姜黄属Curcuma L. 植物,干燥根茎可入药,主产于中国、印度、日本等国家,是常用的传统中药。姜黄素(curcumin)则是从姜科植物姜黄属姜黄、莪术、郁金等根茎中提取得到的一种天然黄色色素,为小分子植物酸性多酚,其分子式为C21H20O6,相对分子质量368.37,化学结构见图 1。姜黄素是咖哩、芥末中的主要黄色色素,是姜黄的主要药效成分,流行病学调查显示,印度的阿尔茨海默病(Alzheimer’s disease,AD)患病率偏低,仅是美国的四分之一,印度人的饮食中经常用咖喱作为调料剂,其中提取到的有效成分就是姜黄素,从而学者们开展了一系列姜黄素与AD发病机制相关性的科学研究[1]。研究发现,姜黄素不仅可以有效抑制AD,还有抗肿瘤、抗菌、抗氧化、抗炎、抗呕吐、抗纤维化、抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)、保护神经系统等作用,其药理药效十分广泛[2]。近年来,PubMed数据库上收录的有关姜黄素药用价值的文献数量也迅速增多,姜黄素成为医疗保健领域新的研究热点之一,具有广阔的开发与应用前景,其作为治疗多种神经系统疾病潜力药物的研究也在越来越多地受到人们的关注。
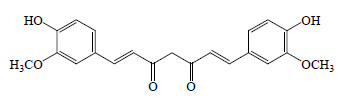 | 图 1 姜黄素化学结构Fig.1 Structure of curcumin |
AD是一种病因未明、起病隐匿的以进行性和不可逆性记忆损害及认知功能障碍为主的中枢神经系统退行性疾病,临床上以全面性痴呆表现为特征,也称为老年性痴呆病。AD主要是由大脑特异区域β淀粉样蛋白(amyloidβ-protein,Aβ)蓄积引起。而姜黄素具有很强的亲脂性,可以透过血脑屏障,其酮-烯醇结构易与Aβ聚合物结合[3],降低脑中老年斑(senile plaques,SP)的体积及Aβ42的量,体外实验也显示,姜黄素能抑制Aβ42的合成并破坏其稳定性,起到抑制Aβ脑内聚集的作用[4]。Aβ是由β淀粉样蛋白前体蛋白(amyloid precursorprotein,APP)在β或其他分泌酶的切割作用下产生并聚集形成的,姜黄素可以通过降低β位切割酶的过度表达来抑制Aβ形成[5]。研究表明,姜黄素还能够改进AD患者巨噬细胞对Aβ肽吞噬作用的缺陷[6],从而有效抑制Aβ水平的升高,减少脑内SP沉积,但这仍需大样本深入研究来证实。另外,AD与胰岛素信号调控密切相关,利用APP/PS1双转基因小鼠检测海马胰岛素受体(insulin receptor,InR)、胰岛素样生长因子受体(insulin-likegrowth factor receptor,IGF1R)的表达水平,显示出姜黄素可改善和调节胰岛素信号转导通路从而发挥治疗作用[7, 8]。
9月龄AD模型APPswe/PS1dE9双转基因小鼠ig大剂量姜黄素后,观察海马CA1区神经元及突触的变化,与AD模型组相比,突触数量增加,突触小泡聚集减少,排列整齐,病理变化大幅改善,这是姜黄素改善AD小鼠空间学习记忆能力的机制之一[8]。姜黄素还可通过降低海马区星形胶质细胞胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达和抑制星形胶质细胞的活性,来改善Aβ1-40诱导的AD大鼠空间学习记忆障碍[10]。已有临床研究表明,应用非甾体消炎药(nonsteroidal antiinflammatory drugs,NSAIDs)能降低AD的发病风险[11],但长期应用副作用极大。体外实验证实,姜黄素能抑制12-十四酸佛波酯-13-乙酸盐(phorbol- 12-myristate-13-acetate,PMA)诱导的炎性小鼠纤维细胞脂质过氧化酶和环氧合酶活性[12],从而抑制白细胞介素-1β(IL-1β)、IL-8和肿瘤坏死因子-α(TNF-α)等的产生,并能抑制脂氧合酶和磷脂酶活性[13],且即使姜黄素大剂量应用,其对小鼠的其他生理功能影响也很小[14]。
2 姜黄素对脑血管病及血管性痴呆发病机制的影响姜黄素有很强的抗炎作用,可减少炎症细胞因子如IL-2、IL-6、TNF-α等的产生,有效降低血肿周围脑组织细胞间黏附分子-1(intercellular cell adhesionmolecule-1,ICAM-1)的表达[15]。在小鼠脑出血后6 h应用姜黄素,72 h后血肿较对照组有明显瓦解现象,这与姜黄素显著减少促炎分子的产生和释放有关[16],同时,姜黄素也减轻了血管源性脑水肿,起到了神经保护作用,其机制可能与抑制基质金属蛋白酶(matrix metalloproteinase,MMP)的活性有关[17]。
脑缺血时,核转录因子-κB(nucleartranscription factor-κB,NF-κB)可激活导致内皮素、细胞因子等损伤缺血的神经细胞[18],经姜黄素预处理的大鼠,可使过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)表达上调,抑制NF-κB激活,减轻炎症反应而改善神经功能[19],与此同时,姜黄素抑制炎症因子如IL-1β、TNF-α、前列腺素E2(PGE2)、NO、环氧合酶-2(COX-2)等的表达,可减弱NF-κB抑制蛋白(inhibitor-κ binding protein,I-κB)的降解,阻抑NF-κB激活,说明抗炎是姜黄素保护脑缺血后神经组织的重要机制。线粒体转录因子A(mitochondrialtranscription factor A,TFAM)是一种维持线粒体DNA复制量的核蛋白,可反映线粒体生物合成功能[20],解偶联蛋白2(uncouplingprotein 2,UCP2)是跨线粒体内膜质子通道转运蛋白,具有抑制活性氧生成、降低电势差、限制Ca2+超载、抑制细胞凋亡等作用[21]。在大脑局灶性缺血-再灌注损伤实验中,缺血前用姜黄素预处理,神经元丢失及线粒体损伤有所减轻,皮质梗死区线粒体UCP2和TFAM表达增加,说明姜黄素可以呈剂量依赖性地调控线粒体生物合成[22]。另外,姜黄素还可降低脑组织NO和损伤标志蛋白S100B的表达水平[23],上调脑源性神经营养因子(brain derived neurotrophic factor,BDNF)及其受体的mRNA与蛋白表达[24],从而保护脑神经。
血管性痴呆(vascular dementia,VD)是由脑血管因素导致脑组织损害而引起的一类痴呆综合征。已有实验研究,通过结扎左、右两侧颈总动脉的方法复制大鼠脑缺血VD模型,采用Morris水迷宫法观察,发现姜黄素对VD大鼠学习记忆功能有良好的改善作用,这与姜黄素可清除脑组织氧自由基、拮抗脑缺血引起的超氧化物歧化酶(superoxide dismutase,SOD)活性下降及丙二醛(malondial- dehyde,MDA)水平升高、降低全血黏度和血沉、改善血液流变学等作用有关[25]。对VD模型大鼠海马神经元凋亡及Bcl-2和Bax蛋白表达的影响做进一步研究,发现姜黄素还能够抑制脑缺血坏死区神经细胞凋亡及凋亡相关蛋白表达,减少海马神经元因缺血缺氧导致的破坏丢失,以改善认知功能[26]。
3 姜黄素对帕金森病发病机制的影响帕金森病(Parkinson’s disease,PD)是一种中老年人常见的神经系统变性疾病,其病理改变为中脑黑质多巴胺(dopamine,DA)能神经元的变性及选择性大量丢失,DA能神经递质量相对不足,残留神经元的胞浆中有Lewy小体出现。由于DA量不足,导致乙酰胆碱(acetylcholine,Ach)递质功能处于相对优势,从而引起肌肉运动功能障碍、静止性震颤麻痹、肌强直等病变特征。大量临床及实验证据显示,氧化应激、兴奋性氨基酸毒性作用、免疫炎症反应、脑源性或胶质源性神经营养因子表达减少、Ca2+超载等病变机制相互作用与PD的发生发展密切相关。神经胶质细胞-神经元网络失衡,例如通过DA受体调节星形胶质细胞神经营养因子的释放以及炎症反应的发生,在DA能神经元选择性、进行性变性病变中起着重要的作用[27]。在老龄动物和6-羟基多巴胺(6-hydroxydopamine,6-OHDA)复制的PD模型中,黑质神经生长因子(nerve growth factor,NGF)前体分子(proNGF)及其受体(p75NTR)、神经死亡因子sortilin mRNA等表达上调,大量星形胶质细胞和小胶质细胞活化[28]。
姜黄素可逆转6-OHDA及细胞内高铁水平造成的活性氧族(reactive oxygen species,ROS)产生增加,从而减轻氧化应激和高铁水平对细胞造成的损伤[29]。另有实验研究显示,姜黄素可降低1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)神经毒质介导的GFAP释放,抑制PD发病中星形胶质细胞增生,减少胶质瘢痕形成。并通过抑制NF-κB核转位,降低脑内炎症因子的表达,改善由中脑注射脂多糖(lipopolysaccharides,LPS)引起的PD样病变导致的小鼠运动障碍[30]。体外细胞培养研究显示,利用1-甲基-4苯基吡啶离子(MPP+)诱导人神经母细胞瘤细胞(SH-SY5Y)作为实验模型,发现经姜黄素处理后可抑制c-Jun的氮末端激酶(JNK)信号通路,保护神经元[31]。
4 姜黄素对癫痫发病机制的影响癫痫是一种常见的发作性神经系统疾病,神经元异常同步化放电,引起突然、短暂、反复出现的脑功能失调,同时癫痫患者和实验动物还可表现为伴有记忆力及认知功能下降。其病因和发病机制较复杂,目前治疗手段有限。
癫痫持续状态(status epilepticus,SE)是指一次癫痫发作持续30 min以上,或连续多次发作且发作间期意识不清醒的状态。药理学研究显示,姜黄素抗痫与其抗氧化、清除自由基、神经保护及影响即早反应基因表达有关[32]。实验证实,姜黄素可通过减轻海马氧化应激反应,抑制神经细胞凋亡,减轻SE发作,从而改善癫痫所致大鼠认知功能障碍。姜黄素及其代谢产物均具有抗氧化活性,可以抑制内质网InsP3受体介导的钙释放,增加内质网钙摄取和贮备,抑制海马内质网应激及其相关基因153(DADD153)的表达,抑制c-Jun氨基端激酶/活化蛋白-1(JNK/Ap-1)途径激活,以保护海马神经元[33]。近期文献报道,姜黄素可以缓解海人酸诱发的癫痫症状,改善实验性癫痫大鼠的行为学变化,可使大鼠反复发作的阵挛抽搐滞后,行为变温和[34]。姜黄素还可以通过上调大鼠海马神经元bcl-2基因、下调bax基因表达,从而抑制神经元凋亡[35]。
S100B蛋白是一种酸性钙离子结合蛋白,主要分布在中枢神经系统星形胶质细胞内,该蛋白增多是提示早期脑损伤可靠的生化指标[36],姜黄素治疗则可降低匹罗卡品致痫大鼠海马神经元S100B蛋白表达,通过抑制星形胶质细胞活化以减轻痫性发作导致的脑损伤[37]。外伤性致痫(posttraumatic epilepsy,PTE)是颅脑损伤后的常见并发症,近年研究显示,哺乳动物雷帕霉素靶蛋白复合物1(mammaliantarget of rapamycin,mTOR complex 1,mTORC1)介导的信号通路异常激活与PTE关系密切,在脑外伤及PTE动物模型中mTORC1磷酸化激活,再通过磷酸化下游多种效应分子参与癫痫的发生发展,而抑制mTORC1激活则具有抗癫痫的作用[38]。利用FeCl3皮层注射诱导大鼠痫性发作,可模拟PTE的发生机制,即外伤致颅内出血,红细胞破裂,Fe3+沉积导致癫痫发生[39]。姜黄素可显著降低PTE大鼠发作频率和等级,抑制皮质异常放电,减少病灶神经元变性坏死,体外实验证实,姜黄素可以抑制mTORC1信号转导通路,以保护PTE大鼠神经组织[40]。
5 姜黄素对抑郁症发病机制的影响抑郁症是由多种原因引起的以心境低落、情感性障碍为主要特征的神经疾病,常伴有睡眠异常和食欲减退等躯体症状,随着生活节奏的加快,生活和工作压力的增大,抑郁症已成为目前又一影响人类健康的常见病与多发病,发病率逐渐上升。其发病机制多样复杂,且抑郁症常表现为其他躯体慢性疾病的伴发症状,神经递质如5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)、DA等合成及分布异常、下丘脑-垂体-肾上腺轴(hypothamo-pituitary-adrenocorticalaxis,HPA)分泌紊乱、炎症介质释放和递质信息传递通路异常、海马神经元损伤等均可能参与了疾病的发生发展过程,针对这些发病机制现已研发出各类化学合成的抗抑郁药,虽具有一定临床疗效,但大多数存在抗抑郁谱窄、副作用大和易复发等缺点。
慢性温和不可预知应激模型是一种经典抑郁症动物模型,其理论依据与人类抑郁症中慢性、低水平的应激源导致抑郁症的发生并加速抑郁症发展的机制更为接近[41]。在慢性不可预见性应激刺激导致大鼠抑郁障碍疾病模型中,姜黄素能缩短大鼠强迫游泳不动时间,提高糖水偏嗜度,明显逆转慢性应激导致的大鼠兴奋性和探索性降低,提高慢性应激大鼠海马5-HT的量,降低糖皮质激素水平,恢复海马对HPA轴的抑制作用,保护海马神经元[42]。姜黄素还可拮抗慢性应激所导致的皮质醇水平升高,防止其下游信息通路的过度激活[43]。姜黄素在逆转皮质酮诱导的大鼠抑郁样行为中,其抗抑郁作用还可能与增加海马和前额皮质BDNF表达、激活BDNF- Akt-bcl2途径,抑制神经元受损有关[44]。
6 姜黄素对神经病理性疼痛发病机制的影响神经病理性疼痛(neuropathic pain,NPP)是由神经系统原发性损害和功能障碍所引起的慢性疼痛。病因主要有病毒感染、神经系统损伤、代谢或营养性疾病等,疼痛表现为自发性、痛觉过敏、异常疼痛等。动物实验研究发现,姜黄素可减轻大鼠坐骨神经慢性压迫性损伤(chronic constriction injury,CCI)的热痛觉过敏和机械性疼痛,可下调脊髓背角和背根神经节趋化因子受体的表达,减轻大鼠CCI所导致的NPP[45]。
糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)是糖尿病一种常见的慢性并发症,其特点是自发痛、痛觉超敏等。实验研究证实,姜黄素可以对DNP产生影响,即脊髓背角TNF-α水平下降,且与痛阈值升高时间一致,为提高姜黄素生物利用度,制备姜黄素自组装纳米乳药物转运系统(self nano emulsifying drug delivery system,SNEDDS),有更好的神经保护作用[46]。姜黄素减轻2型糖尿病大鼠DNP的机制可能为通过抑制脊髓和背根神经节激活子蛋白-1(activator protein 1,AP-1)与NF-κB核转位,抑制炎症因子释放,使单核细胞趋化蛋白-1(monocytechemotactic protein-1,MCP-1)释放减少,从而降低JNK/MCP-1信号通路转导功能[47]。
7 姜黄素对神经系统肿瘤发病机制的影响神经母细胞瘤(neuroblastoma)为内分泌性肿瘤,起源于交感神经系任意神经脊部位,预后较差,5年存活率只有25%~35%。研究发现姜黄素对神经母细胞瘤癌细胞的产生、增殖、转移均有抑制作用,可使癌细胞数目明显减少[48]。姜黄素通过调控癌基因、抑癌基因及其蛋白表达,通过抑制NF-κB激活等阻止肿瘤细胞的侵袭与转移,并调控细胞凋亡等信号途径,诱导肿瘤细胞凋亡,降低SH-SY5Y神经母细胞瘤增殖[49],随着姜黄素浓度增加,瘤细胞的侵袭力逐渐下降,可以减少神经母细胞瘤转移及复发[50]。
脑胶质瘤也是中枢神经系统较常见、预后较差的原发性恶性肿瘤,占颅内肿瘤50%~60%,目前临床化疗药物副作用较大,而中药因其相对安全和作用持久被广泛关注。MMP广泛参与瘤细胞的侵袭和转移过程,发挥着关键性的作用,体外应用姜黄素能够抑制人脑胶质瘤U251、U87细胞的迁移和侵袭,可能机制为抑制了肿瘤细胞内MMP-2、MMP-9的表达[51, 52],促进caspase家族激活,诱导细胞凋亡。Hedgehog(Hh)信号通路与癌细胞的产生和侵袭转移能力密切相关[53],姜黄素可以通过下调Hh信号通路中的重要成分(Shh、Smo、GLI1)mRNA及蛋白表达水平,抑制GLI1转移入细胞核,同时减少其受体积聚,抑制胶质瘤细胞增生,且具有时间和浓度依赖性[54]。因此,有望对姜黄素做进一步研发以期能进入临床应用。
8 结语姜黄素还可改善脊髓损伤脱髓鞘病变、糖尿病周围神经病变和小胶质细胞炎症反应,诱导脑缺血或脊髓损伤后神经干细胞的增殖与迁移,促进神经组织功能修复等。姜黄素是否还可通过其他信号网络或生物分子对上述疾病产生影响,仍需更多的实验研究进行深入探讨;提高其生物利用度、先进制剂技术与新剂型的研发也将成为研究热点。总之,姜黄素以其疗效显著、副作用小等特点具有广阔的临床应用前景。
| [1] | Pham T X, Lee J. Dietaiy regulation of histone acetylases and deacetylases for the prevention of metabolic diseases [J]. Nutrients, 2012, 4(12): 1868-1886. |
| [2] | 罗廷顺, 李洪文, 刘正文, 等. 姜黄素的提取分离与药理作用研究进展 [J]. 现代药物与临床, 2011, 26(2): 102-107. |
| [3] | Yanagisawa D, Shirai N, Amatsubo T, et al. Relationship between the tautomeric structures of curcumin derivatives and their Abeta-binding activities in the context of therapies for Alzheimer's disease [J]. Biomaterials, 2010, 31(14): 4179-85. |
| [4] | Rivière C, Richard T, Quentin L, et al. Inhibitory activity of stilbenes on Alzheimer's beta-amyloid fibrils in vitro [J]. Bioorg Med Chem, 2007, 15(2): 1160-1167. |
| [5] | Lin R Z, Chen X H, Li W M, et al. Exposure to metalions regulates mRNA levels of APP and BACE1 in PC12 cells: blockage by curcumin [J]. Neurosci Lett, 2008, 440(3): 344-347. |
| [6] | Fiala M, Mahanian M, Rosenthal M, et al. MGAT3 mRNA: a biomarker for prognosis and therapy of Alzheimer's disease by vitamin D and curcuminoids [J]. J Alzheimers Dis, 2011, 25(1): 135-144. |
| [7] | 陈晓培, 王 虹, 李瑞晟, 等. 姜黄素对阿尔茨海默病小鼠海马InR和IGF1R表达的影响 [J]. 中国实验动物学报, 2013, 21(1): 27-31. |
| [8] | Lee M S, Wahlqvist M L, Chou Y C, et al. Turmeric improves post-prandial working memory in pre-diabetes independent of insulin [J]. Asia Pac J Clin Nutr, 2014, 23(4): 581-591. |
| [9] | 樊 惠, 魏 鹏, 陈晓培, 等. 姜黄素对9月龄AD双转基因小鼠海马超微结构的影响 [J]. 北京中医药大学学报, 2013, 36(9): 608-611. |
| [10] | 孟凡超, 王运良, 尹红蕾, 等. 姜黄素对Aβ诱导的老年痴呆大鼠海马胶质纤维酸蛋白表达的影响 [J]. 中国老年学杂志, 2012, 32(10): 2119-2121. |
| [11] | Cote S, Carmichael P H, Verreault R, et al. Nonsteroidal anti-inilammatory drug use and the risk of cognitive impairment and Alzheimer's diseaae [J]. Alzheimers Dement, 2012, 8(3): 219-226. |
| [12] | Yu S Y, Gao R, Zhang L, et al. Curcumin ameliorates ethanol-inducedmemoiy deficits and enhanced brain nitric oxide synthase activity in mice [J]. Prog Neuropsychopharmacol Biol Psychiatry, 2013, 44(4): 210-216. |
| [13] | Zhou H, Beevers C S, Huang S. The targets of curcumin [J]. Curr Drug Targets, 2011, 12(3): 332-347. |
| [14] | Skxzypczak-Jankun E, Jankun J, Al-Senaidy A. Human lipoxygenase: developments in its structure, function, relevance to diseases and challenges in drug development [J]. Curr Med Chem, 2012, 19(30): 5122-5127. |
| [15] | 隋韵声, 田 力, 滕伟禹, 等. 姜黄素对于大鼠脑出血后ICAM-1表达的影响 [J]. 辽宁医学杂志, 2013, 27(2): 55-58. |
| [16] | King M D, McCracken D J, Wade F M, et al. Curcumin attenuates hematoma size and neurological injury following intracerebral hemorrhage in mice [J]. J Neurosurg, 2011, 115(1): 116-123. |
| [17] | Sun Y H, Dai M C, Wang Y T, et al. Neuroprotection and sensorimotor functional improvement by curcumin after intracerebral hemorrhage in mice [J]. Neurotrauma, 2011, 28(12): 2513-2521. |
| [18] | Sánchez E C. Mechanisms of action of hyperbaric oxygenation in stroke: a review [J]. Crit Care Nurs Q, 2013, 36(3): 290-298. |
| [19] | Liu Z J, Liu W, Liu L, et al. Curcumin protects neuron against cerebral ischemia-induced inflammation through improving PPAR-gamma function [J]. Evid Based Complement Alternat Med, 2013, 2013: 470975. |
| [20] | Hokari M, Kuroda S, Kinugawa S, et al. Overexpression of mitochondrial transcription factor A (TFAM) ameliorates delayed neuronal death due to transient forebrain ischemia in mice [J]. Neuropathology, 2010, 30(4): 401-407. |
| [21] | Darvesh A S, Carroll R T, Bishayee A, et al. Curcumin and neurodegenerative diseases: A perspective [J]. Expert Opin Investig Drugs, 2012, 21(8): 1123-1140. |
| [22] | 刘 莉, 谭波涛, 李 昱, 等. 姜黄素对大鼠大脑皮质缺血再灌注损伤的保护作用及其机制研究 [J]. 解放军医学杂志, 2013, 38(3): 190-194. |
| [23] | 赵朝华, 吴树强, 苟兴春, 等. 姜黄素对脑缺血再灌注损伤大鼠脑组织中NO和S100β水平的影响 [J]. 吉林大学学报: 医学版, 2014, 40(5): 925-928. |
| [24] | 李天平, 陈俞先, 徐 珽. 姜黄素对大鼠全脑缺血/再灌注后的保护机制 [J]. 中国老年学杂志, 2014, 34(7): 1884-1886. |
| [25] | 黄新武, 张 红, 李 华, 等. 姜黄素对血管性痴呆大鼠血流变学及自由基的影响 [J]. 中成药, 2012, 34(3): 566-568. |
| [26] | 黄新武, 李国春, 李 华, 等. 姜黄素对血管性痴呆模型大鼠海马神经元凋亡和蛋白表达的影响 [J]. 中医临床研究, 2013, 5(15): 13-15. |
| [27] | 张丽娟, 邵海涛, 王跃秀, 等. 帕金森病研究进展 [J]. 生命科学, 2014, 26(6): 560-570. |
| [28] | Sun X L, Chen B Y, Duan L, et al. The proform of glia cell line-derived neurotrophic factor: a potentially biologically active protein [J]. Mol Neurobiol, 2014, 49(1): 234-250. |
| [29] | Wang J, Du X X, Jiang H, et al. Curcumin attenuates 6-hydroxydopamine-induced cytotoxicity by anti- oxidation and nuclear factor-κB modulation in MES23. 5 cells [J]. Biochem Pharmacol, 2009, 78(2): 178-183. |
| [30] | 郭玉霞, 杨 波, 石 磊, 等. 姜黄素对中脑定位注射脂多糖引起帕金森样病变小鼠的抗炎机制研究 [J]. 医学研究生学报, 2012, 25(6): 582-587. |
| [31] | 于 嵩, 刘玉丽, 王 玥, 等. 姜黄素对MPP+诱导的帕金森氏病体外模型保护机制的研究 [J]. 解剖科学进展, 2013, 19(3): 272-274. |
| [32] | Kiasalari Z, Roghani M, Khalili M, et al. Antiepileptogenic effect of curcumin on kainate-induced model of temporal lobe epilepsy [J]. Pharm Biol, 2013, 51(12): 1572-1578. |
| [33] | 孟 伟, 杨锦青, 鞠培新, 等. 姜黄素对癫痫小鼠海马脑损伤的保护作用 [J]. 解剖科学进展, 2012, 18(4): 323-325. |
| [34] | Ahmad M. Protective effects of curcumin against lithium-pilocarpine induced status epilepticus, cognitive dysfunction and oxidative stress in young rats [J]. Saudi J Biol Sci, 2013, 20(2): 155-162. |
| [35] | 佟凤芝, 曾常茜, 王 娜. 姜黄素对海人酸致痫大鼠神经元凋亡及bcl-2、bax蛋白表达的影响 [J]. 中国中医药科技, 2014, 21(5): 539-541. |
| [36] | Beaudeux J L, Laribi S. S100B protein serum level as a biomarker of minor head injury [J]. Ann Biol Clin (Paris), 2013, 71(6): 71-78. |
| [37] | 林 青, 刘素芝, 张玲玲, 等. 姜黄素对匹罗卡品致痫大鼠海马S100B蛋白表达的影响 [J]. 中华中医药学刊, 2014, 32(12): 2977-2979. |
| [38] | Guo D, Zeng L, Brody D L, et al. Rapamycin attenuates the development of posttraumatic epilepsy in a mouse model of traumatic brain injury [J]. PLoS One, 2013, 8(5): e64078. |
| [39] | 陈敏若, 石全红, 谢延风, 等. 表皮生长因子对铁离子致痫大鼠脑的保护作用 [J]. 第三军医大学学报, 2012, 34(12): 1202-1205. |
| [40] | 陆 波, 谢延风, 石全红, 等. 姜黄素通过抑制外伤性癫痫鼠脑组织中mTORC1的表达发挥抗癫痫效应 [J]. 第三军医大学学报, 2015, 37(5): 414-419. |
| [41] | 李金兵, 李翼鹏, 田俊生, 等. 基于慢性温和不可预知应激模型内源性代谢物变化探讨抑郁症病理机制 [J].中草药, 2013, 44(1): 108-115. |
| [42] | 安改红, 陈学伟, 王 静, 等. 姜黄素预处理对慢性心理应激大鼠中枢神经的保护作用 [J]. 解放军预防医学杂志, 2013, 31(1): 16-19. |
| [43] | Bhatia N, Jaggi A S, Singh N, et al. Adaptogenic potential of curcumin in experimental chronic stress and chronic unpredictable stress-induced memory deficits and alterations in functional homeostasis [J]. J Nat Med, 2011, 65(3/4): 532-543. |
| [44] | Huang Z, Zhong X M, Li Z Y, et al. Curcumin reverses corticosterone-induced depressive-like behavior and decrease in brain BDNF levels in rats [J]. Neurosci Lett, 2011, 493(3): 145-148. |
| [45] | 郑晋伟, 郑昌健, 曹 红, 等. 姜黄素下调神经病理性疼痛大鼠脊髓背角和背根节CX3CR1的表达 [J]. 中国中药杂志, 2011, 36(18): 2552-2556. |
| [46] | Joshi R P, Negi G, Kumar A, et al. SNEDDS curcumin formulation leads to enhanced protection from pain and functional deficits associated with diabetic neuropathy: An insight into its mechanism for neuroprotection [J]. Nanomedicine, 2013, 9(6): 776-785. |
| [47] | 郑昌健, 胡 涵, 曹 红, 等. JNK/MCP-1信号通路在姜黄素抗糖尿病神经病理性疼痛中的作用 [J]. 中国病理生理杂志, 2014, 30(11): 1941-1945. |
| [48] | Kim T H, Jiang H H, Youn Y S, et al. Preparation and characterization of water-soluble albumin-bound curcumin nanoparticles with improved antitumor activity [J]. Int J Pharm, 2011, 403(1/2): 285-291. |
| [49] | Mulik R S, Mönkkönen J, Juvonen R O, et al. ApoE3 mediated polymeric nanoparticles containing curcumin: apoptosis induced in vitro anticancer activity against neuroblastoma cells [J]. Int J Pharm, 2012, 437(1/2): 29-41. |
| [50] | Nautiyal J, Banerjee S, Kanwar S S, et al. Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells [J]. Int J Cancer, 2011, 128(4): 951-961. |
| [51] | 蒋杞英, 王科文, 文曙光. 姜黄素对人脑胶质瘤U251细胞侵袭与迁移的抑制作用 [J]. 中国药学杂志, 2014, 49(21): 1908-1912. |
| [52] | 曹一波, 于 君, 马 晶, 等. 姜黄素对胶质瘤U87细胞增殖和迁移能力的影响 [J]. 解放军医药杂志, 2014, 26(5): 19-21. |
| [53] | Xu X, Zhou Y, Xie C, et al. Genome-wide screening reveals an EMT molecular network mediated by Sonic hedgehog-Gli1 signaling in pancreatic cancer cells [J]. PLoS One, 2012, 7(8): e43119. |
| [54] | 窦志金, 杜文众, 刘 幸, 等. 姜黄素通过Hedgehog信号通路抑制胶质瘤细胞增殖 [J]. 中国微侵袭神经外科杂志, 2014, 19(5): 228-231. |
 2016, Vol. 47
2016, Vol. 47


