2. 山西大学生物技术研究所, 山西 太原 030006
2. Institute of Biotechnology, Shanxi University, Taiyuan 030006, China
红景天是景天科(Crassulaceae)红景天属Rhodiola L. 的多年生草本或灌木植物,大多数生长在海拔3 500~5 000 m的高山流石或丛林下[1]。红景天属植物在全球96种,我国有70余种,主要布于我国西南、东北、西北及华北等高寒山区[2]。现代药理学研究表明,红景天具有增强运动耐力、抗氧化、抗糖尿病、抗肺炎及哮喘、抗癌等生理活性[3, 4],被广泛应用于医药、保健品、化妆品等产业。由于其需求量越来越大,野生资源面临巨大压力,导致红景天属植物物种的生态破坏、遗传多样性正逐步丧失,深入研究并获得这一濒危物种的遗传信息,对于更好地深度开发和利用这一植物具有重要意义。
DNA分子标记能够揭示物种核苷酸序列水平的遗传变异差异,具有可靠、精确、多态性高等诸多优势,在药用植物的鉴别、监管、多样性分析等中成为当前主要技术手段[5],而RAPD和ISSR则是目前2种比较简便且可靠的研究方法[6]。目前,对于红景天遗传多样性的分析主要只采用一种分子标记,将2种分子标记结合起来对红景天遗传多样性进行分析尚未见报道。本实验则采用RAPD和ISSR 2种分子标记对不同地区的长白红景天、大花红景天、柴胡红景天、库页红景天进行遗传多样性和亲缘关系分析,旨在为物种保护、改良、鉴定、监管等工作提供数据基础。
1 材料与试剂 1.1 材料材料于2012年5~9月采自西藏、吉林长白山地区的不同地点,其详细的种名、编号、采集地见表 1,所有试验材料均由山西大学崔晋龙博士鉴定为长白红景天Rhodiola angusta Nakai、大花红景天R. crenulata (HK. f. et.Thoms) H. Ohba、柴胡红景天R. bupleuroides (Wall. ex Hook. f. et Thoms.) S. H. Fu、库页红景天R. sachalinensis A. Bor。
| 表 1 供试材料的种名及采集地 Table 1 Species and habitats of investigated plants in Rhodiola L. |
Eppendorf 5424R冷冻离心机,德国Eppendorf公司;BIO-RAD C1000TM Thermal Cycler PCR扩增仪、BIO-RAD 164-5050稳压稳流电泳仪、Gel DocTMXR+ With Image LabTM software,美国Bio-rad公司。
2×EasyTaq PCR SuperMix、100 bp DNA Ladder,北京全式金生物技术有限公司;RAPD随机引物、ISSR引物,上海生工生物工程公司合成。
2 方法 2.1 DNA的提取及检测红景天总DNA的提取主要采用改良的CTAB法[7],用1%的琼脂糖凝胶电泳检测DNA的浓度及纯度,然后将样品DNA置于−20 ℃的冰箱中保存,备用。
2.2 引物的筛选参考文献报道[2, 8],分别选取RAPD、ISSR引物各12条,用1个DNA样品进行20 μL体系的PCR扩增,分别对12条RAPD、ISSR引物进行筛选,选取条带清晰、扩增稳定的引物。
2.3 PCR扩增及检测 2.3.1 RAPD-PCR反应体系2×EasyTaq PCR SuperMix 7 μL(2 mmol/L Mg2+);引物2 μL(10 mmol/L);DNA模板2 μL;ddH2O补足至20 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,37 ℃退火1 min,72 ℃延伸1.5 min,40个循环;72 ℃延伸7 min,4 ℃保存。
2.3.2 ISSR-PCR反应体系2×EasyTaq PCR SuperMix 6 μL(2 mmol/L Mg2+);引物2 μL(10 mmol/L);DNA模板1 μL;ddH2O补足至20 μL。PCR扩增程序:94 ℃预变性4 min;94 ℃变性1 min,退火1 min(退火温度根据各个引物的最适退火温度),72 ℃延伸1 min,40个循环;72 ℃延伸7 min,4 ℃保存。
2.3.3 电泳检测将扩增后的PCR产物用1.5%的琼脂糖凝胶电泳检测,上样量为5 μL,电压120 V,电泳50 min,凝胶成像系统照相,保存。
2.4 数据统计及分析对17份样品的电泳条带数进行统计,以100 bp DNA Maker为标准,根据在相同迁移位置有无扩增条带计数,将电泳图谱上清晰且稳定的条带赋值为“1”,无条带或弱带的赋值为“0”,形成0/1矩阵。用软件POPGEN32计算等位基因数(Na)、有效等位基因数(Ne)、基因多样性指数(H)、Shannon多样性指数(I)等;用NTSYS-pc2.10e软件采用UPGMA方法进行聚类分析,构建聚类图。
3 结果与分析 3.1 RAPD扩增产物的多态性分析根据引物筛选结果筛选出扩增条带清晰、重复性高的RAPD引物11条。11条RAPD引物共扩增出96条条带,多态性条带87条,多态性百分比为90.62%。每条引物平均扩增8.73条带,由此可以看出不同的引物表现出不均匀的多样性,其中引物R7、R11的扩增结果见图 1。
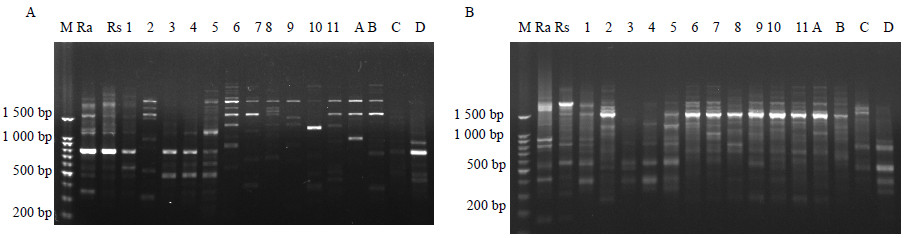 |
Ra-长白红景天 Rs-库页红景天 1~11为大花红景天 A~D为柴胡红景天 M-Marker,图 2同 Ra and Rs refer to R. angusta and R. sachalinensis 1—11 refer to R. crenulata A—D refer to R. bupleuroides, Fig. 2 is same 图 1 RAPD引物R7 (A) 和R11 (B) 的扩增电泳图 Fig.1 Amplification electrophorogram of RAPD Primers R7 (A) and R11 (B) |
根据引物筛选结果筛选出扩增条带清晰、重复性高的ISSR引物11条。11条ISSR引物共扩增出102条条带,多态性条带102条,多态性百分比为100%。每条引物平均扩增9.23条带,其中引物I8扩增的条带数最多为12条,引物I7扩增的条带数最少为8条,引物I7、I8的扩增结果见图 2。
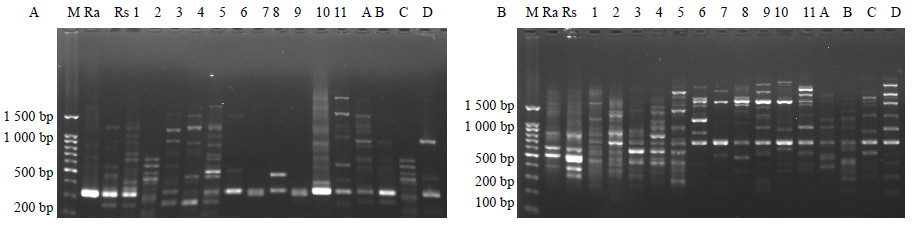 | 图 2 ISSR引物I7 (A) 和I8 (B) 的扩增电泳图 Fig.2 Amplification electrophorogram of ISSR Primers I7 (A) and I8 (B) |
基于RAPD、ISSR 2种分子标记得到的0/1矩阵,通过PopGene 32软件,假定Hardy-Weinerg平衡得到一系列的遗传多样性参数,具体数据见表 2。结果显示,采用ISSR分子标记得出的多态性条带百分比、I、Ne、H值均高于RAPD分子标记所得到的,在一定程度上表明样品数相同、引物数相同时,ISSR检测遗传多样性的能力较高。
| 表 2 RAPD、ISSR分子标记分析4种野生红景天遗传多样性的结果比较 (x±s) Table 2 Comparison on genetic diversity of four wild plants in Rhodiola L. using RAPD and ISSR molecular markers (x±s) |
同样采用PopGene 32软件也可以计算出4种野生红景天的总基因多样性(Ht)、遗传分化系数(Gst)、种群内的基因多样性(Hs)、种间基因流(Nm),结果见表 3。由表 3可见,采用RAPD、ISSR分析得到的4种野生红景天的遗传变异结果没有太大的区别,其Gst分别为0.641 1、0.647 0,即4种野生红景天的遗传变异约64%存在于种间,36%的遗传变异存在于种内,由此可以得出4种野生红景天的遗传变异是以种间遗传变异为主。Nm在0.272 7~0.279 9<1,说明种间产生了明显的遗传分化。
| 表 3 基于RAPD、ISSR分析4种野生红景天遗传变异 Table 3 Analysis on genetic variation for four kinds of wild plants in Rhodiola L. by RAPD and ISSR molecular markers |
根据RAPD的扩增结果得出0/1矩阵,经过NTSYS2.10软件计算得出17个红景天样品间的遗传相似系数范围为0.458 3~0.906 3,其中样品5、6的Gst值最大,为0.906 3,说明这2个样品间的亲缘关系最近;样品1~11的Gst值最小,为0.458 3,说明这2个样品间的遗传距离最远。在平均值0.625 0处,可将所有样品分为4大类,见图 3-A。第I类包括长白红景天与库页红景天,采集地均是吉林长白山;第II大类是从米拉山口及财神湖采集的大花红景天;第III大类包括2种红景天,8~13号样品为不同采集地的大花红景天,15号样品为采自加兴乡的柴胡红景天;第IV大类均为柴胡红景天,分别采自财神湖、米拉山口及日多乡。基于ISSR分子标记得到17个红景天样品间的遗传相似系数(SM)0.392 1~0.843 1,平均值为0.618 1,其中样品1~2的Gst值最大,为0.843 0;样品1~4的Gst值最小,为0.392 1。在遗传系数0.578 0处,可将所有样品分为3类,见图 3-B。第I、II大类的分类与RAPD的分类结果相同;第III大类则包括大花红景天与柴胡红景天2种,采自西藏的不同区域。
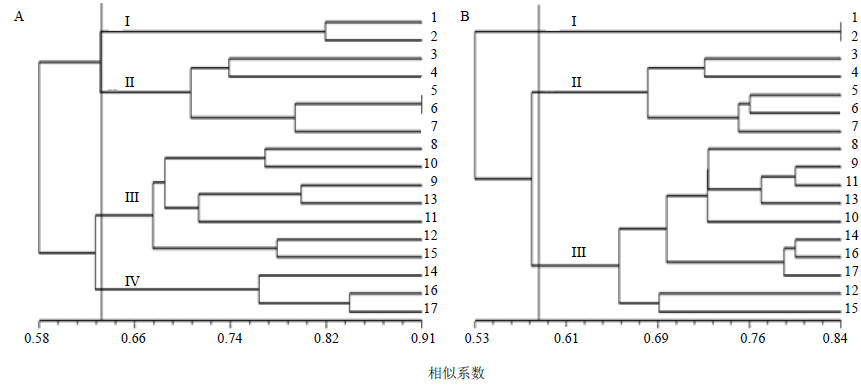 | 图 3 17份红景天的RAPD (A) 和ISSR (B) 标记聚类图 Fig.3 Dendrograms of cluster for 17 samples of Rhodiola L. based on RAPD (A) and ISSR (B) molecular markers |
将RAPD、ISSR分析的0/1矩阵结合进行聚类分析构建聚类图,样品间的Gst值在0.484 8~0.833 3,平均值0.622 4,以遗传系数0.590 0为阈值可将17份红景天样品分成3类,见图 4。从图 4可以看出,将2种分子标记结合起来后的聚类结果与ISSR的聚类图非常相似,均将所有样品分为3类,且每大类中所包含的样品是相同的,只是第III大类中各亚支所包含的样品不同。
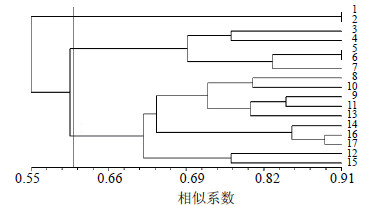 | 图 4 17份红景天的RAPD+ISSR标记聚类图 Fig.4 Dendrogram of cluster for 17 samples of Rhodiola L. based on RAPD + ISSR molecular markers |
本研究分别采用11条RAPD引物和ISSR引物对不同地区的17份野生红景天进行遗传距离及遗传多样性的分析,RAPD、ISSR 2种分子标记得到的多态性百分比分别为90.62%和100%,反映出供试的4个物种种间、种内存在较高的遗传多样性。每种分子标记技术都能从不同层次反映供试样品的遗传多样性,但均存在一些局限性[9],故联合2种或多种标记则能更全面、客观地分析其遗传特征。RAPD技术是以单一随机寡核苷酸序列为引物进行PCR非定点扩增,特点是简单易操作,但对反应条件敏感、重复性差,且RAPD为显性遗传,多态性信息量较低;而ISSR是利用植物基因组中常出现的SSR本身设计引物,对SSR之间的DNA序列进行PCR扩增,标记引物较长、退火温度较高,使其具有较强的可重复性,比RAPD提供更多的遗传信息[10]。因此,在植物的遗传作图、基因定位、遗传多样性、进化、系统发育等研究中ISSR和2种方法联合应用较RAPD有更多的优势。从本研究结果来看,在样品数比较小的情况下3种方式的聚类均能将不同种或不同来源的样品区分开,结果相差不大,但若以相同的遗传相似系数为阈值进行分类,则ISSR、ISSR+RAPD的聚类更加全面。
3种方式的聚类均能将不同种或不同来源的样品区分开,从聚类结果看供试的17份红景天样品中,显然1~7号及12号、15号样品的聚类与其地理来源成一定的相关性。12号大花红景天与15号柴胡红景天聚为一类,反而与同种的其他采集地的红景天相聚较远,原因可能是地理隔离削弱了两地之间植物种群基因交流,从而导致种内出现了较为明显的分化[11]。聚类结果表明长白红景天与库页红景天相近,大花红景天与柴胡红景天相近,而长白红景天、库页红景天与大花红景天、柴胡红景天亲缘关系较远。此聚类结果与根据植物体的叶形、根状茎等形态学分析相似,但有所差异[12]。根据形态学分类柴胡红景天、库页红景天与大花红景天相近,而与长白红景天亲缘关系较远[13]。形成差异的原因一方面可能是与其地理分布和来源有关,另一方面可能与试验中同种材料的样本数有关。
对红景天的遗传多样性进行研究,可以得到红景天种间、种内的遗传变异和遗传分化的分子数据,同时揭示不同地区的同种红景天及同种地区不同红景天间的亲缘关系与地理分布的相关性。红景天属植物生长环境复杂,对环境变化敏感,随着人们对红景天药用价值及化学成分的深入研究,需求量也随之增大,因此对红景天属植物多样性的研究对其物种的保护具有指导意义,同时为红景天资源的合理利用及提供理论依据。
| [1] | Zhao W, Zhao W T, Jiang Z, et al. Genetic diversity and its climate influencing factors of the endangered Rhodiola sachalinensis using molecular markers[J]. Res J Biotechnol, 2014, 9(7): 49-54. |
| [2] | 虞 泓, 朱荣勋, 李永谊, 等. 云南常见药用红景天的RAPD分析[J]. 中草药, 2005, 36(1): 96-99. |
| [3] | Marina M K, Svetlana B G, Andrey A G. Analysis of the genetic structure of Rhodiola rosea (Crassulaceae) using inter-simple sequence repeat (ISSR) polymorphisms[J]. Flora, 2011, 206(8): 691-696. |
| [4] | Zsuzsanna G, Erling F, Márta L, et al. Genetic diversity of roseroot (Rhodiola rosea) in North-Norway[J]. Biochem Syst Ecol, 2013, 50: 361-367. |
| [5] | 王绍先, 王 飞, 刘成柏, 等. DNA 分子标记技术在濒危物种保护中的应用[J]. 生态学杂志, 2008, 27(2): 250-256. |
| [6] | 阳 翠, 刘 萍, 刘姣蓉, 等. 苦豆子ISSR标记的遗传多样性分析[J]. 中草药, 2013, 44(10): 1323-1327. |
| [7] | Zhu T T, Jin L, Du T, et al. Comparison of different methods for extraction of genomic DNA from Ephedra intermedia[J]. Chin J Exp Tradit Med Form, 2012, 40(4): 316-318. |
| [8] | 雷一东. 大花红景天的ISSR遗传多样性与精油化学成分多样性研究[D]. 上海: 复旦大学, 2004. |
| [9] | 齐琳洁, 龙 平, 蒋 超, 等. 黄芩基因组SSR分子标记的开发及遗传多样性分析[J]. 药学学报, 2015, 50(4): 500-505. |
| [10] | 崔占虎, 龙 平, 王颖莉, 等. DNA分子标记技术在中成药鉴定中的应用与展望[J]. 中药材, 2015, 38(1): 190-194. |
| [11] | 王 强, 阮 晓, 李荷迪, 等. 珍稀药用资源植物红景天研究现状、问题与对策[J]. 自然资源学报, 2007, 22(6): 880-888. |
| [12] | 傅书遐. 中国植物志[M]. 北京: 科学出版社, 1984. |
| [13] | 魏晓雨, 田义新, 赵智灵, 等. 不同产地西洋参种质遗传多样性的RAPD和ISSR分析[J]. 中草药, 2014, 45(21): 3153-3158. |
 2016, Vol. 47
2016, Vol. 47


