2. 江西济民可信医药有限公司, 江西 南昌 330096
2. Jiangxi Jiminkexin Pharmaceutical Co., Ltd., Nanchang 330096, China
心绞痛(angina pectoris)属于冠心病中最常见的类型,是冠状动脉供血不足、心肌急剧且暂时的缺血与缺氧所引起的临床综合征[1]。心肌缺血后再灌注过程中会产生大量活性氧自由基(reactive oxygen species,ROS),可导致心肌细胞氧化损伤,是心绞痛后心肌细胞死亡的主要因素之一[2, 3]。H2O2是一种重要的ROS来源,可直接氧化细胞膜上的脂质、蛋白质,并能穿过细胞膜和细胞内的铁离子反应生成·OH等活性更强的自由基,通过多种途径诱导细胞凋亡或坏死,H2O2诱导氧化应激反应是心肌细胞发生凋亡重要原因之一[4]。
心绞痛中医归于“胸痹”“心痛”“厥心痛”等范畴。复方银杏叶颗粒(YXY)是已上市中药品种,主要由银杏叶、红参、刺五加组成,具有益气、活血、通络作用,主要用于气虚血瘀型心绞痛,临床已广泛应用于心绞痛治疗及辅助治疗,取得良好的疗效,但其作用机制并不清楚。
本研究采用H2O2诱导H9c2大鼠心肌细胞氧化损伤,观察YXY对心肌细胞损伤的保护作用及其作用机制,为YXY临床治疗心血管疾病提供进一步的实验资料和数据支持,也为已上市中药品种深度开发及提升科技竞争力奠定基础。
1 材料 1.1 药物与试剂YXY,主要成分为由槲皮素、山柰素、异鼠李素等组成的银杏叶总黄酮,其质量分数在2 mg/g以上;实验用YXY干浸膏为棕黄色粉末,相当于生药6.5 g/g,由江西济民可信药业有限公司提供,批号20140124。用DMSO配制成1 mg/mL储备液,分装后冻存。实验前用培养基稀释至所需质量浓度。
DMEM培养基(Gibco公司);胎牛血清(Hycione公司);胰蛋白酶、碘化丙啶(PI)、噻唑蓝(MTT)、二甲基亚砜(DMSO),均购自Sigma公司;线粒体膜电位检测试剂盒JC-1(北京美科美生物技术开发有限公司);Fluo-4 AM荧光探针、DCFH-DA探针,均购自同仁化学研究所;乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、肌酸激酶-MB(CK-MB)、丙二醛(MDA)检测试剂盒,均购自南京建成生物工程研究所;一氧化氮(NO)检测试剂盒(北京康佳宏原生物科技有限公司);H2O2(3%,北京海德润制药有限公司)。其他试剂均为国产分析纯。
1.2 细胞株H9c2大鼠心肌细胞株,购自中国医学科学院基础医学研究所协和细胞资源中心。
1.3 仪器ELX800酶标仪,BIO-TEX Instruments公司;FV1000激光扫描共聚焦显微镜,日本OLYMPUS公司;XSZ-D2倒置显微镜,重庆光学仪器厂;IC 1000自动细胞计数仪,美国Countstar公司;5424R低温离心机,德国Eppendorf公司;MCO-15AC CO2培养箱,日本SANYO公司。
2 方法 2.1 细胞培养H9c2细胞以含10%胎牛血清的DMEM高糖培养基,于5% CO2、37 ℃恒温细胞培养箱中培养,待细胞铺满瓶底的80%左右时用0.05%胰蛋白酶消化,并以1∶3进行传代或用于后续实验。
2.2 细胞活力测定及形态学观察将存活率90%以上H9c2细胞制成细胞悬液,调整细胞悬液密度为1×105/mL,100 μL/孔接种于96孔板中。待细胞贴壁80%以上,加入浓度梯度为2 000、1 000、500、200、100 μmol/L的H2O2作用24 h,或以YXY 600、400、200、100、50、25 μg/mL作用24 h,对照组加入终浓度为0.1%的DMSO,另设无细胞培养液孔为调零孔。作用完毕后,每孔加入MTT(5 mg/mL)10 μL继续培养4 h后,弃去上清液,加入100 μL DMSO,置于摇床上低速震荡10 min使结晶充分溶解。使用酶联免疫检测仪检测490 nm处各孔吸光度(A)值。细胞抑制率=1-A实验/A对照。同时倒置显微镜观察各组细胞生长及损伤情况。
2.3 H2O2作用不同时间上清中LDH的水平H9c2细胞以密度5×105/mL、每孔500 μL接种于24孔板中。细胞贴壁后H2O2 100、200、300、400、500 μmol/L作用4、6、24 h,检测上清中LDH的水平,检测方法严格按照试剂盒说明书操作。
2.4 对H2O2损伤H9c2细胞形态及存活率的影响细胞接种方法同“2.2”项,分为对照组,模型组,YXY 25、50、100、200 μg/mL剂量组。对照组加入终浓度为0.1%的DMSO,模型组加入500 μmol/L的H2O2作用6 h,YXY组以YXY 25、50、100、200 μg/mL预处置24 h后,500 μmol/L的H2O2作用6 h;细胞活力测定及形态学观察同“2.2”项。
2.5 对细胞上清中LDH、CK、SOD、MDA和NO水平的影响细胞接种方法同“2.3”项,分组及药物干预方法同“2.4”项。处置完毕收集细胞上清,检测LDH、CK-MB、MDA、SOD、NO水平,检测方法严格按照试剂盒说明书操作。
2.6 对细胞内ROS水平的影响以1×105/mL细胞悬液接种于激光共聚焦显微镜专用培养皿,每皿2 mL。分为对照组,模型组,YXY 100、200 μg/mL剂量组。YXY组细胞贴壁后加入YXY 200、100 μg/mL,培养24 h后,YXY组和模型组加入500 μmol/L的H2O2作用1 h(根据预试验选择最佳接种密度和观测时间,H2O2刺激时,细胞内ROS和膜电位等指标变化出现较早,1 h组间即有明显差异)。吸弃培养基,加入1 mL浓度为5 μmol/L的DCFH-DA探针,继续孵育30 min。磷酸缓冲液(PBS)洗涤3次后,运用激光共聚焦显微镜观察细胞内ROS染色(激发波长488 nm,发射波长530 nm)。
2.7 对细胞浆游离钙的影响细胞接种、H2O2刺激和药物干预方法同“2.6”项。作用完毕后吸弃培养液,HEPES缓冲液洗涤细胞1次,加入Fluo-4 AM工作液,37 ℃孵育20 min。HEPES缓冲液洗涤细胞3次,激光共聚焦显微镜下观察。激发波长494 nm,发射波长516 nm。
2.8 对线粒体膜电位的影响细胞接种、H2O2刺激和药物干预方法同“2.6”项。作用完毕后吸弃培养液,PBS洗涤细胞1次,加入1 mL JC-1染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min。吸除上清,JC-1染色缓冲液(1×)洗涤2次,加入2 mL细胞培养液,激光共聚焦显微镜下观察,激发波长490/525 nm,发射波长530/590 nm。线粒体膜电位以红、绿荧光强度的比值表示。
2.9 统计学分析数据以x±s表示,统计检验使用GraphPad Prism软件进行,多组数据间差异比较采用单因素方差分析和Dunnett t检验。
3 结果 3.1 H2O2致H9c2细胞损伤模型成功 3.1.1 不同浓度H2O2作用后H9c2细胞抑制率不同浓度H2O2作用24 h,与对照组比较,随着H2O2浓度增加,H9c2细胞生存率呈剂量依赖性下降,H2O2 100、200、500 μmol/L抑制率分别为10.54%、11.71%、33.39%(n=6,P<0.05、0.01),H2O2 1 000、2 000 μmol/L抑制率达60.19%、68.67%(n=6,P<0.01)。
同期在倒置显微镜下观察:正常H9c2细胞呈梭形,排列规整,大小均匀,胞核、胞质边缘界限清楚,贴壁较牢,细胞间连接紧密。不同浓度H2O2损伤组呈不同程度的细胞收缩、细胞体积明显缩小、变圆,突起消失。细胞间隙增宽,细胞边界不清,胞膜不完整,出现明显损伤形态。H2O2 1 000 μmol/L以上组有较多细胞脱落,并形成大片脱失区。
3.1.2 H2O2作用不同时间上清中LDH的水平选择H2O2 100~500 μmol/L作用4、6、24 h,检测上清中LDH的水平以进一步优化作用时间。结果显示,H2O2 400、500 μmol/L作用6 h后LDH释放量高于对照组,差异显著(n=6,P<0.05、0.01),结果见图 1。综合上述实验结果,选择H2O2 500 μmol/L作为模型组刺激浓度进行后续实验。
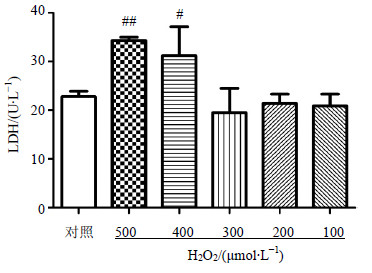 |
与对照组比较:#P<0.05 ##P<0.01 #P < 0.05 ##P < 0.01 vs control group 图 1 H2O2作用6 h H9c2细胞上清中LDH水平 (x±s, n = 6) Fig.1 LDH level in supernatant of H2O2-injured H9c2 cells after 6 h (x±s, n = 6) |
结果表明,YXY 25、50、100 μg/mL作用24 h细胞存活率分别为92.72%、94.08%、95.57%,与对照组差异不显著。YXY 200、400、600 μg/mL呈促进细胞增长趋势,存活率分别为103%、112%、118%(n=6,P<0.01、0.001)。选择对细胞生长无明显影响的200 μg/mL以下质量浓度后续给药。
3.2.2 对H2O2损伤H9c2细胞形态及存活率的影响H2O2损伤组细胞体积明显缩小,突起消失,细胞脱落较多,细胞间隙增宽,细胞胞膜不完整,损伤形态明显,细胞存活率下降。YXY 25、50、100、200 μg/mL预处置24 h对H2O2致细胞损伤有明显保护作用,改善细胞形态,显著提高细胞存活率(P<0.05、0.01)。结果见图 2、3。
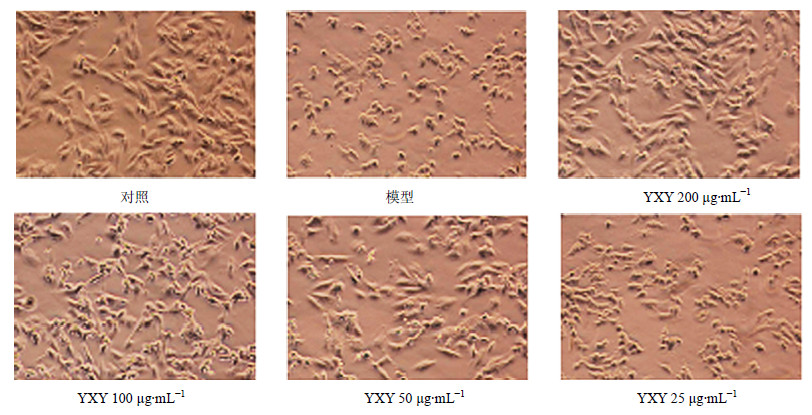 | 图 2 YXY对H2O2损伤H9c2细胞形态的影响 Fig.2 Effect of YXY on cells morphology of H2O2-injured H9c2 cells |
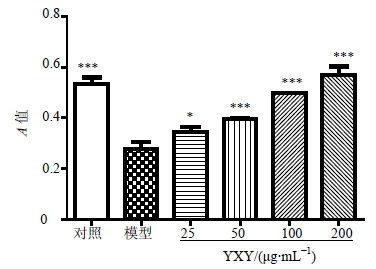 |
与模型组比较:*P<0.05 ***P<0.001,下同 *P < 0.05 ***P < 0.001 vs model group, below as same 图 3 YXY对H2O2损伤H9c2细胞存活率的影响 (x±s, n = 6) Fig.3 Effect of YXY on cell viability of H2O2-injured H9c2 cells (x±s, n = 6) |
LDH和CK在心肌细胞膜受到损伤时可由细胞中漏出,可作为细胞损伤的标志。结果表明,与对照组比较,模型组细胞上清液中LDH和CK的水平升高,LDH差异显著(P<0.001)。25、50、100、200 μg/mL YXY预处理组细胞上清液中LDH和CK的水平均有所降低,其中LDH差异显著(P<0.01、0.001)。与对照组比较,H2O2损伤组细胞上清中SOD活力明显降低,MDA、NO水平明显增加(P<0.01、0.001)。经YXY处理后,25、50、200 μg/mL剂量组SOD活力显著增高,差异显著(P<0.001),YXY 25、100、200 μg/mL剂量组MDA水平有所降低,差异显著(P<0.05、0.01)。YXY 25、50、100、200 μg/mL剂量组NO水平均有所降低,YXY 200 μg/mL组差异显著(P<0.05)。结果见图 4。
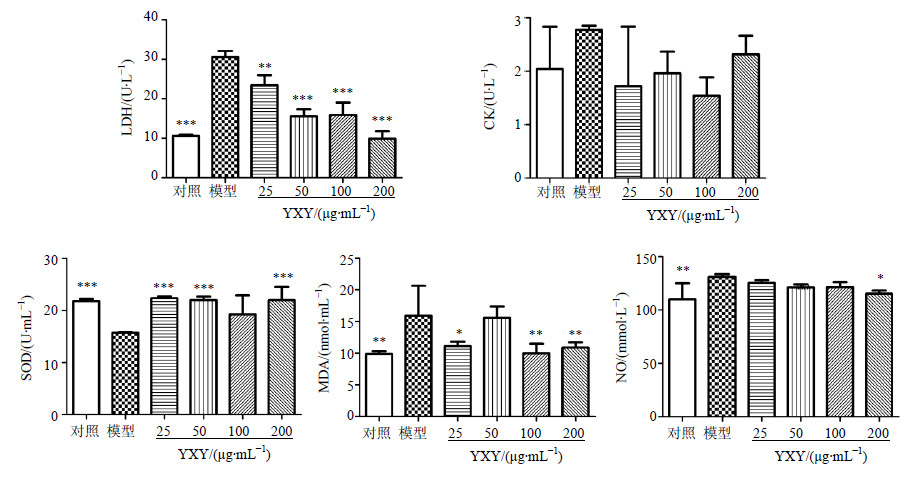 |
与模型组比较:**P<0.01,下同 **P < 0.01 vs model group, same as below 图 4 YXY对H2O2损伤H9c2细胞上清中LDH、CK、SOD、MDA、NO水平的影响(x±s, n = 6) Fig.4 Effect of YXY on LDH, CK, SOD, MDA, and NO levels in supernatant in H2O2-injured H9c2 cells (x±s, n = 6) |
DCFH-DA探针可穿过细胞膜,被细胞内酯酶水解的产物可与细胞内ROS结合生成荧光物质。500 μmol/L H2O2处理细胞1 h后,H9c2细胞内DCFH-DA平均荧光强度显著升高。YXY 200、100 μg/mL预处理可对抗H2O2诱导的心肌细胞内ROS增多,其中200 μg/mL组荧光强度降低30%以上。结果见图 5。
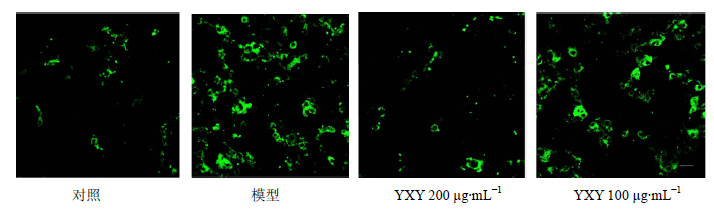 | 图 5 YXY对H2O2损伤H9c2细胞浆中ROS的影响 Fig.5 Effect of YXY on ROS level in cytoplasm of H2O2-injured H9c2 cells |
正常细胞胞浆中游离钙离子浓度较低,经H2O2刺激后游离钙表达阳性率及表达强度均明显增高,主要富集在细胞膜及细胞浆内。100、200 μg/mL YXY预处理能减少胞浆游离钙的异常改变,和模型组比较差异显著。结果见图 6。
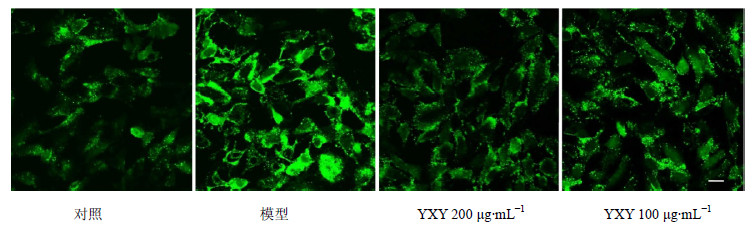 | 图 6 YXY对H2O2损伤H9c2细胞胞浆中游离钙离子浓度的影响 Fig.6 Effect of YXY on concentration of free calcium in cytoplasm of H2O2-injured H9c2 cells |
共聚焦显微镜下观察,正常细胞的表面大多呈均匀的橙红色,显示绿色荧光的细胞较少。经H2O2处理显示绿色荧光细胞数明显增多,荧光强度显著增强,表明细胞受损,其线粒体膜电位明显降低。加入100、200 μg/mL YXY预处理能减少H2O2刺激后的细胞线粒体膜电位的下降(红/绿荧光强度),和模型组比较显著差异(P<0.05、0.01)。结果见图 7。
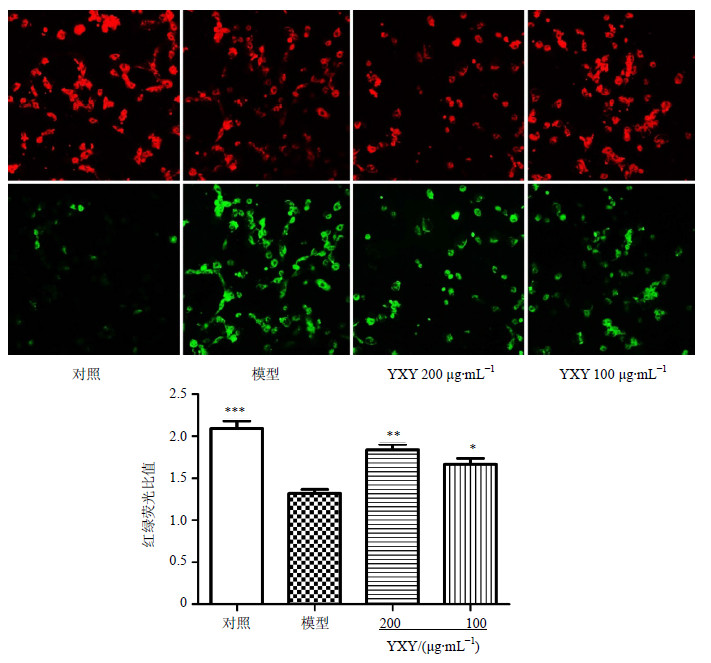 | 图 7 YXY对H2O2损伤H9c2细胞胞浆中线粒体膜电位的影响 (x±s, n = 4) Fig.7 Effect of YXY on mitochondria membrane potential in cytoplasm of H2O2-injured H9c2 cells (x±s, n = 4) |
氧化应激是机体遭受各种有害刺激时,机体氧化系统和抗氧化系统持续失衡而导致的组织损伤,在心脏病发生、发展过程中发挥重要作用。研究发现,心肌缺血再灌注过程中,由于ROS产生过多和抗氧化能力的减弱所致氧化应激可引起心肌细胞功能障碍及结构破坏,凋亡、坏死,心肌细胞大量缺失[5, 6]。
H2O2在体内可以调节多种重要的生理过程,如转录因子的活化、细胞增殖等,但过量的H2O2可引起氧化应激导致组织损伤。H2O2刺激是研究体外氧化应激损伤最常用的模型,可模拟体内氧化损伤的病理过程[7, 8, 9]。本研究采用大鼠H9c2细胞建立H2O2诱导心肌损伤模型,结果表明,H2O2对心肌细胞损伤随着H2O2浓度的增加和时间的延长而显著增强,其中500 μmol/L的H2O2作用6 h能使H9c2形态学细胞发生明显改变,细胞存活率降至30%左右,且细胞上清中LDH水平显著增高,因此选用此浓度的H2O2建立本实验室条件下的H9c2氧化应激模型。
本研究评价了YXY对H2O2心肌损伤的保护作用。YXY预处理可提高细胞生存率,使细胞形态趋向正常,心肌酶LDH和CK外漏减少。CK是特异性心肌标志物,LDH是细胞质中稳定存在的酶类,心肌细胞受损时其漏出量可反映细胞膜损伤程度[10]。YXY预处置减少了H2O2诱导细胞心肌酶漏出,说明心肌细胞膜损伤有所减轻。
同时,H2O2使心肌细胞ROS指示剂DCFH-DA的荧光强度增强,MDA水平升高。这一结果证实了H2O2对细胞内ROS的直接诱导作用及继发的细胞内脂质过氧化反应激增现象。同时心肌细胞内主要抗氧化酶SOD活性降低,表明H2O2不仅诱导了活性氧生成和脂质过氧化,还抑制了心肌细胞抗氧化酶活性,破坏心肌细胞正常的氧化/抗氧化平衡。本研究发现,此模型中NO水平也显著增高,提示氧化应激增加了NO诱导性表达,而NO与细胞内超氧阴离子自由基相互作用可形成强细胞毒性物质自由基硝酸盐阴离子(ONOO−),可进一步加重心肌损伤[11]。本实验结果显示,YXY可使H9c2细胞DCFH-DA荧光强度、MDA、NO水平降低,SOD活性增高,表明YXY一方面可清除H2O2诱生的活性氧、活性氮,减少脂质过氧化产物,还可增强心肌抗氧化能力,可通过恢复细胞内氧化/抗氧化平衡从而发挥对H9c2细胞氧化损伤的保护作用。线粒体,被称为细胞的能量工厂,是自由基最重要的来源,也是被ROS攻击最常见细胞靶器官[12]。同时线粒体作为心肌细胞内重要细胞器,既是心肌细胞能量产生的主要场所,又是细胞凋亡的启动处。在本模型出现了线粒体膜电位的明显变化,表明大量ROS的产生直接攻击了心肌细胞线粒体。同时,模型组可见H9c2细胞内钙明显增高。文献分析发现无论是分离的还是体内的线粒体都可以自发吸收和释放钙离子,线粒体的钙吸收和释放在维持胞浆钙稳态中起到十分重要的作用[13, 14],提示H2O2所致H9c2损伤可能对线粒体结构和功能都产生一定产生影响。YXY可通过稳定心肌细胞线粒体膜电位有效抑制线粒体膜电位下降介导的线粒体机制而发挥保护心肌细胞作用。同时,YXY显著降低细胞内钙水平,初步提示影响线粒体钙吸收和释放相关功能,减轻钙超载,也是YXY减轻心肌细胞损伤的机制之一。
综上所述,本研究首次报道了YXY对H2O2诱导心肌细胞的保护作用,并且发现其作用与线粒体途径有关。YXY是否可引起线粒体膜破坏?是否可以影响心肌细胞能量代谢系统?是否影响线粒体途径介导的心肌细胞凋亡?还需深入研究。
| [1] | 江凤林. 新编冠心病学 [M]. 北京: 中国科学技术出版社, 1998. |
| [2] | Gustafsson A B, Gottlieb R A. Mechanisms of apoptosis in the heart [J]. J Clin Immunol, 2003, 23(6): 447-459. |
| [3] | 刘羿男, 王卫平, 贾竹青, 等. α-硫辛酸对在H9c2细胞在H2O2导致的氧化应激损伤中的保护作用 [J]. 中国生物化学与分子生物学报, 2012, 28(03): 227-233. |
| [4] | Sharikabad M N, Ostbye K M, Brors O. Effect of hydrogen peroxide on reoxygenation-induced Ca2+ accumu-lation in rat cardiomyocytes [J]. Free Radic Biol Med, 2004, 37(4): 531-538. |
| [5] | Sterba M, Popelova O, Vavrova A, et al. Oxidative stress, redox signaling, and metal chelation in anthracycline cardiotoxicity and pharmacological cardioprotection [J]. Antioxid Redox Signal, 2013, 18(8): 899-929. |
| [6] | Murray T V, Ahmad A, Brewer A C. Reactive oxygen at the heart of metabolism [J]. Trends Cardiovasc Med, 2014, 24(3): 113-20. |
| [7] | Zhang Q, Huang W D, Lv X Y, et al. Puerarin protects differentiated PC12 cells from hydrogen peroxide- induced apoptosis through the PI3K/Akt signaling pathway [J]. Cell Biol Int, 2011, 36(5): 419-426. |
| [8] | Then S M, Sanfeliu C, Top G M, et al. Gamma- tocotrienol does not substantially protect DS neurons from hydrogen peroxide-induced oxidative injury [J]. Nutr Metab (Lond), 2012, 9(1): 1-10. |
| [9] | Fu J, Huang H, Liu J, et al. Tanshinone IIA protects cardiac myocytes against oxidative stress-triggered damage and apoptosis [J]. Eur J Pharmacol, 2007, 568(1/3): 213-221. |
| [10] | Sun X, Sun G B, Wang M, et al. Protective Effects of Cynaroside A-gainst H2O2-Induced Apoptosis in H9c2 Cardiomyoblasts [J]. J Cell Biochem, 2011, 112(8): 2019-2029. |
| [11] | 刘 霖, 范 谦, 杨新春, 等. 过氧亚硝酸阴离子加重急性心肌梗死患者缺血-再灌注心肌损伤 [J]. 中国介入心脏病学杂志, 2008, 16(4): 219-221. |
| [12] | Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane permeabilization in cell death [J]. Physiol Rev, 2007, 87(1): 99-163. |
| [13] | Pizzo P, Drago I, Filadi R, Pozzan T. Mitochondrial Ca2+ homeostasis: Mechanism, role, and tissue specifi-cities [J]. Pflugers Archiv J, 2012, 464(1): 3-17. |
| [14] | 陆久维, 翟宇佳, 孙 飞. 线粒体钙离子转运的研究进展 [J]. 生物物理学报, 2013, 29(3): 167-180 |
 2016, Vol. 47
2016, Vol. 47


