2. 北京中医药大学基础医学院, 北京 100029;
3. 北京中医药大学护理学院, 北京 100102
2. School of Preclinical Medicine, Beijing University of Chinese Medicine, Beijing 100029, China;
3. School of Nursing, Beijing University of Chinese Medicine, Beijing 100102, China
天麻Gastrodia elata Blume味甘、性平,入肝经,具有平肝息风、镇静安眠之功效,主要用于治疗癫痫、惊风、头痛、眩晕等疾病[1, 2],其抗癫痫作用在临床上有广泛应用,如抗痫散、镇惊止痫丸等[3, 4]。前期文献研究[5, 6]表明对羟基苯甲醛(HBA)和香草醛等酚醛类成分为天麻抗癫痫的主要有效成分;而结构类似的对羟基苯甲醇和对羟基苯乙醇等酪醇类成分无明显抗癫痫活性,其作用差异可能与结构中取代基类型有关,但具体的构效关系尚未明确。
HBA的抗癫痫作用机制较为明确,通过调节γ-氨基丁酸(GABA)酶系,抑制GABA转氨酶(GABA-T)活性,导致神经递质γ-GABA的水平升高从而产生抗癫痫作用。相关研究表明,利用化合物对GABA-T抑制作用来评价其抗癫痫活性具有一定的可行性[6]。但此种评价方法未见系统的条件优化,以适用于更多抗癫痫药物的体外活性筛选,从而进一步开发GABA-T抑制剂类抗癫痫药物。
本课题组一直致力于神经系统类中药有效成分结构修饰、构效关系分析及体外活性筛选研究[7, 8, 9]。在前期工作的基础上,本研究以HBA为阳性药[6, 10],优化影响GABA-T酶系稳定性的各项参数,建立一个高效的GABA-T抑制剂类抗癫痫药物筛选模型,并运用此模型测定12个HBA结构类似物的GABA-T抑制活性,同时分析HBA及其结构类似物抗癫痫活性的构效关系。本研究为GABA-T抑制剂类抗癫痫药物的研发提供一种新的筛选方法。
1 材料 1.1 动物健康雄性SD大鼠5只,体质量200~250 g,北京市维通利华实验动物技术中心提供,动物生产许可证SCXK(京)2006-0009。
1.2 药品及主要试剂HBA及其类似物均购自于北京伊诺凯科技有限公司,质量分数均达98%以上,结构见图 1、表 1。GABA,阿拉丁试剂;β-巯基乙醇,天津市福晨化学试剂厂;α-酮戊二酸、烟酰胺腺嘌呤二核苷酸(氧化型辅酶I,NAD+),Sigma公司;乙二胺四乙酸二钠(EDTA-2Na)、二甲基亚砜(DMSO),Amresco公司。
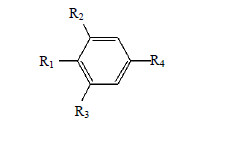 | 图 1 HBA及其类似物母核结构 Fig.1 Structures of HBA and its analogs |
| 表 1 HBA及其类似物结构 Table 1 Structures of HBA and its analogs |
TU-1810紫外可见分光光度计(北京普析通用仪器有限公司);pH计(梅特勒-托利多仪器有限公司);组织研磨器(匀浆器,涿州市长虹玻璃仪器厂);移液枪、离心机、DK-600电热恒温水浴箱(上海精宏实验设备有限公司);Specta Max190酶标仪(美国Molecular Devices);96孔板(美国Costar公司)。
2 方法 2.1 GABA-T酶系液的制备 2.1.1 缓冲液的配制缓冲液1:0.01 mol/L K2HPO4/KH2PO4、0.1 mmol/L EDTA-2Na、1 mmol/L β-巯基乙醇和1 mmol/L α-酮戊二酸,pH值为7.4,4 ℃保存;缓冲液2:0.01 mmol/L K2HPO4/KH2PO4、0.1 mmol/L EDTA-2Na、1 mmol/L β-巯基乙醇和20%甘油,pH值为7.4,4 ℃保存;检测缓冲液:0.1 mol/L K2HPO4/KH2PO4,pH值为8.5。
2.1.2 GABA-T酶系液的制备雄性SD大鼠,乙醚深度麻醉后,断头处死,迅速取出完整鼠脑(操作均在冰块上进行),于4 ℃生理盐水中洗净,置匀浆器中,每个鼠脑加入4~5 mL 缓冲液1,冰水浴匀浆处理。向匀浆液中慢慢滴加1 mmol/L乙酸,调节pH值为5.5,于50 ℃加热5 min后,在冰箱中冷却至4 ℃。10 000 r/min,离心10 min,收集上清液,缓慢加入 (NH4)2SO4,达70%饱和度时产生沉淀。10 000 r/min离心10 min,弃掉上清液,收集沉淀,用缓冲液2溶解,得质量分数为25%的GABA-T酶系粗提液,−20 ℃暂存。本优化处理是在常规酶原配制方法[11, 12]的基础上进行改进,制备的GABA-T酶系含有琥珀酸半醛脱氢酶(SSADH),活性检测时无需另外加入。
2.2 GABA-T活性检测模型的建立 2.2.1 酶活力单位与吸光度(A)值相关性评价应用紫外分光光度计检测烟酰胺腺嘌呤二核苷酸(NADH)在340 nm处A值,检测NADH的生成量、生成速率,反映GABA-T的活性大小。NADH生成表达式如下:
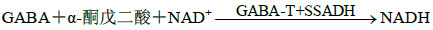
分别以反应时间,底物NAD+、α-酮戊二酸、GABA的浓度,GABA-T酶系液的加入量为横坐标,以A值为纵坐标,绘制相关性曲线。
2.2.2 反应温度和时间对GABA-T活性的影响向检测缓冲液中依次加入底物NAD+、GABA、α-酮戊二酸,使终浓度分别为0.025、5、0.2 mmol/L,摇匀后加入80 μL GABA-T酶系液,总体积4 mL。温孵温度为30、37、45 ℃,每隔10 min测定1次340 nm处A值。
2.2.3 NAD+浓度对GABA-T活性的影响向检测缓冲液中,分别加入0、0.025、0.05、0.1、0.2、0.6、0.8、1.6 mmol/L浓度的NAD+,再依次加入5 mmol/L GABA和0.2 mmol/L α-酮戊二酸,摇匀后加入80 μL GABA-T,总体积4 mL。分别于温孵之前及37 ℃条件下温孵30 min后测340 nm处A值,记录ΔA。
2.2.4 α-酮戊二酸浓度对GABA-T活性的影响向检测缓冲液中,加入0.2 mmol/L NAD+和5 mmol/L GABA,α-酮戊二酸的浓度分别为0、0.2、0.4、0.8、1.6、3.2、4.8、6.4 mmol/L,摇匀后加入80 μL GABA-T酶系液,总体积4 mL。ΔA值检测方法同“2.2.3”项。
2.2.5 GABA浓度对GABA-T活性的影响向检测缓冲液中,加入0.2 mmol/L NAD+和0.8 mmol/L α-酮戊二酸,GABA的浓度分别为0、2、4、6、8、10、12、16 mmol/L,摇匀后加入80 μL GABA-T酶系液,总体积4 mL。ΔA值检测方法同“2.2.3”项。
2.3 HBA及其结构类似物的筛选及构效分析设置空白组、对照组、药物空白组、药物测定组。以GABA-T酶系液、DMSO、检测缓冲液组成空白组;以GABA-T酶系液、检测缓冲液、0.2 mmol/L NAD+、6 mmol/L GABA、0.8 mmol/L α-酮戊二酸组成对照组;以检测缓冲液、药物、DMSO组成药物空白组,用以扣除药物的吸收;以GABA-T酶系液、药物、缓冲液、0.2 mmol/L NAD+、6 mmol/L GABA、0.8 mmol/L α-酮戊二酸组成药物测定组。各药物测定组中,HBA及其结构类似物以DMSO配制成质量浓度分别为0、2、4、6、8、10、12 μg/mL的溶液。每组设3个复孔,测340 nm处A值。以A值为纵坐标,以药物质量浓度为横坐标,绘制药物对GABA-T活性的抑制曲线。
GABA-T活性=(药物组A值-药物空白组A值-空白组A值)/(对照组A值-空白组A值)
2.4 统计学分析数据均以x±s表示,采用Origin软件进行统计分析。
3 结果 3.1 催化反应温度和时间对GABA-T活性的影响反应温度为37 ℃时,NADH的生成速率快且平稳上升,表明GABA-T催化效率高。反应时间为30 min时,NADH的生成浓度接近最大,趋近平衡,之后GABA-T开始失活,结果见图 2。故模型选择温孵条件为37 ℃,时间为30 min。
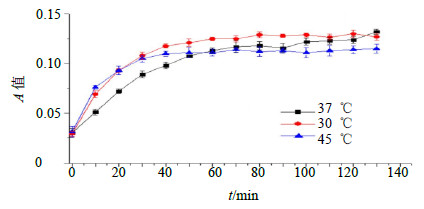 | 图 2 催化反应温度与时间考察曲线 (x±s, n = 3) Fig.2 Absorbance of reaction temperature and catalytic time (x±s, n = 3) |
NAD+浓度为0.2 mmol/L时,NADH的生成量接近最大,趋于平衡,说明GABA-T的催化能力达到饱和,不再随NAD+浓度的增加而升高,结果见图 3。故模型选择NAD+浓度为0.2 mmol/L。
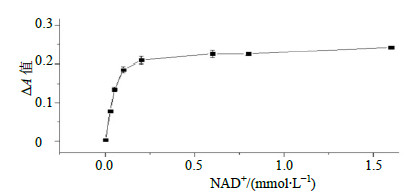 | 图 3 底物NAD+浓度考察曲线 (x±s, n = 3) Fig.3 Absorbance of different concentration of NAD+(x±s, n = 3) |
α-酮戊二酸浓度为0.8 mmol/L时,NADH的生成量接近最大,趋于平衡,GABA-T的催化能力达到饱和,ΔA值随α-酮戊二酸浓度进一步增加而降低,说明α-酮戊二酸的浓度过高对GABA-T有抑制作用,结果见图 4。故模型选择α-酮戊二酸浓度为0.8 mmol/L。
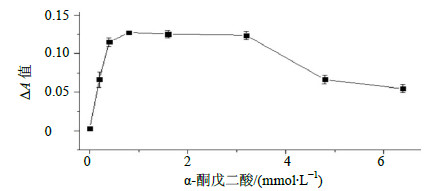 | 图 4 底物α-酮戊二酸的浓度考察曲线 (x±s, n = 3) Fig.4 Absorbance of different concentration of α-ketoglutarate (x±s, n = 3) |
GABA浓度为6 mmol/L时,NADH的生成量接近最大,趋于平衡,GABA-T的催化能力达到饱和,但随GABA的浓度继续增大而略有升高趋势,说明酶的活性与GABA的浓度呈量效关系,结果如图 5。故模型选择GABA浓度为6 mmol/L。
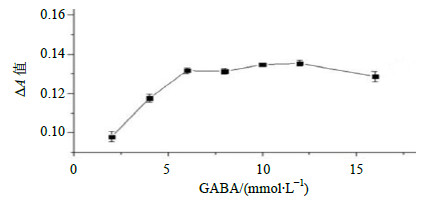 | 图 5 底物GABA的浓度考察曲线 (x±s, n = 3) Fig.5 Absorbance of different concentration of GABA(x±s, n = 3) |
根据以上参数考察实验,确定GABA-T活性检测体系为检测缓冲液中加入底物0.2 mmol/L NAD+、6 mmol/L GABA、0.8 mmol/L α-酮戊二酸;总体积4 mL;37 ℃条件下,温孵30 min,340 nm处测A值。
3.6 HBA及其结构类似物的筛选及构效分析HBA对GABA-T酶系液有明显抑制作用(IC50为4.8 μg/mL),且呈剂量依赖性,与文献报道的一致[14]。结果见图 6。说明此筛选模型可靠,可进行GABA-T抑制剂类药物筛选。
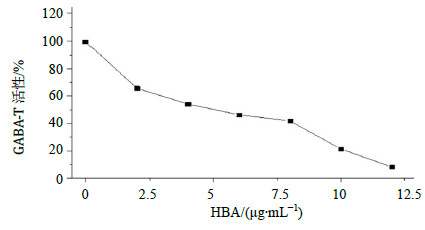 | 图 6 HBA对GABA-T的抑制曲线 (x±s, n = 3) Fig.6 Inhibition of GABA-T by HBA (x±s, n = 3) |
在10 μg/mL质量浓度下,HBA、香草醛和原儿茶酸组的GABA-T活性明显受到抑制,GABA-T活性分别为26.16%、45.58%和53.47%,对应的抑制率分别为73.84%、54.42%和46.53%,而其他化合物的抑制率较低,与前期文献报道基本相符[6, 13]。结果见图 7。
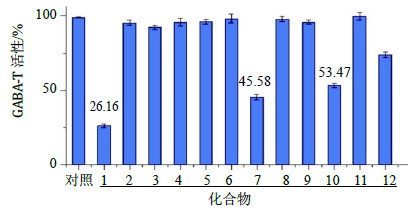 | 图 7 化合物终质量浓度为10 μg/mL GABA-T体外测试活性 (x±s, n = 3) Fig.7 In vitro tests on activity of GABA-T at final concentration of 10 μg/mL (x±s, n = 3) |
构效关系分析表明,12种HBA结构类似物为以下4种情况时,其对GABA-T的抑制活性均消失:①HBA的-OH替换为-OCH3,即化合物2(茴香醛)结构;②HBA的-OH被去掉,即化合物3(苯甲醛)结构;③HBA的-CHO被还原为-CH2OH即化合物4(对羟基苯甲醇)结构和化合物8(香草醇)结构;④HBA的-CHO被氧化成-COOH即化合物6(对羟基苯甲酸)结构和化合物9(香草酸)结构。得出结论,HBA及香草醛的-OH及苯环对位上的-CHO确定为必须药效团。HBA与底物之一α-酮戊二酸均具有羰基基团和酸性基团(-OH或-COOH),故HBA可以与底物竞争GABA-T的活性位点,产生较强的抑制作用。
4 讨论癫痫等神经系统类疾病均与脑内GABA浓度有关,GABA-T抑制剂类化合物可增加脑内GABA浓度,选择性地对相关神经系统类疾病达到治疗作用,如HBA等GABA-T类化合物已被证实通过此途径发挥抗癫痫活性[15]。因此,GABA-T抑制活性高通量筛选方法可为发现癫痫等神经系统疾病治疗方法提供依举,对发现及研究中药有效成分中GABA-T抑制剂类抗癫痫成分提供有效参考。
目前,评价抗癫痫中药药效成分活性的模型主要以动物模型为主[16],通过电击或药物刺激等手段对实验动物造模,待测药物干预后,将模型动物进行取材,分析GABA-T等癫痫指标,进而评价抗癫痫药物活性。发掘以靶点进行体外活性高通量筛选是当前药物筛选研究的热点[17],本研究成功建立了基于GABA-T酶系的体外抗癫痫筛选模型。研究结果表明,在中药天麻抗癫痫有效成分中,HBA、香草醛和原儿茶醛为GABA-T抑制剂类活性成分,在本模型中测定的其他酪醇未表现出明显活性,与其不是GABA-T抑制剂的事实相符[18]。该模型可用于抗癫痫中药复方活性成分筛选和作用机制研究,也可为中药抗癫痫先导化合物的结构修饰、构效关系研究提供依据,在新型GABA-T抑制剂类抗癫痫药物发现方面具有一定价值。
| [1] | 洪 全, 陈 淼, 李雪萍. 天麻药理研究进展 [J]. 中国实用医药, 2010, 5(11): 249-250. |
| [2] | 陈 颖, 常 琪, 刘新民. 天麻对中枢神经系统作用的研究进展 [J]. 中草药, 2007, 38(6): 附4-附6. |
| [3] | 朱欧鸽, 陈志茹, 程为平. 单纯中药治疗癫痫病的研究进展 [J]. 世界中西医结合杂志, 2010, 5(3): 272-275. |
| [4] | 王丛礼. 镇惊止痫丸治疗痫证 (风痰闭窍型) 的临床研究 [D]. 哈尔滨: 黑龙江省中医药科学院, 2013. |
| [5] | 王 莉, 肖红斌. 天麻质量控制及活性成分研究进展 [J]. 中草药, 2009, 40(增刊): 71-72. |
| [6] | Tao Y H, Yuan Z, Tang X Q, et al. Inhibition of GABA shunt enzymes' activity by 4-hydroxybenzaldehyde derivatives [J]. Bioorg Med Chem Lett, 2006, 16(3): 592-595. |
| [7] | Xu B, Gong Y, Xu X, et al. Synthesis and protective effect of new ligustrazine derivatives against CoCl2-induced neurotoxicity in differentiated PC12 cells. Part 2 [J]. Med Chem Commun, 2015, 6(5): 806-809. |
| [8] | Li G L, Xu X, Xu K, et al. Ligustrazinyl amides: a novel class of ligustrazine-phenolic acid derivatives with neuroprotective effects [J]. Chem Cent J, 2015, doi: 10.1186/s13065-015-0084-5. |
| [9] | Wang P L, Zhang H G, Chu F H, et al. Synthesis and protective effect of new ligustrazine-benzoic acid derivatives against CoCl2-induced neurotoxicity in differentiated PC12 cells [J]. Molecules, 2013, 18(10): 13027-13042. |
| [10] | Ha J H, Lee D U, Lee J T. 4-Hydroxybenzaldehyde from Gastrodia elata B1. is active in the antioxidation and GABAergic neuromodulation of the rat brain [J]. J Ethnopharmacol, 2000, 73(1/2): 329-333. |
| [11] | Churchich J E, Moses U. 4-Aminobutyrate aminotransferase. The presence of nonequivalent binding sites [J]. J Biol Chem, 1981, 256(3): 1101-1104. |
| [12] | Koo Y K, Nandi D, Silverman R B. The Multiple active enzyme species of γ-aminobutyric acid aminotransferase are not isozymes [J]. Rch Biochem Biophys, 2000, 374(2): 248-254. |
| [13] | Ha J H, Shin S M, Lee S K, et al. In vitro effects of hydroxybenzaldehydes from Gastrodia elata and their analogues on GABA ergic neurotransmission, and a structure-activity correlation [J]. Planta med, 2001, 67(9): 877-880. |
| [14] | 张 勇, 席刚明, 周少华. 天麻及其成分对神经系统的作用 [J]. 国际中医中药杂志, 2006, 28(5): 268-271. |
| [15] | Kushner S A, Dewey S L, Kornetsky C. The irreversible C-aminobutyric acid (GABA) transaminase inhibitor C-vinyl-GABA blocks cocaine self-administration in rats. J Pharmacol Exp Ther, 1999, 290(2): 797-802. |
| [16] | 于美娟, 刘学伍. 动物模型在抗癫痫药物筛选中的应用 [J]. 国外医学: 神经病学·神经外科学分册, 2003, 30(2): 141-144. |
| [17] | 庄嘉琅, 曾 行, 钟国平, 等. 基于报告基因检测的PXR, FXR和LXR α-激动剂高通量筛选模型的建立 [J]. 中国药理学通报, 2015, 31(2): 289-293. |
| [18] | 王加强, 韩东娜, 关碧琰, 等. 天麻素辅助治疗慢性顽固性癫痫的疗效观察 [J]. 中国全科医学, 2005, 8(14): 1181-1182. |
 2016, Vol. 47
2016, Vol. 47


