2. 安徽省中医药科学院中西医结合研究所, 安徽 合肥 230038
2. Institute of Integrated Traditional and Western Medicine, Anhui Academy of Chinese Medicine, Hefei 230038, China
白念珠菌Candida albicans是临床上常见的条件致病性真菌,定植于人体皮肤黏膜,在机体免疫力下降或微生态失衡时能引起皮肤、口腔、阴道甚至系统性感染[1]。常规抗真菌药物尽管对白念珠菌具有一定的效果,但由于临床上长期使用,白念珠菌出现耐药性的情况日益严重。白念珠菌耐药性原因较多,生物膜(biofilm)形成是主要因素之一。生物膜是微生物(主要是细菌和真菌)在生物或非生物组织材料表面上形成的一种复杂的三维结构,由菌体及其所分泌的基质所组成[2]。生物膜形成后,膜内菌的耐药性比浮游菌增强10~1 000倍[3]。
鉴于现有抗真菌药物对肝肾等主要脏器的毒副作用以及生物膜形成等原因所产生的耐药性,亟需寻找更多的抗真菌药物。研究表明,大量中药(复方、单味药以及有效成分)具有良好的抗真菌活性[4]。本课题组近期在对抗真菌中药筛选研究中发现云南重楼(滇重楼)Paris polyphylla Smith. var. yunnanensis (Franch.) Hand. -Mazz. 具有显著的抗白念珠菌作用。为了更接近有效部位或组分又不失中药多成分、多效应的特点,本研究对云南重楼饮片采用多种溶剂萃取,得到相应的提取物。经比较得出,云南重楼提取物的石油醚、醋酸乙酯萃取物不仅有效成分少,且无明显抗白念珠菌的效果,而云南重楼正丁醇提取物(butanol extract from Paris polyphylla,BEPP)具有显著的抗白念珠菌作用。本研究拟探讨BEPP对白念珠菌生物膜形成的干预作用,初步探讨其作用机制。
1 材料 1.1 菌株白念珠菌标准株SC5314由第二军医大学药学院姜远英教授惠赠,临床株由安徽省立医院检验科鲁怀伟主任惠赠。
1.2 主要试剂阳性对照药氟康唑(FCZ,中国食品药品检定研究院,批号100314);25%戊二醛溶液(国药集团化学试剂有限公司);RPMI 1640培养基(美国Gibco公司);甲基四氮盐(XTT,加拿大BBI公司);维生素K3(博美公司);无水乙醇(上海苏懿化学试剂有限公司);溶壁酶、HEPES试剂(Sigma公司);Total RNA提取试剂、逆转录试剂盒、实时荧光定量PCR(qRT-PCR)反应试剂(日本ToyoBo公司);引物(上海生工生物工程有限公司);FUN 1(Invitrogen公司)。
1.3 药物云南重楼中药饮片购于安徽亳州济人药业有限公司,经安徽省中医院高家荣主任药师鉴定为云南重楼Paris polyphylla Smith. var. yunnanensis (Franch.) Hand. -Mazz. 的干燥根茎。将云南重楼药材置于75%乙醇中加热回流提取3次,每次2 h,合并滤液,再用水饱和正丁醇萃取3次,将正丁醇萃取液合并,65 ℃旋转蒸发至干,得到BEPP[5]。BEPP主要成分为云南重楼总皂苷,经检测其质量分数为56.83%。
1.4 仪器DPH-9162型电热恒温培养箱(上海一恒科技有限公司);聚苯乙烯96孔微量培养板(美国Corning公司);血细胞计数板(上海求精生化试剂仪器有限公司);AB SpectraMax M2e多功能酶标仪(上海美谷分子仪器有限公司);I7000荧光定量PCR仪(美国生物应用系统公司),Sirion 200型扫描电镜(scanning electron microscopy,SEM,荷兰FEI公司),激光共聚焦显微镜(confocal laser scanning microscopy,CLSM,德国徕卡公司),HVS-GB型真空蒸镀仪(上海铂锐仪器有限公司)。
2 方法 2.1 菌液的配制从4 ℃保存的沙氏培养基上挑取白念珠菌单菌落,接种至5 mL沙氏液体培养基中,于37 ℃、200 r/min振荡培养16 h,使白念珠菌处于对数生长期,用血细胞计数板计数,以RPMI 1640培养基将菌液稀释到2×106 CFU/mL备用[6]。
2.2 MIC的测定[7]根据美国临床试验标准化委员会(NCCLS)的M27-A方案的微量稀释法,将菌液浓度调整为2×103 CFU/mL,用RPMI 1640培养基将BEPP按倍比稀释成10个质量浓度:2 048、1 024、512、256、128、64、32、16、8、4 μg/mL,在96孔板中的第1~10列依次加入配好的不同质量浓度的100 μL BEPP和100 μL菌液,在第11列加入100 μL RPMI 1640培养基和100 μL菌液作为对照组,第12列加入200 μL RPMI 1640培养基,使96孔板上的第1~11列的菌液浓度最终为1×103 CFU/mL。设置阳性对照药FCZ(0.25~1 024 μg/mL)。恒温37 ℃培养48 h,以肉眼观察96孔板中无菌生长的最小药物稀释浓度作为MIC,以上操作重复3次。
2.3 生物膜抑制80%浓度(SMIC80)的测定[8]XTT溶液的配制:XTT粉末以林格液溶解,使其质量浓度为0.5 g/L,用0.22 μm滤膜滤过后储存于−20 ℃。维生素K3用丙酮溶解稀释到浓度为10 mmol/L,置于−20 ℃储存。实验前向XTT溶液中加入维生素K3溶液,使维生素K3的浓度为1 μmol/L。
除96孔板上的第1~11列的菌液浓度最终为1×106 CFU/mL、设置FCZ(2~1 024 μg/mL)外,其余操作均同“2.2”项。恒温37 ℃培养24 h至生物膜成熟后,吸弃上清液,磷酸盐缓冲液(PBS)洗1次后,每孔中加入50 μL XTT-维生素K3溶液,避光孵育2 h。使用多功能酶标仪检测490 nm处各孔的吸光度(A)值。与对照组相比,以A值降低80%的药物浓度为SMIC80,以上操作重复3次。
2.4 白念珠菌SC5314生物膜抑制率的检测将BEPP按倍比稀释成7个质量浓度:2 048、1 024、512、256、128、64、32 μg/mL,在96孔板1~7列中分别加入各质量浓度的100 μL BEPP和100 μL 2×106 CFU/mL的菌液,在第8列中加入100 μL RPMI 1640培养基和100 μL 2×106 CFU/mL的菌液作为对照组,第9列加入200 μL RPMI 1640培养基。恒温37 ℃培养24 h至生物膜成熟后,XTT代谢实验检测SC5314生物膜,方法同“2.3”项。按公式计算生物膜抑制率。
生物膜抑制率=1-A处理组/A对照组
2.5 白念珠菌SC5314时间-杀菌曲线[9]取3 mL 2×106 CFU/mL菌液与3 mL质量浓度分别为256、128、64、32、0 μg/mL的BEPP以及256 μg/mL FCZ分别混合置于6个试管中。将上述所有试管置于37 ℃培养箱,分别在培养0、2、4、8、12、24 h,取菌液100 μL,用PBS按10倍系列稀释。将原菌液和各个稀释倍数的菌液分别取100 μL均匀涂布于沙氏琼脂培养基平皿上,将平皿置于37 ℃培养箱中培养48 h,计数,菌落数>20方可计入结果。以lgCFU为纵轴作时间-杀菌曲线。
2.6 SEM观察白念珠菌SC5314生物膜形态[10]取1 mL 2×106 CFU/mL菌液与1 mL质量浓度分别为256、128、64、0 μg/mL BEPP以及256 μg/mL FCZ混合置于6孔板,每孔中再分别放入经75%乙醇浸泡24 h的1 cm的硅胶导管,恒温37 ℃培养24 h后,将导管取出,用无菌PBS清洗3次,置2.5%戊二醛中,避光4 ℃放置2 h,取出导管用无菌PBS洗3次,依次置于35%、50%、75%、95%乙醇,无水乙醇逐级脱水10 min,室温干燥后,经HVS-GB型真空蒸镀仪喷金后,用SEM观察、拍照。
2.7 CLSM观察白念珠菌SC5314生物膜厚度[11]取1 mL 2×106 CFU/mL菌液与1 mL质量浓度分别为256、128、64、0 μg/mL BEPP以及256 μg/mL FCZ混合置于CLSM培养皿中,恒温37 ℃培养24 h后,吸弃上清液,用GH缓冲液清洗,加入FUN1荧光染液,避光染色0.5 h后,以CLSM观察、拍照。
2.8 qRT-PCR检测白念珠菌SC5314生物膜相关基因的表达 2.8.1 总RNA的提取3 mL 2×106 CFU/mL菌液与3 mL质量浓度分别为0、64、128、256 μg/mL BEPP混合,37 ℃、200 r/min作用24 h后,离心(8 000 r/min,5 min)收集菌体,用无菌PBS冲洗3次后进行总RNA提取,调节RNA浓度,使菌体模板量一致。操作方法按照RNA提取试剂说明书进行。
2.8.2 引物的设计与合成所需基因序列由NCBI基因库查得,Primer Premier5.0软件设计引物,委托上海生工生物工程有限公司合成,各引物序列见表 1。
| 表 1 白念珠菌生物膜形成相关基因引物序列 Table 1 Related gene primer sequences for formation of C. albicans biofilm |
根据逆转录试剂盒说明书进行,反应液配制均于冰上操作。具体如下:6 μL RNA变性(65 ℃、5 min,4 ℃、1 min),加入其他反应试剂 [4×DNA Master(55 μL):gDNA Remover(1.1 μL)] 2 μL,5×RT-Master Mix II 2 μL混合后按如下条件进行逆转录:50 ℃、5 min;98 ℃、5 min;4 ℃、1 min。反应完成后将cDNA稀释10倍,置于−80 ℃备用。
2.8.4 qRT-PCR反应采用qRT-PCR试剂盒,总反应体系为25 μL:2×SYBR Green Real time PCR 12.5 μL,正向引物(10 μmol/L)1 μL,反向引物 1 μL,cDNA 0.5 μL,ddH2O 10 μL。扩增反应在ABI 7000荧光定量PCR仪上进行,反应条件:预变性95 ℃、60 s;扩增定量程序40个循环,循环参数为变性95 ℃、15 s;退火55 ℃、15 s;延伸72 ℃、45 s;熔解曲线:60~95 ℃,加热速率为0.1 ℃/s。每个样品均设置3重复,实验重复3次。
2.8.5 定量分析qRT-PCR分析分别测定目的基因HWP1、MP65、SUN41及内参ACT1的Ct值,实验结果取其平均值。基因表达水平用倍数变化来表示(2−ΔΔCt法)。
2.9 统计学处理计量资料以x±s表示,所有数据使用SPSS 17统计软件分析处理,组间差异比较采用单因素方差分析检验。
3 结果 3.1 对白念珠菌SC5314以及临床株的MIC以及SMIC80除标准SC5314和临床1302菌株,其余菌株对FCZ的MIC都大于64 μg/mL,为耐药菌株,所有菌株对FCZ的SMIC80均大于1 024 μg/mL。BEPP对白念珠菌的MIC在32~128 μg/mL,SMIC80在128~512 μg/mL。相对于FCZ,BEPP对白念珠菌生物膜形成的抑制效果更好。结果见表 2。
| 表 2 BEPP对白念珠菌的MIC及SMIC80 Table 2 MICand SMIC80 of BEPPto C.albicans |
通过XTT代谢实验表明,BEPP对白念珠菌生物膜形成的抑制作用呈剂量依赖性,当BEPP质量浓度为16 μg/mL时,对生物膜形成几乎无抑制作用。随着药物质量浓度的升高,BEPP对生物膜形成的抑制作用也相应增强,当质量浓度为256 μg/mL时,即可有效抑制80%左右的生物膜形成。结果见图 1。
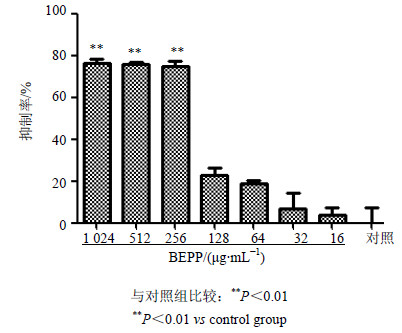 |
与对照组比较:**P<0.01 **P<0.01 vs control group 图 1 BEPP对白念珠菌SC5314生物膜形成的抑制率(x±s, n = 6) Fig.1 Inhibitory rates of BEPP at different concentration on biofilm formation of SC5314 (x±s, n = 6) |
当药物质量浓度在32 μg/mL以下时,几乎无杀菌作用,与对照组差别不大,当药物质量浓度提高至256 μg/mL,白念珠菌SC5314的生长受到明显抑制,从4 h开始,lgCFU下降到3以下,说明杀菌效果良好。结果见图 2。
 |
与对照组比较:*P<0.05 *P < 0.05 vs control group 图 2 BEPP对白念珠菌SC5314的时间-杀菌曲线 (x±s, n = 6) Fig.2 Time-sterilization curves of BEPP against SC5314 (x±s, n = 6) |
经SEM观察发现,对照组大量菌丝错综交叉并包裹酵母相,形成成熟的生物膜结构。在64、128 μg/mL BEPP作用下,仍可见一定的生物膜形态,当BEPP达到256 μg/mL时,白念珠菌生物膜结构完全消失,只有少量的酵母相存在。结果见图 3。
 | 图 3 SEM观察BEPP对白念珠菌SC5314生物膜形态结构的影响 Fig.3 Effects of BEPP on biofilms morphological structures of SC5314 observed by SEM |
根据荧光强度所对应的生物膜活细胞数,对照组所显示的生物膜最厚,而加入BEPP干预后,荧光强度随药物质量浓度的不断增高而逐渐减弱,当BEPP为256 μg/mL时,只能观察到微弱的荧光信号。结果见图 4。
 | 图 4 CLSM观察BEPP对白念珠菌SC5314生物膜的影响 Fig.4 Effects of BEPP on biofilms framework of SC5314 observed by CLSM |
与对照组比较,当BEPP质量浓度在64、128、256 μg/mL时,HWP1表达分别下调了25.9%、67.1%、87.8%,MP65表达分别下调了43.5%、72.0%、85.0%,SUN41表达分别下调了37.5%、86.5%、88.9%。结果见图 5。
 |
与对照组比较:**P<0.01 **P < 0.01 vs control group 图 5 BEPP对白念珠菌SC5314生物膜相关基因表达的影响 (x±s, n = 3) Fig.5 Effect of BEPP on gene expression of C. albicans biofilm (x±s, n = 3) |
云南重楼属于百合科重楼属植物的干燥根茎,主要分布于我国的四川、云南、贵州等地,其主要用于清热解毒、治疗癌症、消肿止痛等[12, 13]。药理学实验表明,云南重楼具有广谱的抗微生物活性,对大肠杆菌、金黄色葡萄球菌、宋内氏痢疾杆菌、黏质沙雷氏菌具有较好的抑制效果,尚有一定的抗病毒作用[14],但云南重楼对真菌尤其是白念珠菌生物膜的影响尚未见报道。
本实验发现,BEPP对白念珠菌标准株SC5314以及临床菌株的MIC范围在32~128 μg/mL,表明其对白念珠菌悬浮菌具有较强抑制作用;SMIC80的范围在128~512 μg/mL,显示其对白念珠菌生物膜也具有良好的干预效应,而阳性对照药FCZ的SMIC80超过1 024 μg/mL,提示BEPP抗白念珠菌生物膜作用强于FCZ。
XTT是一种四唑氮衍生物,其可与活细胞的线粒体脱氢酶作用,被活细胞还原成棕黄色的甲臢产物。XTT法利用这一特性检测甲臢产物的A值,从而反映活细胞的增殖以及活性状况[15]。实验发现,相对于对照组,当BEPP在256 μg/mL时,A值减小了80%。而时间-杀菌曲线也验证BEPP具有一定的杀菌作用,可进一步抑制白念珠菌的生物膜形成。
SEM检测发现,相对于对照组的成熟生物膜,随着BEPP质量浓度递增,生物膜形成呈剂量依赖性抑制。当BEPP质量浓度为256 μg/mL时,白念珠菌已不能形成生物膜,只有少量的酵母相细胞存在。利用重构荧光图像的方法,通过CLSM观测发现,对照组的生物膜可形成较厚的三维结构,而BEPP质量浓度为256 μg/mL时,CLSM只能观察到较弱的荧光强度,无生物膜存在。
白念珠菌生物膜形成受到相关基因的调控。HWP1是首个发现在体内条件下对生物膜形成有显著影响的基因,其表达产物是一种黏附素,可利用共价键与宿主细胞集合,HWP1基因的缺失菌株在体内外均不能形成完整的生物膜[16, 17]。MP65基因参与细胞壁葡聚糖以及黏附素的合成,敲除该基因的菌株也不能形成完整形态生物膜[18]。SUN基因家族包括SUN41和SUN42两个基因,其中SUN41参与菌体细胞壁以及生物膜的形成,缺失该基因的菌株无法正常生成作为生物膜主要结构的菌丝,且对宿主的致病性也大大降低[19]。qRT-PCR结果显示,加入不同质量浓度的BEPP均可导致HWP1、MP65、SUN41基因呈不同程度的下调,在256 μg/mL质量浓度的BEPP作用下,HWP1、MP65、SUN41基因分别下调了87.8%、85.0%、88.9%。推测BEPP抑制白念珠菌生物膜的形成可能与抑制上述生物膜相关基因的表达有关。
本研究表明,BEPP对耐药性强的白念珠菌生物膜具有显著的抑制作用,这将为拓宽云南重楼潜在的临床用途奠定了基础,同时也丰富了抗真菌药物的来源渠道。但BEPP抗白念珠菌生物膜的有效成分与详细的作用机制以及对体内的生物膜干预效应尚有待于进一步揭示。
| [1] | Mayer F F, Wilson D, Hube B. Candida albicans pathogenicity mechanisms [J]. Virulence, 2013, 4(2): 119-128. |
| [2] | Bonhnmme J, d'Enfert C. Candida albicans biofilm: building a heterogeneous, drug-tolerant environment [J]. Curr Opin Microbiol, 2013, 16(4): 398-403. |
| [3] | Heather T T, Kaitlin F M, Jessica A E, et al. Mechanisms of Candida biofilm drug resistance [J]. Future Microbiol, 2013, 8(10): 1325-1337. |
| [4] | 范国君. 中药抗真菌研究进展 [J]. 四川中医, 2014, 32(8): 185-186. |
| [5] | 高云涛, 杨利荣, 杨益林, 等. 重楼提取物体外清除活性氧及抗氧化作用研究 [J]. 中成药, 2007, 29(2): 195-198. |
| [6] | Tobudic S, Kratzer C, Lassnigg A, et al. In vitro activity of antifungal combinations against Candida albicans biofilms [J]. J Antimicrob Chemother, 2010, 65(2): 271-274. |
| [7] | Ansari M J, Al-Ghamdi A, Usmani S, et al. Effect of jujube honey on Candida Albicans growth and biofilm formation [J]. Arch Med Res, 2013, 44(5): 352-360. |
| [8] | Chavez-Dozal A A, Lown L, Jahng M, et al. In vitro analysis of finasteride activity against Candida albicans urinary biofilm formation and filamentation [J]. Antimicrob Agents Chemother, 2014, 58(10): 5855-5862. |
| [9] | Liu W, Li L P, Zhang J D, et al. Synergistic antifungal effect of glabridin and fluconazole [J]. Plos One, 2014, 9(7): e103442. |
| [10] | Andes D, Nett J, Oschel P, et al. Development and characterization of an in vivo central venous cantheter Candida Albicans biofilm model [J]. Infect Immun, 2004, 72(10): 6023-6031. |
| [11] | Li D D, Zhao L X, Mylonakis E, et al. In vitro and in vivo activity of pterostilbene against Candida albicans biofilms [J]. Antimicrob Agents Chemother, 2014, 58(4): 2344-2355. |
| [12] | 李彤彤, 高 飞, 段承俐, 等. 云南重楼中血管内皮生长因子结合因子的活性研究 [J]. 中草药, 2015, 46(15): 2251-2256. |
| [13] | 张兰天, 左予桐, 高文远, 等. 云南重楼提取物及化学成分的抗肿瘤活性研究 [J]. 中草药, 2007, 38(3): 422-424. |
| [14] | 邓子超, 黄 玮, 张文生, 等. 云南重楼研究进展 [J]. 中国医药技术经济与管理, 2007, 1(2): 57-63. |
| [15] | Xie Z H, Thompson A, Kashleva H, et al. A quantitative real-time RT-PCR assay for mature C. albicans biofilms [J]. BMC Microbiol, 2011, doi: 10.1186/1471-2180-11-93. |
| [16] | Nobile C J, Nett J E, Andes D R, et al. Function of Candida albicans adhesin hwp1 in biofilm formation [J]. Eukaryot Cell, 2006, 5(10): 1604-1610. |
| [17] | Sundstrom P. Adhesion in Candida spp. [J]. Cell Microbiol, 2002, 4(8): 461-469. |
| [18] | Sandini S, La Valle R, De Bernardis F, et al. The 65 kDa mannoprotein gene of Candida albicans encodes a putative beta-glucanase adhesin required for hyphal morphogenesis and experimental pathogenicity [J]. Cell Microbiol, 2007, 9(5): 1223-1238. |
| [19] | Ekkehard H, Sonja H, Herwig B, et al. Candida albicans Sun41p, a putative glycosidase, is involved in morphogenesis, cell wall biogenesis, and biofilm formation [J]. Eukaryotic Cell, 2007, 6(11): 2056-2065. |
 2016, Vol. 47
2016, Vol. 47


