2. 河北医科大学第二医院 药学部, 河北 石家庄 050000
2. Department of Pharmacy, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China
松萝Usneae Filum为松萝科(Usneaceae)植物长松萝Usnea longissim Ach. 或节松萝Usnea diffracta Vain. 的干燥地衣体,在我国分布广泛,其性味苦、甘、平,具有祛风活络、清热解毒、止咳化痰的功效[1]。现代药理研究表明松萝具有抗菌、镇痛、解热、杀虫、抗肿瘤、抗过敏、抗病毒、促进伤口愈合[2, 3, 4, 5, 6, 7]等作用。松萝含有多种有效成分,主要为酚酸、甾体、三萜及多糖等,其中酚酸类成分是其主要药效成分,具有抗菌[3]、抗癌[8]、解热镇痛[9]等药理作用。目前仅对松萝中化学成分的提取和分离进行了研究和报道[10, 11, 12, 13, 14, 15, 16],因此,研究中药松萝中的酚酸类化合物对科学阐释其药效物质基础和质量控制具有重要意义。近年来,UHPLC-Triple-TOF-MS技术广泛应用于中药材及复方多成分的鉴定上,通过超高效液相色谱分离,利用高分辨飞行时间质谱的精确相对分子质量定性优势,能够快速地对中药材中化学成分进行鉴定。目前,尚未见采用高分辨质谱对于松萝化学成分分析研究的相关报道。本实验采用UHPLC-Triple-TOF-MS对松萝中主要酚酸类化学成分进行定性分析,从中初步鉴定了17中酚酸类化学成分,主要分3大类:缩酚酸及其衍生物类化合物、二苯骈呋喃类化合物、多取代单苯环类化合物,并初步总结了其裂解规律。为松萝中化学成分鉴定提供了一种快速、高效的鉴定方法,同时为松萝中化学成分的药效物质基础研究与质量控制提供技术参考。
1 仪器与材料DJU-20A超高效液相色谱仪(日本Shimadzu公司);Triple TOF 5600质谱仪(美国AB Sciex公司);BT125D型十万分之一分析天平(德国Sartorius公司);KQ-5200E台式超声波清洗器(昆山市超声仪器有限公司);铁研船(济南忆健医疗设备有限公司);D-3024 R离心机(美国SCILOGEX公司);甲醇为色谱纯(美国TEDIA公司);水为娃哈哈水;其余试剂均为分析纯。
对照品松萝酸(批号DR140321)购自鼎瑞化工(上海)有限公司,地弗地衣酸(批号L13J6Y17289)购自上海源叶生物科技有限公司,经HPLC峰面积归一化法检测质量分数均大于98%。
松萝样品经河北医科大学生药教研室李连怀教授鉴定为松萝科松萝属植物长松萝Usnea longissim Ach.。标本(150102)存放于河北医科大学药学院。
2 方法 2.1 色谱及质谱条件色谱条件:Phenomenex Luna 3u C18色谱柱(150 mm×2.0 mm,3 μm),流动相甲醇(0.05%甲酸,A)~水(0.05%甲酸-4 mmol/L 乙酸铵,B),梯度洗脱(0~15 min,5%~95% A;15~30 min,95% A),体积流量0.3 mL/min,柱温30 ℃,进样量2 μL。
质谱条件:三重四级杆飞行时间质谱仪(美国AB Sciex公司),采用电喷雾离子源负离子模式,离子喷雾电压−4 500 kV,离子源温度650 ℃,气体1(喷洒气体):414 kPa,气体2(TIS 气体):448 kPa,气帘气:138 kPa,碰撞气体为氮气,去簇电压(DP):−60 V,碰撞能量(CE):−30 eV。质谱测定数据采用TOF MS~Product Ion~IDA模式采集,数据采集范围m/z 50~1 000。
2.2 数据处理使用AB Sciex公司PeakView 1.2软件中XIC Manager,对预测的成分进行筛选和初步鉴定,质量偏差为δ≤5×10−3。
查阅国内外松萝及其同科属植物化学成分研究相关文献报道[10, 11, 12, 13, 14, 15, 16],收集整理了松萝中各类酚酸类化学成分,同时借助Scifinder数据库,建立包括化合物中文名、英文名称、结构式、分子式、精确相对分子质量的松萝中酚酸类化学成分数据库。
2.3 溶液的制备 2.3.1 对照品溶液的制备
精密称取松萝酸、地弗地衣酸对照品适量,精密称定,置10 mL量瓶中,加甲醇溶解并稀释至刻度,分别配制成质量浓度为0.400、0.392 g/L的对照品储备液。分别精密吸取上述对照品储备液,分别稀释100倍,混合,即得混合对照品溶液。
2.3.2 供试品溶液的制备取松萝药材粉末(粉碎后过60目筛)约0.1 g,精密称定,置具塞三角瓶中,精密加入甲醇25 mL,密塞,称定质量,超声处理(功率250 W,频率50 kHz)30 min,取出,放冷至室温,再称定质量,用100%甲醇补足减失的质量,摇匀,以3 000 r/min离心10 min,取上清液,过0.22 μm滤膜,取续滤液,即得。
3 结果 3.1 松萝中酚酸类化学成分鉴别的分析方法利用优化好的UHPLC-Triple-TOF-MS方法对松萝样品进行检测。对于有对照品的化合物,通过比对色谱保留时间和高分辨质谱数据进行确证,并对其裂解规律和裂解途径进行探讨。对于没有对照品的化学成分信息,其推导过程如下:(1)采用XIC Manager软件对分子离子峰的一级高分辨数据推导化合物的分子式;(2)通过得到的分子式在已经建立的松萝中酚酸类化学成分的数据库中进行搜索,获得可能的化合物名称;(3)通过化合物的二级质谱图,参考总结的对照品和文献报道的酚酸类成分的裂解规律,从而提高鉴定的可信度。(4)对于具有相同分子式及二级质谱碎片一致的取代基位置不同的同分异构体,采用Chemdraw软件计算油水分配系数(ClogP),根据其ClogP值和色谱保留时间来确定化合物的结构。按照上述分析方法,共鉴定松萝中17个酚酸类成分,其UHPLC-Triple-TOF-MS提取离子流图和二级质谱图见图 1,分析数据见表 1。
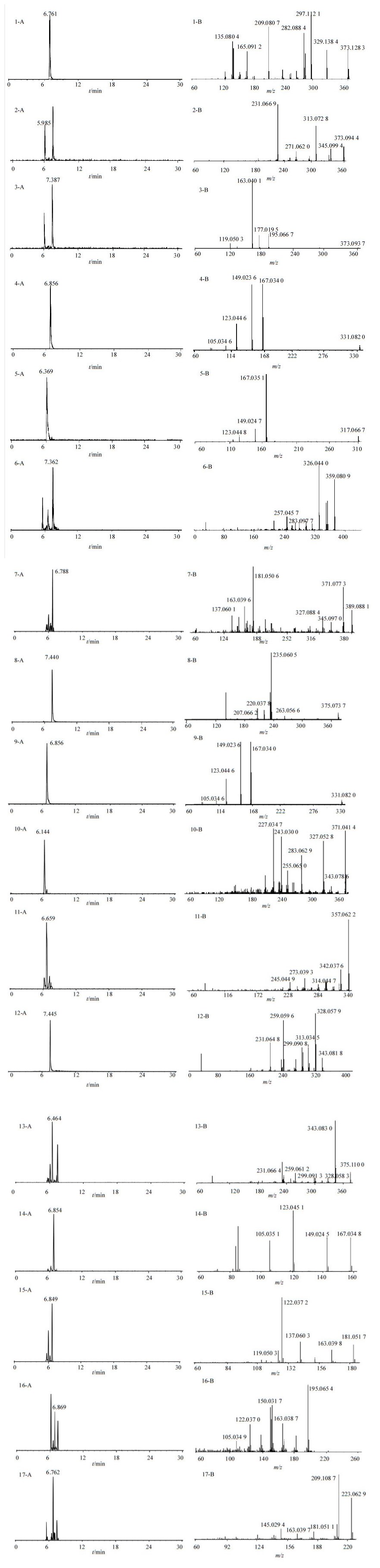 | 1~17对应表 1中17种化合物 1—17 is matched with 17 kinds of compounds in Table 1 图 1 松萝样品中17种酚酸类化学成分的UHPLC-Triple-TOF-MS提取离子流图 (A) 和二级质谱图 (B) Fig.1 UHPLC-Triple-TOF-MS extract ion chromatograms (A) andmass spectra (B) of 17 major phenolic acidsin Usneae Filum |
| 表 1 松萝中各化学成分的鉴定分析 Table 1 Identification analysis of each chemical constituent in Usneae Filum |
以地弗地衣酸为此类化合物代表进行分析,其分子式为C20H22O7,由PeakView 软件计算出精确相对分子质量为374.136 6,其计算 [M-H]− 峰为373.129 3。松萝样品中化合物1的TOF-MS给出负电离模式下 [M-H]−为373.129 5,其质量偏差范围在5×10−3以内,初步推断其为地弗地衣酸。其TOF-MS二级碎片离子有m/z 329.140 1,297.113 0,282.090 4,209.081 4,165.091 9,135.081 4,根据结构和二级碎片离子,推断二级质谱中m/z 329.140 1峰为 [M-H-CO2]−,m/z 297.113 0峰为 [M-H-2CH3-H2O-CO]−,m/z 209.081 4和m/z 165.091 9推断由地弗地衣酸断裂苯酚键而得,推测其质谱裂解途径见图 2。综上,化合物1与地弗地衣酸对照品二级离子碎片和保留时间进行比对,确认为地弗地衣酸。
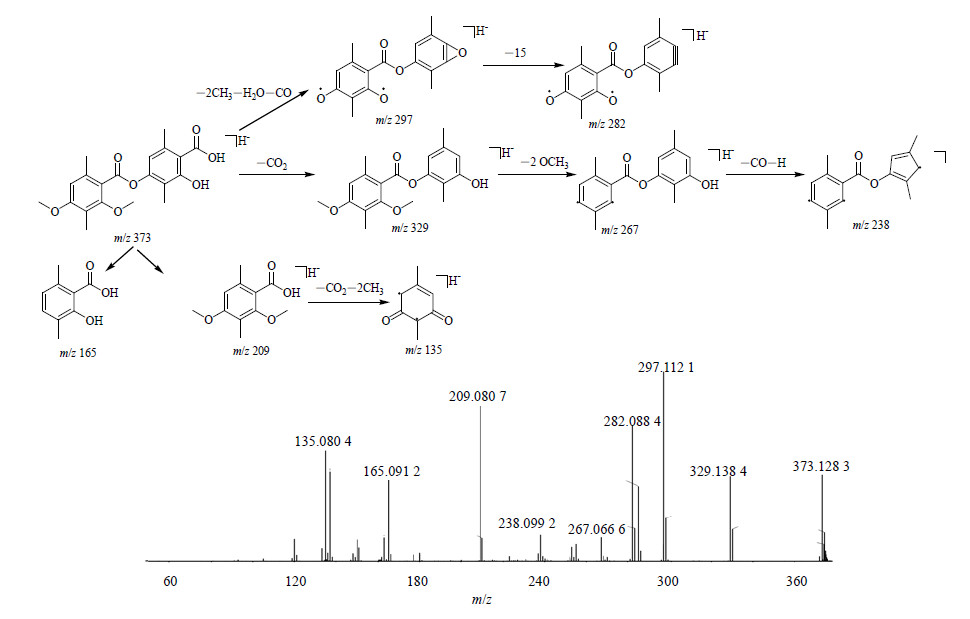 | 图 2 地弗地衣酸质谱裂解过程 Fig.2 Fragmentation pathway of diffractaic acid |
以松萝酸为此类化合物代表进行分析,其分子式为C18H16O7,由PeakView软件计算出精确相对分子质量为344.089 6,计算 [M-H]− 峰为343.082 3。松萝样品中化合物12的TOF-MS给出负电离模式下 [M-H]−为343.183 4,其质量偏差范围在5×10−3内,初步推断其为松萝酸。其TOF-MS二级碎片离子有m/z 328.057 9,313.034 5,299.090 8,259.059 6,231.064 8,根据结构和二级碎片离子,推断二级质谱图上m/z 328.057 9峰为 [M-H-CH3]−,m/z 313.034 5峰为 [M-H-2CH3]−,m/z 299.090 8峰为 [M-H-2CH3-CH2]−,m/z 259.059 6峰为松萝酸在负电模式下发生Retro-Diels-Alder(RDA)重排而得,即 [M-H-C4H4O2]−,m/z 231.064 8峰为m/z 259.059 6峰丢失CO所得,推测其质谱裂解途径见图 3。综上,化合物12与松萝酸对照品保留时间进行比对,确认为松萝酸。
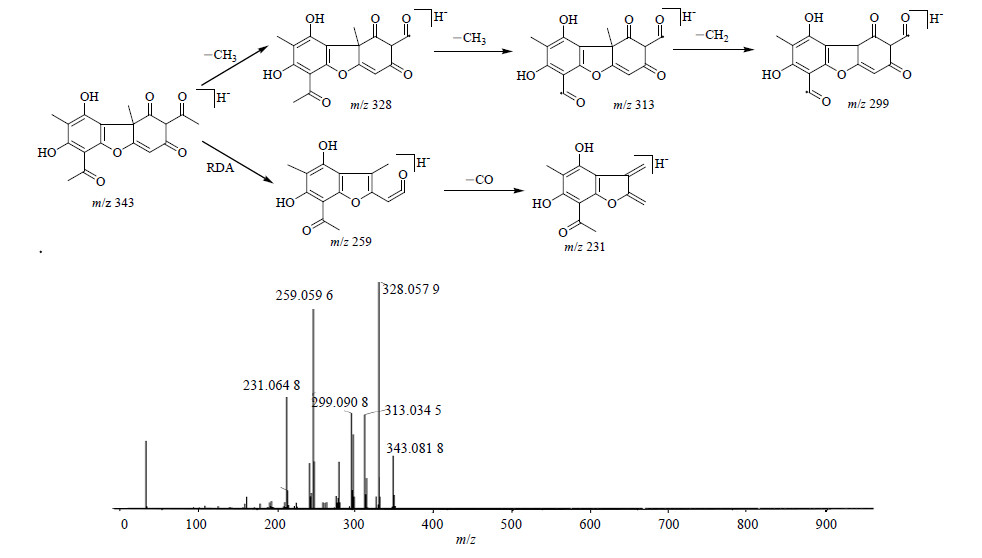 | 图 3 松萝酸的质谱裂解过程 Fig.3 Fragmentation pathway of usnic acid |
由此,此类化合物大部分遵循此质谱裂解规律:一方面,在负电离模式下母核连续丢失CH3、CO等小分子;另一方面,二苯骈呋喃类化合物在质谱的高温高热环境中发生RDA重排,生成相应二级碎片离子[17]。化合物13与松萝酸为同一类化合物,结构也相似,由TOF-MS得到的 [M-H]− 峰及二级质谱碎片离子,结合裂解规律和化合物极性,其结构得到了验证。
3.2.3 多取代单苯环类化合物化合物14~17均属于多取代单苯环类化合物,以苔色酸为代表分析此类化合物的质谱裂解规律。苔色酸分子式为C8H8O4,由PeakView软件计算出精确相对分子质量为168.042 3,计算 [M-H]−峰为167.035 0。松萝样品中化合物14的TOF-MS给出负电离模式下[M-H]−为167.035 7,其质量偏差范围在5×10−3内,初步推断其为苔色酸。其TOF-MS二级碎片离子有m/z 149.024 5,123.045 1,105.035 1,根据结构和二级碎片离子,推断二级质谱图上m/z 149.024 5峰为 [M-H-H2O]−,m/z 123.045 1峰为 [M-H-CO2]−,m/z 105.035 1峰为 [M-H-CO2-H2O]−,推测其质谱裂解途径见图 4。由其二级碎片离子推断为苔色酸。化合物15~17与14结构相似,其二级碎片离子也大致符合母核连续丢失CO2、H2O等小分子。化合物15~17与苔色酸为同一类化合物,由TOF-MS得到的 [M-H]− 峰及二级质谱碎片离子,结合裂解规律和化合物极性,其结构得到了验证。
 | 图 4 苔色酸的质谱裂解过程 Fig.4 Fragmentation pathway of orsellinic acid |
为了获得更好地色谱分离和质谱效应,考察了不同的梯度进行洗脱,由于酚酸类化学成分极性偏小,最终以5%~95%甲醇大梯度进行洗脱,同时因为单纯甲醇和水使得色谱峰有严重拖尾,所以在有机相和水相均加入甲酸来改善峰形。同时,因其电喷雾离子源(ESI)对待测分析物离子化效果不佳,所以考察了在流动相加入不同浓度的乙酸铵,来增强离子化效果,经过多次实验结果比较,最终流动相为甲醇(0.05%甲酸)-水(0.05%甲酸,4 mmol/L乙酸铵)梯度洗脱,定性成分色谱峰型较好。质谱条件的优化比较了负离子模式和正离子模式扫描检测,发现负离子模式电离效果优于正离子模式,同时结合化合物本身结构性质,在负离子模式下电离效果好,且二级质谱完整全面,故选择负离子模式为检测手段。
4.2 质谱裂解规律对于缩酚酸类及其衍生物和二苯骈呋喃类化合物,因为其有对照品作为代表分析物,其裂解规律有一定的可信度。虽然多取代单苯环类化合物没有对照品作为支持,但是,根据4种化合物的二级碎裂信息分析,其裂解规律有一定的参考。同时,松萝中药材中成分复杂,且同分异构体很多,而本实验中只鉴定了松萝中17种量较高的酚酸类化学成分,对于其他一些出现在提取离子流图中的色谱峰,由于浓度较低,导致无法产生二级碎片离子的化合物,并没有进行定性分析。
4.3 小结本实验共鉴定松萝中17种酚酸类化学成分,主要分3大类:缩酚酸及其衍生物类化合物、二苯骈呋喃类化合物、多取代单苯环类化合物。首先,对于缩酚酸及其衍生物类化合物,主要发生八元环过渡态氢重排β-裂解,从而断裂得2部分,在此基础上进行失水和失甲醇[19],同时,一小部分直接在母核上连续丢失CO2、OCH3、CO或组合丢失。其次,对于二苯骈呋喃类化合物,最主要是在质谱的高温高热环境中发生RDA重排,生成相应二级碎片离子。最后,对于多取代单苯环类化合物,主要是母核连续丢失CO2、H2O等小分子。
本实验在负电离TOF MS~Product Ion~IDA模式下,采用UHPLC-Triple-TOF-MS对松萝中酚酸类化学成分进行了快速分析鉴别,本实验共鉴定松萝中17种酚酸类化学成分,这17种化学成分均为地衣类植物所特有的,为进一步的化学成分药理研究和定量研究提供一定参考。该方法能够快速准确地对松萝中酚酸类化合物进行分析,并在一定程度上,保证了中药化学成分的整体性,为中药松萝的药效物质基础研究,快速准确鉴定与质量控制提供了参考依据。
| [1] | 江苏新医学院. 中药大辞典 (上册) [M]. 上海: 上海人民出版社, 1997. |
| [2] | Muhammad I C, Azizuddin, Saima J, et al. Bioactive phenolic compounds from a medicinal lichen, Usnea longissima[J]. Phytochemistry, 2005, 66(19): 2346-2350. |
| [3] | 苏印泉, 王海宏, 马养民, 等. 西藏长松萝浸提物抑菌作用研究[J]. 西北林学院学报, 2006, 21(5): 154-155. |
| [4] | Thallita K R, Fares Z C, Laura M V, et al. Redox characterization of usnic acid and its cytotoxic effect on human neuron-like cells (SH-SY5Y)[J]. Toxicol In Vitro, 2012, 26(2): 304-314. |
| [5] | Shtroa A A, Zarubaeva V V, Luzinab O A, et al. Novel derivatives of usnic acid effectively inhibiting reproduction of influenza A virus[J]. Bioorg Med Chem, 2014, 22(24): 6826-6836. |
| [6] | Bayir Y, Odabasoglu F, Cakir A, et al. The inhibition of gastric mucosal lesion, oxidative stress and neutrophil-infiltration in rats by the lichen constituent diffractaic acid[J]. Phytomedicine, 2006, 13(8): 584-590. |
| [7] | 拉喜那木吉拉, 包海鹰, 图力古尔. 松萝属地衣类化学成分及药理活性研究进展[J]. 中国中药杂志, 2013, 38(4): 539-545. |
| [8] | 靳菊情, 丁东宁, 欧阳雪, 等. 松萝酸的提取和抗癌活性研究[J]. 西北药学杂志, 1996, 11(5): 211-212. |
| [9] | Okuyama E, Umeyama K, Yamazaki M, et al. Usnic acid and diffractaic acid as analgesic and antipyretic components of Usnea dffracta[J]. Planta Med, 1995, 61(2): 113-115. |
| [10] | 孙汉董, 钮芳娣, 林中文, 等. 四种药用地衣的化学成分[J]. 植物学报, 1990, 32(10): 783-788. |
| [11] | 冯 洁, 杨秀伟, 苏思多, 等. 长松萝化学成分研究[J]. 中国中药杂志, 2009, 34(6): 708-711. |
| [12] | 孙汉董, 林中文, 沈晓羽, 等. 七种云南地衣植物的化学成分[J]. 云南植物研究, 1986, 8(4): 483-488. |
| [13] | Huan Y Q, Yuan P J, Yan P S. A new depsidone from Usnea diffracta[J]. Chin Chem Lett, 2009, 20: 187-189. |
| [14] | Honda N K, Pavan F R, Coelho R G, et al. Antimycobacterial activity of lichen substances[J]. Phytomedicine, 2010, 17(5): 328-332. |
| [15] | Mallavadhani U V, Sudhakar A V S, Anita M, et al. Phenolic and steroidal constituents of the lichen Usnea longissimi[J]. Biochem Syst Ecol, 2004, 32(1): 95-97. |
| [16] | 牛东玲, 王立松, 张颖君, 等. 地衣次生代谢产物及其生物活性研究进展[J]. 天然产物研究与开发, 2007, 19(6): 1079-1086. |
| [17] | 殷彩霞, 李 聪, 彭 莉, 等. 云南丽江长茎松萝酚性成分研究[J]. 云南师范大学学报, 1996, 16(3): 56-61. |
| [18] | 丛浦珠, 李笋玉. 天然有机质谱学 [M]. 北京: 中国医药科技出版社, 2003. |
 2016, Vol. 47
2016, Vol. 47


