2. 黑龙江生物科技职业学院, 黑龙江 哈尔滨 150025;
3. 黑龙江中医药大学, 黑龙江 哈尔滨 150040
2. Heilongjiang Vocational College of Biology Science and Technology, Harbin 150025, China;
3. Heilongjiang University of Chinese Medicine, Harbin 150040, China
黑果腺肋花楸Aronia melanocarpa Elliot为蔷薇科腺肋花楸属落叶灌木,是集食用、药用、园林和生态价值于一身的珍贵树种,果实为紫黑色浆果[1-2]。腺肋花楸类植物的果实中富含黄酮类和酚酸类成分,以花青素、原花青素及其衍生物为主[2]。研究表明其中的原花青素等多酚化合物在抗氧化活性、防治心血管疾病、抗癌、降血糖等方面具有良好的药理活性[3-5]。目前为止对黑果腺肋花楸的种植栽培技术、其浆果中化学成分以及生物活性等研究较多[6-8],但是目前还尚未见黑果腺肋花楸浆果中有效成分的量研究报道。常用测定原花青素类或黄酮类的定量方法有高效液相色谱法[9-12]、高效液相色谱-串联质谱法[13-14]和可见分光光度法[15-16]。其中,高效液相色谱法和超高效液相色谱-串联质谱法可用于多个单体化合物的同时定量分析[9-14],而分光光度法能测定总量[15-16]。本实验以不同批次的黑果腺肋花楸的浆果为研究对象,采用UPLC技术,建立同时测定原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素5种有效成分的方法,此方法简便、快捷、准确,专属性强,对于黑果腺肋花楸的开发应用具有十分重要的意义。
1 仪器与试药Waters Acquity UPLC®系统(包括二元超高压溶剂系统、自动进样恒温样品管理器、二极管阵列检测器、Empower 3色谱工作站,美国Waters公司);LE204E/02电子天平(梅特勒-托利多仪器上海有限公司);TGL-16G台式离心机(上海安亭科学仪器厂制造);超声清洗器(深圳市洁盟清洗设备有限公司)。
原花青素B1对照品(批号MUST-15090611,中国科学院成都生物研究所,质量分数为98%);原花青素B2(批号MUST-15032610,中国科学院成都生物研究所,质量分数98.53%);原花青素B4(批号MUST-15092910,中国科学院成都生物研究所,质量分数98.95%);芦丁(批号20141026,上海源叶生物科技有限公司,质量分数大于98%,);槲皮素(批号100081-200406,中国食品药品检定研究院,质量分数98.3%);甲醇、乙腈(色谱级,赛默飞世尔科技有限公司);水为高纯水、其他试剂均为分析纯。3批黑果腺肋花楸浆果(批号分别为20150901、20150902和20150903)均采收于黑龙江省黑河市林区,经哈尔滨商业大学中药学教研室曲中原副教授鉴定为蔷薇科腺肋花楸属黑果腺肋花楸Aronia melanocarpa Elliot的浆果果实。
2 方法与结果 2.1 对照品溶液的制备准确称取原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素对照品适量,于25 mL量瓶中,用甲醇完全溶解,稀释并定容至刻度,摇匀,制成质量浓度分别为221、5 000、270、740、209 μg/mL的对照品储备液,置4 ℃冰箱里保存备用。
2.2 供试品溶液的制备取新鲜黑果腺肋花楸浆果10.0 g,精密称定,置具塞锥形瓶中,捣碎,精密加入20%酸化甲醇30 mL,称定质量,超声处理(功率250 W,频率50 kHz)30 min,取出,再称定质量,用20%酸化甲醇补足减失的质量,抽滤除渣,甲醇定容至50 mL,摇匀,用0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.3 色谱条件色谱柱为ACQUITY UPLC HSS T3 C18色谱柱(100 mm×2.1 mm,1.8 μm);流动相为甲醇(A)-0.03%磷酸水溶液(B),梯度洗脱,洗脱程序见表 1;体积流量0.2 mL/min;柱温35 ℃;进样量5 μL。
|
|
表 1 洗脱程序 Table 1 Elution procedure |
2.4 线性关系考察
分别准确吸取不同体积原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素对照品储备液于6个10 mL量瓶中,用甲醇稀释至刻度,摇匀,即得到6组混合对照品溶液。分别吸取6组混合对照品溶液5 μL进样,按照“2.3”项下色谱条件测定其峰面积,以对照品在混合溶液中的质量浓度(C)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,得到的线性回归方程、相关系数、线性范围见表 2,实验结果表明峰面积与质量浓度呈良好的线性关系。
|
|
表 2 5种成分的线性回归方程、相关系数和线性范围 Table 2 Linear regression equations, correlation coefficients, and linear ranges of five constituents |
2.5 精密度试验
取混合对照品溶液,按“2.3”项色谱条件下连续进样5次,测定原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素峰面积的RSD分别为1.13%、0.95%、1.81%、1.43%、1.91%,表明仪器精密度良好。
2.6 重复性试验精密称取同一批(批号20150901)黑果腺肋花楸浆果样品5份,每份约10.0 g,按“2.2”项方法制备供试品溶液,按上述色谱条件进行测定,计算样品中原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素质量分数的RSD分别为1.41%、1.05%、1.67%、1.47%和1.32%,实验结果表明重复性良好。
2.7 稳定性试验取同一批(批号20150901)样品溶液,分别放置0、2、4、6、8 h注入液相色谱仪,按“2.3”项色谱条件下进样检测。计算原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素峰面积的RSD分别为0.162%、0.99%、1.64%、1.53%和1.29%。结果表明样品溶液在8 h内稳定性良好。
2.8 加样回收率试验精密称取已测定的黑果腺肋花楸浆果样品5份,每份10.0 g,分别精密加入与样品相当的原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素1.34、30.76、2.05、1.35和0.81 mg。按“2.2”项制备溶液,按“2.3”项色谱条件测定,以外标法计算回收率。结果原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素平均回收率分别为101.23%、99.64%、102.31%、98.74%、103.53%,RSD分别为2.13%、1.23%、2.89%、2.96%、2.64%。
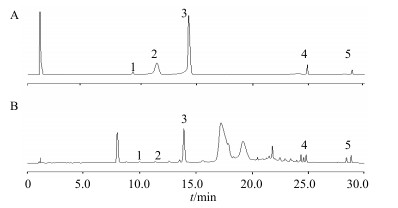
2.9 样品测定按“2.2”项下方法制备黑果腺肋花楸浆果供试品溶液,注入高效液相色谱仪,按“2.3”项色谱条件下进行测定。混合对照品和样品的UPLC色谱图见图 1,记录原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素峰面积,代入回归方程计算,测定结果见表 3。
|
1-原花青素B1 2-原花青素B2 3-原花青素B4 4-芦丁5-槲皮素 1-procyanidin B1 2-procyanidin B2 3-procyanidin B4 4-rutin 5-quercetin 图 1 混合对照品(A)和供试品溶液(B)的色谱图 Fig.1 Chromatograms of mixed reference substances (A) and sample (B) |
|
|
表 3 样品中5种成分的测定结果 Table 3 Determination of five constituents |
3 讨论
利用二极管阵列检测器将5种对照品溶液进行一次测定运行,在波长200~400 nm内同时采集210、254、280、315、360 nm波长色谱图,结合文献报道[9-11],发现原花青素B1、原花青素B2和原花青素B4均在波长280 nm处有最大吸收,故选择280 nm为检测波长。芦丁和槲皮素在360 nm波长下色谱峰的峰形对称,达到定量分析要求,因此确定芦丁和槲皮素检测波长为360 nm。
根据文献报道[9, 11]考察了甲醇-水、乙腈-水和甲醇-乙腈-水为流动相系统,又考虑到待测物显弱酸性,加适量酸能抑制其电离,故在水中加入不同体积分数的磷酸或甲酸溶液,分别做等度洗脱或梯度洗脱,观察样品中各个有效成分的分离情况,当甲醇-0.03%磷酸水溶液作为流动相,梯度洗脱时,原花青素B1、原花青素B2、原花青素B4、芦丁和槲皮素峰形良好能达到基线分离,并且与其他杂质峰得到了良好的分离。经方法学考察,该方法线性关系、精密度和稳定性均良好,表明该方法确实可行,杂质干扰小,专属性较高。
考察了甲醇和乙醇2种提取溶剂,以5种成分的测定结果为指标,结果表明前者优于后者;又以不同浓度甲醇为提取溶剂考察了回流法、浸提法、超声波法不同方法的提取效果,结果表明这几种方法无明显差异;分别考察了甲醇超声提取30、45、60 min提取时间,结果表明三者也无明显差异,分析其原因黑果腺肋花楸浆果富含40%以上的果汁,有效成分易于浸出。又考虑到原花青素在pH值小于或等于3的酸性条件下稳定[17-18],故提取方法最终确定为20%酸化甲醇(pH为2.5)超声30 min。
黑果腺肋花楸的果实对心脏病、高血压等心脑血管疾病具有特殊的疗效,有很好的开发利用前景。本实验建立的方法简便快速、准确可靠、重现、精密度、稳定性、回收率都较好,为黑果腺肋花楸浆果资源的深度开发利用、药用价值研究以及质量评价提供了科学依据。
| [1] | Slimestad R, Torskangerpoll K, Nateland H S, et al. Flavonoids from black chokeberries, Aronia melanocarpa[J]. J Food Compos Anal, 2005, 18(1): 61–68. DOI:10.1016/j.jfca.2003.12.003 |
| [2] | 于明, 李铣, 张丽, 等. 黑果腺肋花楸果实的化学成分[J]. 中草药, 2010, 41(4):544–546. |
| [3] | Appel K, Meiser P, Millán E, et al. Chokeberry (Aronia melanocarpa (Michx.) Elliot) concentrate inhibits NF-κB and synergizes with selenium to inhibit the release of pro-inflammatory mediators in macrophages[J]. Fitoterapia, 2015, 105: 73–82. DOI:10.1016/j.fitote.2015.06.009 |
| [4] | Badescu M, Badulescu O, Badescu L, et al. Effects of Sambucus nigra and Aronia melanocarpa extracts on immune system disorders within diabetes mellitus[J]. Pharm Biol, 2015, 53(4): 533–539. DOI:10.3109/13880209.2014.931441 |
| [5] | 宓伟, 练武, 尹淑英, 等. 山楂原花青素及维生素C对胰岛素抵抗大鼠肝脏氧化应激的影响[J]. 中草药, 2016, 47(4):625–629. |
| [6] | 曾光. 黑果腺肋花楸嫩枝扦插育苗技术[J]. 辽宁林业科技, 2016(1):71–72. |
| [7] | 楚景月. 黑果腺肋花楸高产栽培关键技术[J]. 防护林科技, 2015, 136(1):105–106. |
| [8] | 于雪, 胡文忠, 姜爱丽, 等. 黑果腺肋花楸营养物质与功效的研究进展[J]. 食品工业科技, 2016, 37(10):396–400. |
| [9] | 赵辰砚, 王淼, 张冠文, 等. RP-HPLC法测定葡萄籽提取物中原花青素B1和B2的含量[J]. 沈阳药科大学学报, 2014, 31(1):32–35. |
| [10] | 陈燕, 乔洪翔, 叶剑锋, 等. 银杏叶制剂中原花青素的HPLC鉴别方法研究[J]. 中草药, 2013, 44(13):1774–1778. |
| [11] | 刘知远, 沈廷明, 吴仲玉. RP-HPLC法同时测定福建产金线莲中槲皮素、山柰素、异鼠李素的量[J]. 中草药, 2015, 46(3):432–434. |
| [12] | 木合塔尔·吐尔洪, 买买提·吐尔逊, 热萨莱提·伊敏, 等. RP-HPLC法同时测定昆仑雪菊中绿原酸、芦丁、槲皮素和木犀草素的量[J]. 中草药, 2016, 47(9):1601–1604. |
| [13] | 单岩, 李永仙, 郑飞云, 等. 原花青素对照品组份的UPLC-MS及RP-HPLC分析[J]. 分析试验室, 2012, 31(5):76–79. |
| [14] | 许文, 傅志勤, 林婧, 等. UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J]. 药学学报, 2014, 49(12):1711–1717. |
| [15] | Prior R L, Fan E, Ji H P, et al. Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders[J]. J Sci Food Agric, 2010, 90(9): 1473–1478. DOI:10.1002/jsfa.v90:9 |
| [16] | 宋德群, 孟宪军, 王晨阳, 等. 蓝莓花色苷的pH示差法测定[J]. 沈阳农业大学学报, 2013, 44(2):231–233. |
| [17] | 国石磊, 朱凤妹, 王娜, 等. 黑果腺肋花楸花色苷树脂纯化工艺及其稳定性研究[J]. 天然产物研究与开发, 2015, 27(9):1636–1642. |
| [18] | Mayer-Miebach E, Adamiuk M, Behsnilian D. Stability of chokeberry bioactive polyphenols during juice processing and stabilization of a polyphenol-rich material from the by-product[J]. Agriculture, 2012, 2(4): 244–258. DOI:10.3390/agriculture2030244 |
 2016, Vol. 47
2016, Vol. 47



