造血干细胞及祖细胞增殖、分化是血细胞正常发育成熟、维持正常造血功能的基础。研究报道,大剂量放射线和化疗药物如环磷酰胺等对骨髓造血功能具有抑制作用,其机制主要是放射线和化疗药物可诱导骨髓细胞衰老,从而导致造血干、祖细胞增殖分化功能降低[1-2]。因此,促进造血干细胞和祖细胞的增殖和分化是促进血细胞生成的重要途径。黄芪和当归配伍具有补气生血的功效,其中最有名的是黄芪当归配伍比例为5:1的当归补血汤,具有促进造血的作用[3],可用于各种原因贫血的治疗。此外,还具有增强免疫[4]、心血管保护等多种作用[5]。研究表明,当归-黄芪配伍在1:5~5:1均对促进造血功能的恢复具有协同作用[6]。当归补血汤的补气、补血作用主要来源于当归,黄芪在当归补血汤中的作用可能是促进红系祖细胞的增殖活性[7]。前期研究发现,黄芪和当归配伍比例在5:1、2.5:1、1:1、1:2.5、1:5、1:10时,可升高外周血细胞数,增加血清造血生长因子的量、骨髓有核细胞数和骨髓造血组织面积,降低脾指数,尤以黄芪和当归1:1、1:2.5、1:5配伍时发挥促造血的作用最强。但黄芪和当归二者配伍的最佳比例及补血作用机制尚未完全弄清楚,研究结果不一,导致临床应用也不一致。为进一步明确黄芪和当归配伍促造血作用的合理配伍及其作用机制,本实验采用骨髓造血功能抑制小鼠模型,研究了黄芪和当归配伍对造血祖细胞增殖和骨髓细胞衰老的影响,为其合理配伍及临床应用提供参考。
1 材料 1.1 实验动物SPF级ICR雄性小鼠,体质量18~22 g,由湖南中医药大学实验动物中心提供,合格证号43004700005819。饲养于室温24℃,湿度50%的环境。
1.2 药物与试剂黄芪(产地内蒙古)、当归(产地甘肃)均由湖南中医药大学附一医院药剂科统一购进并经左亚杰教授鉴定,黄芪为豆科植物蒙古黄芪Astragalus membranaceus Bunge var. monggholicus (Bunge) P. K. Hsiao的干燥根、当归为伞形科植物当归Angelica sinensis (Oliv.) Diels的干燥根,原植物保存于湖南中医药大学第一附属医院。注射用环磷酰胺(CTX),江苏盛迪医药股份有限公司,批号15072925;重组人粒细胞巨噬细胞集落因子(rhGM-CSF),山东齐鲁制药有限公司,批号201503002TJ;重组人促红细胞生成素(rhEPO):以色列PROSPEC公司,批号311PEPO28;重组小鼠促血小板生成素(rmTPO),以色列PROSPEC公司,批号1212PMTPO;重组小鼠粒单系集落刺激因子(rmGM-CSF),美国PeproTech公司,批号107MGMC01;重组小鼠白细胞介素-3(rmIL-3),以色列PROSPEC公司,批号107PMIL3;乙酰胆碱酯酶染色液,上海哈灵生物科技有限公司,批号HL0111A16;β-半乳糖苷酶试剂盒,碧云天生物技术有限公司,批号C0602。
1.3 仪器SW-CJ-IFD型超净工作台(苏州苏洁净化设备有限公司);SHEL-LAB2300型CO2培养箱(美国);TGL16型高速冷冻离心机(湖南湘仪离心机仪器有限公司);IX51型倒置显微镜(日本Olympus公司);HH-ZK1型恒温水浴锅(巩义市予华仪器有限责任公司)。
2 方法 2.1 不同比例当归和黄芪配伍提取物的制备根据《中国药典》2015年版中黄芪用量为9~30 g,当归用量为6~12 g,取黄芪成人临床常用量为20 g,当归临床成人常用量为10 g,换算成小鼠等效剂量为黄芪3 g/kg,当归1.5 g/kg。分别取药材适量,以水热回流法提取2次(第1次8倍量水,提取1 h;第2次6倍量水,提取1 h),合并2次提取液,滤过药液,60℃真空减压浓缩得各药液,各当归和黄芪配伍(当归-黄芪)组生药质量浓度为1.08 g/mL,黄芪提取物生药质量浓度为0.6 g/mL,当归提取物生药质量浓度为0.3 g/mL。加入0.1%苯甲酸钠,冷藏备用。
2.2 分组和给药方法取小鼠随机分为9组,每组9只,分别为对照组、模型组、单用黄芪(6 g/kg)组、单用当归(3 g/kg)组、黄芪-当归(10:1)组(黄芪9.8 g/kg+当归1 g/kg)、黄芪-当归(5:1)组(黄芪9 g/kg+当归1.8 g/kg)、黄芪-当归(1:1)组(黄芪5.4 g/kg+当归5.4 g/kg)、黄芪-当归(1:5)组(黄芪1.8 g/kg+当归9 g/kg)、阳性对照组(rhG-CSF,45 μg/kg)。实验动物屏障环境适应性饲养5 d后开始ig给药,每天1次,连续8 d。对照组和模型组每天ig蒸馏水10 mL/kg。阳性对照组在第1~5天每天ig等量蒸馏水,第6~8天每天sc rhG-CSF。其他给药组每天ig相应药物10 mL/kg。采用ip CTX方法造成骨髓造血功能抑制模型[8],除对照组外,其余各组于给药的第4、5、6天ip CTX生理盐水溶液(40 mg/kg),每天1次,造成小鼠骨髓造血功能抑制模型。注射CTX后同前给药。实验第9天颈椎脱臼处死小鼠,无菌环境下取小鼠股骨骨髓细胞,制成全骨髓细胞悬液。
2.3 骨髓造血祖细胞培养参照文献方法[9]将制备好的骨髓有核细胞与培养体系充分混合后加入6孔细胞培养板内,置于37℃、5% CO2、饱和湿度下进行细胞培养。每孔含培养体系1 mL,培养体系组成见表 1。红细胞集落形成单位(CFU-E)培养3 d观察计数,红系爆式集落形成单位(BFU-E)、粒细胞-单核细胞集落形成单位(CFU-GM)、巨核细胞集落形成单位(CFU-MK)培养7 d观察计数。
|
|
表 1 CFU-GM、CFU-MK、CFU-E和BFU-E培养体系的组成 Table 1 Constitution of CFU-GM, CFU-MK, CFU-E, and BFU-E culture system |
2.4 造血祖细胞集落鉴定与计数
CFU-E、BFU-E经二甲氧基联苯胺染色法[9]鉴定呈红色者为阳性集落。CFU-MK经乙酰胆碱酯酶染色[9]鉴定呈棕色者为阳性集落。CFU-GM经氯乙酸AS-D萘酚酯酶染色法[10]鉴定呈鲜红色者为阳性集落。各造血祖细胞鉴定见图 1。CFU-E>8个细胞、BFU-E>50个细胞者计为1个集落;CFU-GM>50个细胞者计为1个集落、CFU-MK>3个细胞者计为1个集落。显微镜下计数每孔造血祖细胞的集落形成数。
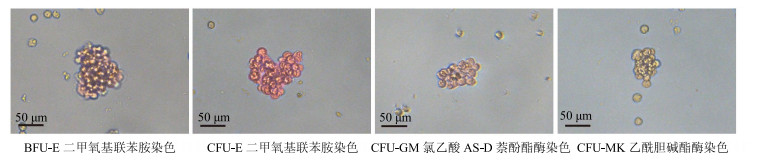
|
图 1 各系祖细胞染色鉴定 Fig.1 Stain identification of progenitor cells |
2.5 β-半乳糖甘酶染色法测定骨髓有核细胞衰老率
将制备好的骨髓细胞以淋巴细胞分离液分离,制成骨髓有核细胞悬液,采用β-半乳糖苷酶染色法染色计数观察细胞形态,阳性细胞β-半乳糖苷酶染色细胞胞浆内见蓝色颗粒,阴性细胞未着色[11]。计数阳性细胞,计算阳性细胞率。
2.6 统计分析实验数据采用SPSS 22.0统计软件进行分析,所有数据均采用x±s表示,多组间均数比较采用单因素方差分析,组间两两比较方差齐者用LSD检验,方差不齐者用DunnerT3检验。
3 结果 3.1 各组造血祖细胞集落形成数的比较与对照组比较,CTX能显著降低CFU-GM、CFU-MK、CFU-E、BFU-E的集落数(P<0.01)。与模型组比较,阳性对照药组CFU-GM集落数显著升高(P<0.01),但CFU-MK、CFU-E、BFU-E集落数无显著增加(P>0.05);单用黄芪组CFU-GM、CFU-MK、CFU-E、BFU-E集落数无显著变化(P>0.05);单用当归组CFU-GM、CFU-MK、CFU-E、BFU-E集落数显著增加(P<0.01);在黄芪-当归各配伍组中,黄芪-当归(10:1)组CFU-MK、CFU-E、BFU-E集落数显著增加(P<0.05),但CFU-GM集落数无显著变化(P>0.05);黄芪-当归(5:1)组、黄芪-当归(1:1)组、黄芪-当归(1:5)组CFU-GM、CFU-MK、CFU-E、BFU-E集落数均显著增加(P<0.01)。与黄芪-当归(1:1)组比较,单用黄芪组、单用当归组、黄芪-当归(10:1)组、黄芪-当归(5:1)组、黄芪-当归(1:5)组的CFU-GM、CFU-E、BFU-E集落数均显著降低(P<0.01),且单用黄芪组、黄芪-当归(10:1)组、黄芪-当归(1:5)组的CFU-MK集落数也低于黄芪-当归(1:1)组(P<0.01),但单用当归组、黄芪-当归(5:1)组的CFU-MK集落数与黄芪-当归(1:1)组比较无显著性差异(P>0.05)。结果见表 2。
|
|
表 2 各组造血祖细胞集落数的比较(x±s, n=9) Table 2 Comparison on colony formation of HPC among groups (x±s, n=9) |
3.2 黄芪-当归配伍对骨髓有核细胞衰老的影响
阳性细胞胞质呈蓝色(图 2)。表 3显示,模型组衰老细胞阳性率显著高于对照组(P<0.01)。与模型组比较,阳性药物组衰老细胞阳性率无显著差异(P>0.05);单用黄芪组、单用当归组、黄芪-当归(10:1)组、黄芪-当归(5:1)组、黄芪-当归(1:1)组、黄芪-当归(1:5)组骨髓有核细胞衰老阳性率显著降低(P<0.05、0.01)。黄芪-当归(10:1)组、单用当归组、单用黄芪组、黄芪-当归(5:1)、黄芪-当归(1:5)组衰老细胞阳性率均高于黄芪-当归(1:1)组(P<0.05、0.01)。
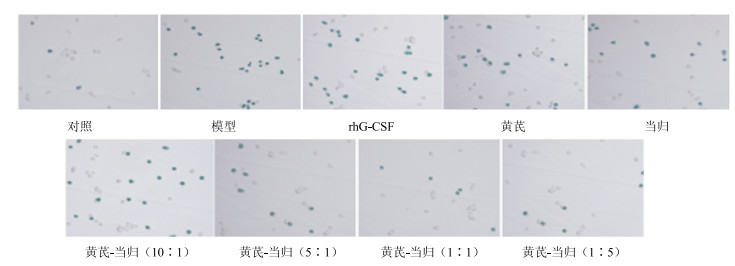
|
图 2 各组骨髓有核细胞β-半乳糖苷酶染色 Fig.2 β-galactosidase staining among groups |
|
|
表 3 各组衰老细胞阳性率的比较(x±s, n=4) Table 3 Comparison on senescence rate among groups (x±s, n=4) |
4 讨论
李东垣的当归补血汤用黄芪一两、当归二钱,“重用黄芪大补脾肺之气,以裕生血之源;更用当归益血和营,以使阳生阴长,气旺血生”,是补气生血的名方。现代对当归补血汤的补血作用及其机制进行了大量的研究。研究表明,当归补血汤可显著增加CFU-MK集落的形成,促进血小板的恢复[12]。当归补血汤含药血清能够促进骨髓粒系、红系造血祖细胞的增殖与分化,促进骨髓有核细胞DNA的合成[13]。也有研究发现,当归补血汤中的多糖和非多糖类成分均能促进造血,其中当归多糖可促进血虚动物骨髓有核细胞DNA合成,刺激造血干、祖细胞增殖,而黄芪多糖无明显刺激作用。不同浓度的非多糖成分促造血作用不同,以阿魏酸作用最显著[14]。当归多糖可增加血虚小鼠骨髓有核细胞数量,促进DNA合成[15],改善血虚小鼠红细胞和血红蛋白的水平[16]。以往的研究均认为,当归补血汤黄芪和当归的配伍比例以5:1为好。近期对其配伍研究表明,当归-黄芪在1:5~5:1配伍均有协同增效作用,尤其在当归10~40 g、黄芪90~180 g及当归50~100 g、黄芪20~100 g表现出很强的协同作用[6]。不同剂型当归补血汤及不同配伍下,当归补血汤标准汤剂、当归补血汤整方颗粒剂、黄芪-当归5:1、1:1、5:1颗粒配方剂均能明显增加造血祖细胞集落产率[17]。
本研究结果表明,单用当归及黄芪-当归5:1、1:1、1:5配伍可显著增加骨髓抑制小鼠红系、粒系、巨核系3系祖细胞产率,而单用黄芪无明显促进作用。尤以黄芪-当归1:1配伍对BFU-E、CFU-E、CFU-GM集落形成的促进作用为强。提示具有直接促造血作用的药物主要是当归,而黄芪的直接促造血作用弱,黄芪配伍当归可增强其促造血作用,这与以往的研究相符。二者在一定的比例配伍下具有较好的促造血作用,尤以黄芪-当归1:1配伍的促造血作用为佳。这与以往关于黄芪-当归5:1配伍促造血作用最强的报道[22]不同,也提示黄芪和当归在一定的剂量范围配伍具有促造血作用,二者配伍不是绝对的5:1配伍。二者配伍促进骨髓造血功能抑制后造血祖细胞的增殖和定向分化是其发挥补血作用的主要机制之一。
血细胞的生成是一个持续的过程。众多血细胞由于寿命短,需要造血干细胞、祖细胞不断增殖和定向分化来产生新的血细胞,以维持血细胞数量和生命活动的需要。由于造血功能完全依赖骨髓中微量的造血干细胞,因而,造血干细胞衰老必将导致造血功能低下。辐射、化疗药物等由于对骨髓造血微环境破坏,作用于造血前体细胞和处于静止期的干细胞,引起骨髓造血干细胞、祖细胞凋亡与分化功能障碍,细胞呈衰老表现[18]。因此,造血干细胞、祖细胞衰老反映了其增殖分化功能障碍。拮抗造血干细胞、祖细胞衰老,促进其功能的恢复,是恢复骨髓造血功能的重要手段。多项研究发现黄芪中的黄芪多糖、当归中的当归多糖可以延缓造血干细胞衰老[19-21]。但有关黄芪和当归配伍对造血干细胞衰老有何影响还不清楚。本研究也对黄芪当归不同配伍对骨髓细胞衰老的影响进行了探讨。结果显示,单用黄芪、单用当归、黄芪-当归10:1、黄芪-当归5:1、黄芪-当归1:1、黄芪-当归1:5各组衰老细胞阳性率均低于模型组。且以黄芪-当归1:1配伍的骨髓有核细胞的衰老细胞阳性率最低,说明黄芪当归配伍均抑制CTX引起的骨髓有核细胞衰老,黄芪-当归1:1配伍的作用最强。提示黄芪当归配伍促进骨髓造血细胞增殖分化的作用可能与两药合用后可对抗化疗药对骨髓有核细胞的毒性,延缓骨髓细胞衰老,促进造血干细胞、祖细胞功能恢复有关。
| [1] | Toussaint O, Medrano E E, Zglinicki T V. Cellular and molecular mechanisms of stress-induced premature senescence (SIPS) of human diploid fibroblasts and melanocytes[J]. Exp Gerontol, 2000, 35(8): 927–945. DOI:10.1016/S0531-5565(00)00180-7 |
| [2] | 田杰, 于沛, 孙文宣, 等. 环磷酰胺对正常小鼠骨髓造血细胞的影响及其作用机制[J]. 中国实验血液学杂志, 2012, 20(6):1316–1321. |
| [3] | Yang X, Huang C G, Du S Y, et al. Effect of Danggui Buxue Tang on immune-mediated aplastic anemia bone marrow proliferation mice[J]. Phytomedicine, 2013, 21(5): 640–646. |
| [4] | Liu Y, Zhang H G, Li X H. A Chinese herbal decoction, Danggui Buxue Tang, improves chronic fatigue syndrome induced by food restriction and forced swimming in rat[J]. Phytother Res, 2011, 25(12): 1825–1832. DOI:10.1002/ptr.v25.12 |
| [5] | Tsim K W K. Danggui Buxue Tang (Chinese Angelica Decoction):A sample trial in TCM standardization[J]. Asia-Pacific Biotech News, 2004, 8(23): 1316–1321. DOI:10.1142/S0219030304002277 |
| [6] | Shi X Q, Shang E X, Tang Y P, et al. Interaction of nourishing and tonifying blood effects of the combination of Angelicae sinensis Radix and Astragali Radix studied by response surface method[J]. Acta Pharm Sin, 2012, 47(10): 1375–1383. |
| [7] | 范颖, 陈信义. 当归补血汤源流及配伍效用关系研究进展[J]. 中国实验方剂学杂志, 2006, 12(10):62–65. |
| [8] | Yan S, Xie Y, Zhu B, et al. Effect comparison of different formulation of Dang-Gui-Bu-Xue-Tang on myelosuppression mouse[J]. Asian Pac J Trop Med, 2011, 4(7): 556–559. DOI:10.1016/S1995-7645(11)60145-4 |
| [9] | 徐有恒, 王绮如. 造血生理学和造血细胞检测技术[M]. 长沙: 湖南科学技术出版社, 1997. |
| [10] | 郑德先, 吴克复, 诸建新. 现代实验血液学研究方法与技术[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1999. |
| [11] | Liu C, Li J Q, Meng F Y, et al. Polysaccharides from the root of Angelica sinensis promotes hematopoiesis and thrombopoiesis through the PI3K/AKT pathway[J]. BMC Complement Altern Med, 2010, 10(1): 1–12. DOI:10.1186/1472-6882-10-1 |
| [12] | Yang M, Chan G C F, Deng R, et al. An herbal decoction of Radix astragali and Radix angelicae sinensis promotes hematopoiesis and thrombopoiesis[J]. J Ethnopharmacol, 2009, 124(1): 87–97. DOI:10.1016/j.jep.2009.04.007 |
| [13] | 黄丽萍, 陈耀辉, 吴素芬, 等. 当归补血汤含药血清对血虚小鼠骨髓造血功能的影响[J]. 中药药理与临床, 2014, 30(2):18–20. |
| [14] | Shi X, Tang Y, Zhu H, et al. Pharmacokinetic comparison of seven major bio-active components in normal and blood deficiency rats after oral administration of Danggui Buxue Decoction by UPLC-TQ/MS[J]. J Ethnopharmacol, 2014, 153(1): 169–177. DOI:10.1016/j.jep.2014.02.004 |
| [15] | 宁炼, 陈长勋, 金若敏, 等. 当归补血汤促进造血功能的成分及其作用的研究[J]. 中国中药杂志, 2002, 27(1):50–53. |
| [16] | 刘忠全, 贺殿, 晋玲. 当归复方颗粒对血虚证模型动物的影响[J]. 西部中医药, 2013, 26(5):9–11. |
| [17] | Gao Q, Li J, Cheung J K H, et al. Verification of the formulation and efficacy of Danggui Buxue Tang (a decoction of Radix Astragali and Radix Angelicae Sinensis):An exemplifying systematic approach to revealing the complexity of Chinese herbal medicine formulae[J]. Chin Med, 2007, 2(1): 1–10. DOI:10.1186/1749-8546-2-1 |
| [18] | Meng A, Wang Y, Van Zant G, et al. Ionizing radiation andbusulfan induce premature senescence in murine bone marrow hematopoietic cells[J]. Cancer Res, 2003, 63(17): 5414–5419. |
| [19] | 王乾兴, 金华, 何国平, 等. 黄芪多糖对衰老小鼠造血干细胞细胞周期调控蛋白的影响[J]. 遵义医学院学报, 2014, 37(2):144–146. |
| [20] | 张岩岩, 李静, 贾道勇, 等. 当归多糖对衰老模型小鼠造血干细胞Wnt/β-catenin信号通路的影响[J]. 中草药, 2015, 46(14):2111–2116. |
| [21] | 张先平, 王乾兴, 陈斌, 等. 当归多糖对小鼠衰老造血干细胞细胞周期蛋白的调控[J]. 基础医学与临床, 2013, 33(3):320–324. |
| [22] | 严苏纯, 祝彼得, 韩英光, 等. 当归补血汤不同剂型及配伍对骨髓抑制小鼠造血调控的实验研究[J]. 中国药学杂志, 2008, 43(18):1386–1390. |
 2016, Vol. 47
2016, Vol. 47


