2. 四川师范大学化学与环境科学学院, 四川 成都 610068;
3. 四川师范大学植物资源应用与开发研究所, 四川 成都 610101
2. College of Chemistry and Environmental Science, Sichuan Normal University College, Chengdu 610068, China;
3. Institute of Plant Resources Application and Development Research, Sichuan Normal University College, Chengdu 610101, China
延胡索Corydalis Rhizoma(CR)亦名元胡,为罂粟科紫堇属植物延胡索Corydalis yanhusuo W. T. Wang的干燥块茎,具有活血、行气和止痛的功效,用于胸胁、脘腹疼痛、胸痹心痛、经闭痛经、产后瘀阻、跌扑肿痛[1-3]。有研究发现延胡索中去氢紫堇碱(dehydrocorydaline)和海罂粟碱(glaucine)对慢性疼痛可能有很好的疗效,并且没有耐药性[4-5]。
高速逆流色谱(high-speed counter-current chromatography,HSCCC)是20世纪60年代发展起来的一种新型的液-液分配色谱技术,作为一种新型的分离纯化技术,操作方便、快捷,分离度高,液-液分配体系选择广泛,克服了由固相载体带来的样品结合、失活、污染等缺陷,被广泛应用于天然产物活性成分的分离制备和中草药的分析鉴定[6-9]。
近年来对延胡索的分离纯化方法研究中,Tong等[10]采用1次HSCCC法分离了4种异喹啉生物碱类化合物,冯静等[11]采用1次HSCCC法联合制备色谱分离了4种生物碱,仅保证了化合物纯度,但其收率未进行考察,其他研究则多采用大孔吸附树脂和硅胶柱色谱,或者采用制备高压液相色谱等方法[12-14],获得高纯度的产品往往需要反复地色谱和结晶,步骤繁琐,分离时间较长,而且产品收率不高。本实验采用1次HSCCC技术选择合适的溶剂体系从延胡索的提取物中快速分离得到了脱氢紫堇碱和海罂粟碱单体,并且采用超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q-TOF-MS/MS)法对其结构进行鉴定[15-19],获得较高纯度和高收率的脱氢紫堇碱和海罂粟碱单体产品,为这类化合物的分离纯化提供了一种快速简便的方法。
1 仪器与材料TBE-300C型高速逆流色谱仪,上海同田生物技术有限公司;AB SCIEX Triple 4600型UPLC-MS/MS,高分辨质谱仪,美国SCIEX公司;DIONEX-Summit P680A DGP-6型双三元高效液相色谱仪,美国Thermo Fisher公司;Sartorius BP211D精密电子天平,德国Sartorius公司。
延胡索药材,购置于四川德仁堂中药饮片有限公司,并由成都中医药大学药学院邓赟教授鉴定为罂粟科紫堇属植物延胡索Corydalis yanhusuo W. T. Wang,批号为130101;D101大孔树脂,粒度0.3~1.25 mm,规格HG2-885-76,天津市光复精细化工研究所;色谱乙腈,正丁醇、氯仿、甲醇、乙醇(分析纯);对照品脱氢紫堇碱,批号T-033-160912,质量分数98.8%,购于成都普菲德生物技术公司;对照品海罂粟碱,批号B21272,质量分数98%,购于上海源叶生物技术公司。
2 方法与结果 2.1 延胡索提取物的制备取延胡索粉末500 g加50%乙醇10 L,80 ℃回流提取3次,每次1 h。滤过合并提取液,减压回收提取溶剂得浸膏75.123 g。取5 kg D101大孔树脂用95%乙醇活化后装入色谱柱中,用蒸馏水洗柱至洗液无醇味。取浸膏50 g溶解于1 L蒸馏水中,溶解后上D101大孔树脂柱,静态吸附12 h,蒸馏水洗柱10个柱体积弃去水洗片段。用30%乙醇洗脱15个柱体积,合并洗脱液,减压回收提取溶剂得粗提物干粉9.815 g,备用。
2.2 HSCCC溶剂体系筛选选取氯仿-正丁醇-甲醇-水(4:1:2:5)混合溶剂体系,振摇后静置分层。再次振摇并记录分层时间为22.2 s,静置完全分层后取4 mL上相,加入少量“2.1”项下制备的粗提物干粉,充分震荡溶解,移取2 mL,加入2 mL下相进行震荡萃取,用HPLC分别测定萃取前以及萃取后上相中目标物的峰面积(S),按照下式计算其分配系数(K)为0.70和1.29。根据K值和分层时间确定其为最佳分离体系。
K=(S萃取前-S萃取后)/S萃取后
溶剂体系的选择是HSCCC成功分离的关键,通常通过测定目标物质在溶剂体系中的K值来判断溶剂体系是否适合目标组分的分离。在HSCCC分离中,目标物质在两相溶剂体系中的K值最适范围为0.5~2.0,且两相体系间的分层时间越短越好。根据延胡索粗提物的D101大孔树脂30%乙醇洗脱片段的HPLC图谱结合所要分离的目标物的化学性质及常用溶剂体系,实验中考察溶剂体系及2个目标化合物在该溶剂体系中的K值,结果见表 1。从表中可以看出溶剂体系氯仿-正丁醇-甲醇-水(4:1:2:5)中化合物1和化合物2的K值均在0.5~2.0,且分层时间<25 s,因此,选择该溶剂体系作为HSCCC分离的溶剂体系。
|
|
表 1 目标化合物在不同比例氯仿-正丁醇-甲醇-水体系中的K值 Table 1 K values of target components in different solvent systems of chloroform-n-butanol-methanol-water |
2.3 HSCCC分离方法确定
以氯仿-正丁醇-甲醇-水(4:1:2:5)混合液置于分液漏斗中,充分震荡后静置分层,分别取上下相,超声脱气20 min。上相作为流动相,下相作为固定相。将固定相以30 mL/min的体积流量注满高速逆流色谱仪的螺旋管,正转转速为800 r/min,体积流量10 mL/min的条件泵入流动相,温度为25 ℃,检测波长282 nm有下相流出时体系平衡,称取“2.1”项下制备的粗提物干粉50 mg,用20 mL下相溶解后进样。正转反向洗脱30 min后反转转速为800 r/min,体积流量10 mL/min反转正向洗脱30 min,根据色谱图收集各个色谱峰组分。
在氯仿-正丁醇-甲醇-水(4:1:2:5)体系中,化合物1主要保留在上相中,所以在以上相为流动相,下相为固定相的反向洗脱体系中,化合物1易被洗脱。而化合物2在溶剂体系中多保留在下相,反向洗脱不能洗脱出化合物2,因此在洗脱30 min(1个柱体积)的条件下,选择下相为流动相,上相为固定相的正向洗脱,化合物2易被下相洗脱,其HSCCC分离图见图 1,2个化合物在1次分离中被完全分离。
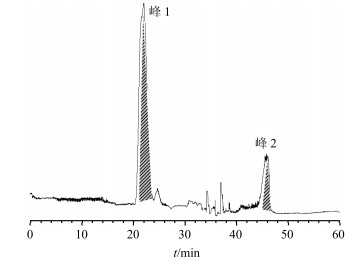
|
图 1 延胡索生物碱纯化物的HSCCC图 Fig.1 HSCCC of alkaloids purified from CR |
2.4 HPLC-UV法分析目标物纯度
采用HPLC法对延胡索提取物的分离片段以及单一化合物进行纯度分析。
2.4.1 混合对照品溶液的配制精密称取脱氢紫堇碱和海罂粟碱对照品适量至25 mL棕色量瓶中,加色谱乙腈溶解,定容至刻度,摇匀,配制成质量浓度分别为脱氢紫堇碱811 μg/mL和海罂粟碱402 μg/mL的混合对照品储备液。
2.4.2 色谱条件Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.2%冰乙酸的三乙胺水溶液(pH 4.0),二元梯度洗脱:0~25 min,10%~26%乙腈;25~33 min,26%乙腈;33~55 min,26%~80%乙腈;55~60 min,80%乙腈;60~65 min,80%~10%乙腈;65~75 min,10%乙腈;体积流量1 mL/min;柱温30 ℃;进样10 μL;紫外检测波长282 nm。理论板数以脱氢紫堇碱峰和海罂粟碱峰计算不低于10 000,色谱图见图 2。
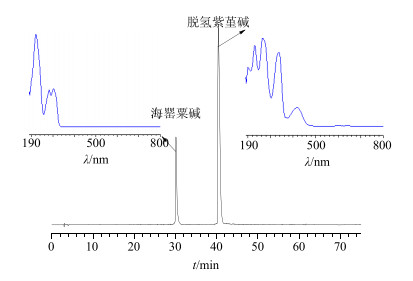
|
图 2 混合对照品HPLC图及紫外扫描图 Fig.2 HPLC and 3D-Ultraviolet absorbance of the mixed reference substance solutions |
2.4.3 供试品溶液的配制
精密称取“2.1”项下的粗提物干粉5 mg至10 mL量瓶中,用色谱乙腈定容至刻度摇匀,过0.45 μm微孔滤膜,滤液为粗提干粉供试品溶液。
2.4.4 线性关系考察精密移取混合对照品储备液0.1 mL于10 mL量瓶中,移取0.1、0.2、0.4、0.6、1.2、1.8、3.6 mL于5 mL量瓶中,加乙腈定容至刻度摇匀,按“2.4.2”色谱条件进行分析,测定不同质量浓度的混合对照品溶液中各化合物的峰面积。以峰面积为纵坐标(Y),进样量为横坐标(X),进行回归分析,得海罂粟碱线性方程Y=2.510 8 X-0.128 4,r=0.999 7,线性范围4.020~402.00 μg/mL,检出限0.053 μg/mL,定量限0.026 μg/mL;脱氢紫堇碱线性方程Y=0.834 X-0.734 1,r=0.999 3,线性范围8.107 4~810.74 μg/mL,检出限0.070 μg/mL,定量限0.035 μg/mL。
2.4.5 精密度试验取混合对照品溶液,按照“2.4.2”项色谱条件重复进样6次,记录色谱峰面积,其中海罂粟碱峰面积的RSD值为0.97%,脱氢紫堇碱峰面积的RSD值为0.84%,结果表明仪器精密度良好。
2.4.6 稳定性试验取同一供试品溶液,分别放置0、2、4、8、12、24 h后,按“2.4.2”项色谱条件测定峰面积,其中海罂粟碱峰面积的RSD值为1.05%,脱氢紫堇碱峰面积的RSD值为0.77%,结果表明供试品溶液在24 h是稳定的。
2.4.7 重复性试验精密称取延胡索粉末6份,按照“2.1”方法平行制备6份供试品溶液,按“2.4.2”项色谱条件分别测定海罂粟碱和脱氢紫堇碱的峰面积,计算其质量分数的RSD值分别为1.37%和1.25%,表明方法重复性高。
2.4.8 回收率试验分别精密称取5 mg粗提物干粉6份置10 mL量瓶中,再分别加入1 mL混合对照品储备液,乙腈定容至刻度线,摇匀,按照“2.4.2”项色谱条件进样测定并计算,其中脱氢紫堇碱平均加样回收率为104.5%,RSD值为2.37%,海罂粟碱的平均加样回收率为99.05%,RSD值为1.82%。
2.5 样品测定精密称取粗提物干粉5 mg以及分离得到的组分I 7.1 mg和组分Ⅱ 3.4 mg,按照“2.4.3”项方法进行制备,在“2.4.2”项色谱条件下进行测定,得色谱峰面积,带入“2.4.4”项线性回归方程,计算脱氢紫堇碱和海罂粟碱的量。图谱见图 3。
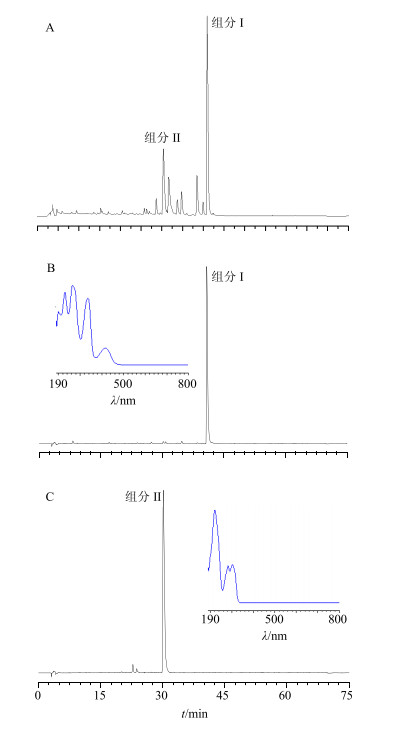
|
图 3 粗提物(A)、组分Ⅰ(B)和组分Ⅱ (C)的HPLC图及紫外扫描图 Fig.3 HPLC and 3D-Ultraviolet absorbance of crude extract (A), component Ⅰ (B), and component Ⅱ (C) |
2.5.1 定量测定结果
通过与对照品比对,组分I和组分Ⅱ的保留时间和3D紫外全波长扫描图分别与脱氢紫堇碱和海罂粟碱一致。通过标准曲线法计算得出粗提物干粉中脱氢紫堇碱质量分数为17.44%,海罂粟碱7.46%,组分I中脱氢紫堇碱98.89%,组分Ⅱ中海罂粟碱94.29%。
2.5.2 组分Ⅰ、Ⅱ收率测定结果50 mg粗提物中含有脱氢紫堇碱和海罂粟碱分别为8.719 mg和3.731 mg,通过1次纯化获得脱氢紫堇碱和海罂粟碱的质量分别为7.1 mg和3.4 mg,脱氢紫堇碱和海罂粟碱的收率为81.43%和91.11%。
目标物收率=制备目标物的量/粗提物中目标物的量
2.6 UPLC-Q-TOF-MS/MS法对目标产物进行结构鉴定 2.6.1 色谱条件色谱柱为Kinetex XB-C18柱(100 mm×2.1 mm,2.6 μm);流动相为0.05%甲酸水溶液-乙腈,梯度洗脱:0~0.5 min,10%乙腈;0.5~8 min,10%~90%乙腈;8~12 min,90%乙腈;12~15 min,90%~10%乙腈;体积流量0.2 mL/min;柱温30 ℃;自动进样2 μL。理论板数以脱氢紫堇碱峰和海罂粟碱峰计算不低于6 000。
2.6.2 质谱条件Triple TOF 4600高分辨质谱系统采用ESI离子源、采用Positive离子化模式,质量扫描范围m/z: 100~1 000,雾化气为氮气,鞘气(DP1)为379.225 kPa(55 psi),辅助气(DP2)为379.225 kPa(55 psi),气帘气(CUR)为172.375 kPa(25 psi),雾化温度600 ℃,采用TOF-MS-Product Ion-IDA扫描模式,TOF/MS一级预扫描和触发的二级扫描Product-Ion-IDA离子积累时间为600 ms,150 ms采用多重质量亏损(MMDF)和动态背景扣除(DBS)作为二级触发条件,解簇电压80 V,离子源电压为5 500 V/−5 500 V,碰撞能量(CE)为40 eV,碰撞能量叠加(CES)为(40±10)eV,数据分析软件Analyst TF1.6 Software(AB SCIEX,Foster City,CA)。
2.6.3 2个化合物的LC-MS/MS的结构分析(1)组分Ⅰ的结构鉴定:图 4中的一级质谱图显示组分Ⅰ的准分子离子峰为m/z 366.169 6,与脱氢紫堇碱的理论质量数相差−2.5×10−6。观察组分I的二级质谱图,准分子离子m/z 366.173 3丢失1分子甲基形成m/z 351.149 5碎片离子,而失去1分子CH4形成m/z 350.141 8碎片离子,再失去1分子羰基形成碎片离子m/z 322.146 4。这些碎片离子与文献中报道[16, 18]的脱氢紫堇碱的碎片离子基本相同。所以根据其精确质量数和碎片离子进一步推测组分Ⅰ为脱氢紫堇碱。
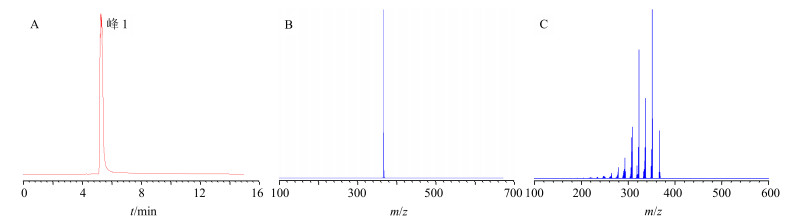
|
图 4 组分Ⅰ的总离子流图(A)、MS图(B)和MS/MS图(C) Fig.4 Total ion chromatogram (A), MS spectrum (B), and MS/MS spectru (C) of component Ⅰ |
(2)组分Ⅱ的结构鉴定:图 5中的一级质谱图显示组分Ⅱ的准分子离子峰为m/z 356.185 2,与海罂粟碱的理论质量数相差−2.8×10−6。观察组分Ⅱ的二级质谱图,准分子离子m/z 356.185 2丢失1分子甲氧基形成m/z 325.142 1碎片离子,丢失1分子甲氧基和1分子甲基形成m/z 310.118 5碎片离子,丢失2分子甲基形成m/z 294.123 8碎片离子,失去2分子甲氧基和1分子甲基形成m/z 279.100 0碎片离子。上述碎片离子与文献中报道[18, 20]的海罂粟碱的碎片离子基本相同。所以根据其精确质量数和碎片离子进一步推测组分Ⅱ为海罂粟碱。
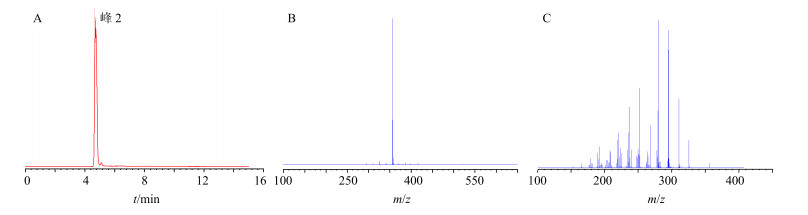
|
图 5 组分Ⅱ的总离子流图(A)、MS图(B)和MS/MS图(C) Fig.5 Total ion chromatogram (A), MS spectrum (B), and MS/MS spectrum (C) of component Ⅱ |
经对照品对照后,组分Ⅰ与组分Ⅱ保留时间分别为40.08 min和30.12 min,与对照品的出峰时间40.02 min和30.07 min基本能够吻合。可确定组分Ⅰ与组分Ⅱ分别为脱氢紫堇碱和海罂粟碱。
3 讨论采用HSCCC以氯仿-正丁醇-甲醇-水(4:1:2:5)为四元溶剂系统从延胡索D101大孔树脂30%乙醇洗脱片段(50 mg)中分离得到脱氢紫堇碱7.1 mg和海罂粟碱3.4 mg,其收率分别为81.43%和91.11%。经HPLC分析测得分离的脱氢紫堇碱和海罂粟碱的质量分数为98.9%和94.3%。与传统的分离方法相比较,HSCCC简便、快速、节省溶剂和时间,实现了短时间内的高纯度、高得率产品的制备,具有很好的使用价值。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 张永欣, 张颖, 张启伟. 醋制延胡索微粉提取条件的研究[J]. 中国中药杂志, 2003, 28(10):57. |
| [3] | 张铁军, 许浚, 韩彦琪, 等. 中药质量标志物(Q-marker)研究:延胡索质量评价及质量标准研究[J]. 中草药, 2016, 47(9):1458–1467. |
| [4] | Liang X M. The analgesic components is discovered from Rhizoma Corydalis[J]. Curr Biol, 2014, 24(2): 117–123. DOI:10.1016/j.cub.2013.11.039 |
| [5] | 张笑恺.元胡止痛方治疗偏头痛的功效成分分析和作用机制研究[D].西安:第四军医大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-90032-1015961608.htm |
| [6] | 严志宏, 黄秀珍, 顿珠次仁, 等. 高速逆流色谱分离制备裂叶独活中香豆素类成分[J]. 中草药, 2015, 46(20):3023–3027. |
| [7] | 刘琳.高速逆流色谱分离桑叶乙酸乙酯部位化学成分的研究[D].北京:北京中医药大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10026-1014242118.htm |
| [8] | 李文娟.黄芩中汉黄芩素的高速逆流色谱制备及其抗肿瘤作用[D].福州:福建中医药大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10393-1014241524.htm |
| [9] | 胡利锋, 廖晓兰, 柏连阳, 等. 硅胶柱色谱-高速逆流色谱法分离纯化羌活中佛手柑内酯[J]. 中草药, 2013, 44(6):701–704. |
| [10] | Tong S Q, Yan J Z. Preparative isolation and purification of alkaloids from Corydalis yanhusuo W. T. Wang by high speed counter-current chromatography[J]. Liquid Chromatogr, 2007, 18(28): 2979–2989. |
| [11] | 冯静, 王晓, 于宗渊, 等. 延胡索中生物碱成分研究[J]. 中国实验方剂学杂志, 2013, 19(6):124–127. |
| [12] | 张少君.延胡索中生物碱类化合物的分离纯化及指纹图谱研究[D].大连:大连理工大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10141-2009115808.htm |
| [13] | 杨鑫宝, 刘扬子, 杨秀伟, 等. 磐安延胡索化学成分研究[J]. 中草药, 2013, 44(16):2201–2207. |
| [14] | Zhang J, Jin Y, Liu Y F, et al. Purification of alkaloids from Corydalis yanhusuo W. T. Wang using preparative 2-D HPLC[J]. Sep Sci, 2009, 32(3): 1401–1406. |
| [15] | 任伟光, 武拉斌, 降雪, 等. 豨莶草及其酒炙品UPLC-Q-TOF/MS分析[J]. 中草药, 2014, 45(2):181–187. |
| [16] | 孙明谦.中药复杂样品电喷雾质谱分析方法研究[D].北京:北京中医药大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10026-2009089796.htm |
| [17] | 黄林芳, 李文涛, 王冬梅, 等. 基于UPLC-Q-TOF/MS技术研究酒苁蓉增效的物质基础[J]. 中草药, 2013, 44(24):3471–3475. |
| [18] | Sun M Q, Liu J X, Li C R, et al. Alkaloid profiling of the traditional Chinese medicine medicine Rhizoma Corydalis using high performance liquid chromatography-tandem quadrupole time-of-flight mass spectrometry[J]. Acta Pharm Sin B, 2014, 4(3): 208–216. DOI:10.1016/j.apsb.2014.04.003 |
| [19] | 李明潺, 王玉丽, 郭春宏, 等. UPLC-Q-TOF-MS法同时测定平消片中7种成分[J]. 中草药, 2015, 46(11):1625–1628. |
| [20] | Eun-K J, Sun Y L, Se M Y, et al. Identification of structurally diverse alkaloids in Corydalis species by liquid chromatography/electrosprap ionization tandem mass spectrometry[J]. Eur J Rapid Commun Mass Spectrom, 2012, 26(8): 1661–1674. |
 2016, Vol. 47
2016, Vol. 47


