2. 丽水学院医学与健康学院, 浙江 丽水 323000 ;
3. 台州学院生命科学学院, 浙江 椒江 318000
2. College of Medicine and Health, Lishui University, Lishui 323000, China ;
3. College of Life Science, Taizhou University, Jiaojiang 318000, China
斑叶兰属Goodyera L.植物为兰科(Orchidaceae)地生草本,具根状茎,因部分物种的叶片常带有杂色斑纹,故名斑叶兰;该属植物全世界约有40种,我国有29种[1]。斑叶兰属的部分种类如斑叶兰G. schlechtendaliana Rchb. f.、高斑叶兰G. procera (Ker-Gawl.) Hook.和大花斑叶兰G. biflora (Lindl.) Hook. f.等有较高的药用价值,具活血止痛、清肺止咳、消肿解毒和软坚散结的功效,可用于治疗肺结核、跌打损伤、尿路感染、支气管炎、毒蛇咬伤和痈疖疮疡等[2-4]。药材加工后容易改变形态结构,利用传统的中药鉴定手段难以准确鉴别,分子标记具有鉴定准确性高和重现性好等优点,目前已广泛应用于中药材鉴定[5]。
常见的分子标记技术有DNA条形码(DNA barcoding)、随机扩增多态性DNA标记(random amplified polymorphic DNA,RAPD)、扩增片段长度多态性(amplified fragment length polymorphism,AFLP)和单核苷酸多态性(single nucleotide polymorphisms,SNP)等[6],核糖体DNA内转录间隔区(internal transcribed spacer,ITS)是一种重要的DNA条形码,由2个间隔区(ITS1和ITS2)及它们之间的5.8 S组成,5.8 S在进化上十分保守,而ITS1和ITS2在序列长度和碱基组成上的变异较大,是研究遗传多样性、系统发育和物种鉴定的重要分子标记[7]。近年来,科研人员就斑叶兰属植物的药理作用、保护生物学、组织培养、化学成分和新记录种发现等方面开展了一些研究[8-12]。但有关斑叶属植物rDNA ITS序列克隆方面未见报道,本研究以7种斑叶兰属植物为材料,在克隆各自ITS序列的基础上,对它们进行序列分析,为该属植物的分子鉴定和系统发育分析奠定基础。
1 材料与仪器 1.1 材料斑叶兰Goodyera schlechtendaliana Rchb. f.、绒叶斑叶兰Goodyera velutina Maxim.、小斑叶兰Goodyera repens (L.) R. Br.、光萼斑叶兰Goodyera henryi Rolfe、高斑叶兰Goodyera procera (Ker -Gawl.) Hook.、大花斑叶兰Goodyera biflora var. macrantha (Lindl.) Hook. f.和绿花斑叶兰Goodyera viridiflora (Bl.) Bl. 7种植物,样品的采集地点及海拔信息见表 1,植物均由蒋明鉴定。每个物种采集5棵植株的叶片,分别装入取样袋后置于冰盒中带回实验室,先用大量的自来水冲洗,然后用无菌水冲洗2~3次,用吸水纸吸干后贮存于−80 ℃低温冰箱中备用。
|
|
表 1 斑叶兰属植物的来源 Table 1 Sources of plants in Goodyera L. |
1.2 仪器
BIO-RAD C1000型PCR仪;北京六一DYY-12型电泳仪和电泳槽;Eppendorf移液枪;BIO-RAD Gel Doc XR+凝胶成像系统;BECKMAN Allegra 64R高速冷冻离心机;超净工作台;恒温培养箱;恒温摇床。“新型植物基因组DNA快速提取试剂盒”购自北京鼎国昌盛生物技术有限责任公司。
2 方法 2.1 基因组DNA的提取DNA提取根据试剂盒说明书进行,每个样品取0.1 g用于DNA的提取。基因组DNA经电泳检测后,置于−80 ℃低温冰箱中保存备用。
2.2 ITS序列的克隆、转化和测序克隆ITS序列所用的PCR引物分别为ITSUP:5’-AGAAGTCGTAACAAGGTTTCCGTAGG-3’和ITSDN:5’-GGAAGTAAAAGTCGTAACAAGG-3’,委托生工生物工程(上海)股份有限公司合成。反应总体积为20 μL,在PCR管中依次加入15.8 μL无菌ddH2O,2 μL 10×PCR缓冲液(含20 mmol/L Mg2+)、0.35 μL上游引物(20 μmol/L)、0.35 μL下游引物(20 μmol/L)、0.20 μL 200 ng/μL的DNA、0.55 μL dNTPs(Genview)和0.55 μL 2 U/μL的Taq DNA聚合酶(北京鼎国公司)。PCR扩增程序:95 ℃预变性5 min,95 ℃变性45 s,55.8 ℃退火45 s,72 ℃延伸70 s,循环次数为33。
2.3 PCR产物的回收、连接和测序PCR产物经琼脂糖凝胶分离后,用刀片割取含目的片段的胶块。DNA片段的回收采用北京鼎国的“快速凝胶回收纯化试剂盒”,操作根据试剂盒说明书进行。各取2 μL纯化片段,连接到p-GEM T-easy载体(Promega),经转化大肠杆菌Trans5α化学感受态细胞(北京全式金生物技术有限公司)、蓝白斑筛选及菌液PCR验证后,各取3份阳性菌液用于测序。菌液PCR的体系和程序同“2.2”项,模板改为0.1 μL菌液。
2.4 序列分析测序结果经整理后保存为Fasta格式,用ClustalX 1.81软件进行序列比对[13];G+C值利用Excel计算获得;遗传距离计算及系统发育树的构建采用MEGA 3.1软件[14],建树方法为邻接法(neighbor joining,NJ),自举检测次数为1 000。
3 结果与分析 3.1 ITS序列的特征以基因DNA为材料,利用ITSUP和ITSDN引物对克隆到的7种斑叶兰属植物的rDNA进行ITS序列分析。测序结果显示,每个物种5棵单株的ITS序列完全一致。序列分析结果表明,7种斑叶兰属植物的ITS全长为700~702 bp,绒叶斑叶兰的ITS序列最长,光萼斑叶兰和大花斑叶兰次之,长度为701 bp,其余4种的ITS长度均为700 bp。ITS1的长度为239~240 bp,ITS2为298~300 bp,而5.8 S的长度十分保守,均为162 bp(表 2)。7种斑叶兰属植物ITS序列的G+C值为49.4%~53.0%,高斑叶兰的G+C值最高,绿花斑叶兰次之,为50.3%,绒叶斑叶兰的G+C值最低。
|
|
表 2 斑叶兰属植物ITS序列的长度及G+C值 Table 2 Length of ITS sequences and G+C value in plants of Goodyera L. |
3.2 ITS序列的比较分析
利用ClustalX 1.81对齐ITS序列,发现它们共有可变位点107个、信息位点34个,序列中存在大量的缺失/插入和转换/颠换现象,这些信息位点可完全区分这7种斑叶兰属植物(图 1)。ITS1和ITS2的信息位点数分别为22和11,5.8 S序列中存在1个信息位点,位于+341处。ITS1序列的+130、+139、+196和+213位发生缺失/插入现象,ITS2仅+147位存在缺失/插入,而在5.8 S序列中未检测到。转换/颠换现象在ITS1和ITS2中十分普遍,次数分别为56和47,而5.8 S序列中的转换/颠换现象较少,仅发生3次,分别位于+326、+341和+363。斑叶兰和小斑叶兰的ITS序列差异最小,仅存在4个碱基的差异,分别位于+37、+113、+598和+687处;绒叶斑叶兰和光萼斑叶兰的ITS存在8个碱基的差异,它们是+32、+112、+140、+213、+511、+608、+609和+651位(图 1)。
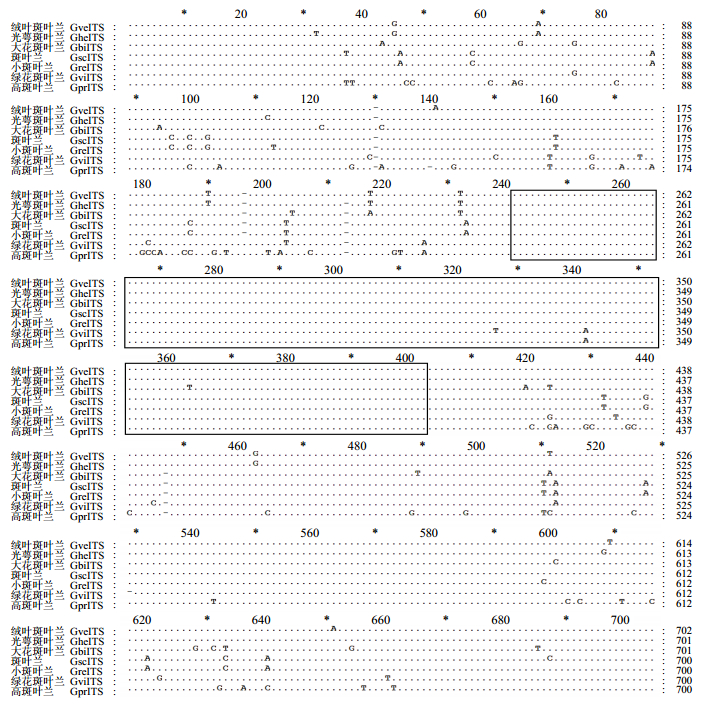
|
黑色方框表示5.8 S序列 Black boxes indicate 5.8S sequences 图 1 斑叶兰属药用植物的ITS序列 Fig.1 ITS sequences of seven medicinal plants in Goodyera L. |
3.3 系统发育分析
利用Mega软件计算遗传距离,结果表明,7种斑叶兰属植物的遗传距离为0.006~0.110。其中,斑叶兰和小斑叶兰的遗传距离最近;绒叶斑叶兰和光萼斑叶兰次之,遗传距离为0.010;高斑叶兰和小斑叶兰、高斑叶兰和大花斑叶兰之间的遗传距离最远,分别为0.106和0.110。7种斑叶兰属植物在系统发育树上分为4组,大花斑叶兰、光萼斑叶兰和绒叶斑叶兰聚为一组(Ⅰ),斑叶兰和小斑叶兰聚为一组(Ⅱ),而绿花斑叶兰及高斑叶兰单独处于2个不同分支(Ⅲ和Ⅳ)(图 2)。
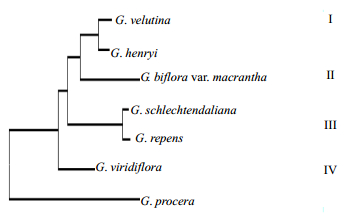
|
图 2 基于ITS序列构建的7种斑叶兰属植物的系统发育树 Fig.2 Phylogenetic tree of seven kinds of plants in Goodyera L. constructed based on ITS sequences |
4 讨论
正确鉴定中药是安全用药和药用植物合理开发的保证,因地理分布和所处生境不同,植物的形态和化学成分差异较大,利用传统的形态学、显微法、理化性质和化学指纹图谱鉴定具有一定的局限性[15]。随着分子生物学技术的发展,分子标记已广泛应用于药用植物的资源鉴定、亲缘关系确定和多样性研究[16]。rDNA-ITS是一种重要的DNA条形码,它具有信息位点丰富、序列长度保守和核苷酸变异快等特点,已广泛用于物种鉴定、植物分类和系统发育研究[6]。Jeanmougin等[13]以野豌豆属Vicia L. 8种药用植物为材料,克隆到各自的ITS序列,共有信息位点33个,特异性鉴别位点29个,可将这些植物完全区分;邵婧等[14]以茅苍术Atractylodes lancea (Thunb.) DC.及其近缘种为材料获得各自的ITS2序列,共鉴定到7个变异位点,可用茅苍术药材的鉴定。本研究中,7种斑叶兰属植物ITS序列的信息位点十分丰富,达34个,利用它们可将7种植物完全区分。
在被子植物中,rDNA-ITS的全长由ITS1、5.8 S和ITS2组成,长度500~700 bp,ITS1的长度为187~298 bp,ITS2为187~252 bp,其中的5.8 S最为保守,序列长度通常为163~164 bp[17-18]。不同种属植物的ITS序列差异较大,山姜属Alpinia L.植物ITS1的长度为201~231 bp,ITS2的长度为253~281 bp,而5.8 S的长度变异最小,为163~164 bp[19];远志属Polygala L. 7药用植物ITS1的长度为279~291 bp,ITS2的长度为211~219 bp[20];鼠尾草属Salvia L. 27种药用植物的ITS1长度为226~233 bp,ITS2的长度为216~228 bp[21]。本研究中,7种斑叶兰属植物的ITS全长为700~702 bp,其中的ITS1长度为239~240 bp,ITS2长298~300 bp,而5.8 S的长度与石豆兰属Bulbophyllum L.、银杏Ginkgo biloba L.和川牛膝Cyathula officinalis Kuan一致,均为162 bp[22-24]。
本研究以7种斑叶兰属植物为材料,分别克隆到它们的ITS全长序列,测序结果表明7种斑叶兰属植物ITS序列的信息位点丰富,利用这些位点可将它们完全区分,研究结果为斑叶兰属植物的分子鉴定和遗传多样性研究奠定了基础。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志(第17卷)[M]. 北京: 科学出版社, 1999 . |
| [2] | Lee S, Xiao C, Pei S. Ethnobotanical survey of medicinal plants at periodic markets of Honghe Prefecture in Yunnan Province, SW China[J]. J Ethnopharmacol , 2008, 117 (2) :362–377. DOI:10.1016/j.jep.2008.02.001 |
| [3] | 付志惠, 李洪林, 张建霞, 等. 斑叶兰的组织培养[J]. 植物生理学通讯 , 2006, 42 (3) :480–480. |
| [4] | 李泳锋, 刘杰书, 刘金龙. 大花斑叶兰中化学成分的气相色谱-质谱联用分析[J]. 内蒙古中医药 , 2009 (4) :40–41. |
| [5] | 郭伟云, 牛玉璐, 姚朝阳. DNA分子标记技术在中药材品质鉴定中的应用进展[J]. 新乡医学院学报 , 2006, 23 (6) :635–637. |
| [6] | Arif I A, Bakir M A, Khan H A, et al. A brief review of molecular techniques to assess plant diversity[J]. Int J Mol Sci , 2010, 11 (5) :2079–2096. DOI:10.3390/ijms11052079 |
| [7] | Baldwin B G, Sanderson M J, Porter J M, et al. The ITS region of nuclear ribosomal DNA:A valuable source of evidence on angiosperm phylogeny[J]. Ann Mol Bot Gard , 1995, 82 (2) :247–277. DOI:10.2307/2399880 |
| [8] | Du X M, Irino N, Furusho N, et al. Pharmacologically active compounds in the Anoectochilus and Goodyera species[J]. J Nat Med , 2008, 62 (2) :132–148. DOI:10.1007/s11418-007-0169-0 |
| [9] | Wong K C, Sun M. Reproductive biology and conservation genetics of Goodyera procera (Orchidaceae)[J]. Am J Bot , 1999, 86 (10) :1406–1413. DOI:10.2307/2656923 |
| [10] | 付志惠, 李洪林, 张建霞, 等. 斑叶兰的组织培养[J]. 植物生理学通讯 , 2006, 42 (3) :480–480. |
| [11] | Zhang F, Han B, Li P, et al. Design, synthesis and hepatoprotective activity of analogs of the natural product goodyeroside A[J]. Molecules , 2013, 18 (2) :1933–1948. DOI:10.3390/molecules18021933 |
| [12] | 葛斌杰, 田怀珍, 胡超. 田旗中国大陆兰科植物新记录种--南湖斑叶兰[J]. 广西植物 , 2012, 32 (6) :750–752. |
| [13] | Jeanmougin F, Thompson J D, Gouy M, et al. Multiple sequence alignment with Clustal X[J]. Trends Biochem Sci , 1998, 23 (10) :403–405. DOI:10.1016/S0968-0004(98)01285-7 |
| [14] | 邵婧, 谷巍, 巢建国, 等. 基于ITS2序列的茅苍术及其近缘种DNA分子鉴定[J]. 中草药 , 2015, 46 (8) :1209–1215. |
| [15] | 张忠廉, 宋美芳, 李海涛, 等. 千斤拔属药用植物DNA条形码鉴定研究[J]. 中草药 , 2015, 46 (1) :118–122. |
| [16] | Kool A, de Boer H J, Krüger A, et al. Molecular identification of commercialized medicinal plants in Southern Morocco[J]. PLoS One , 2012, 7 (6) :e39459. DOI:10.1371/journal.pone.0039459 |
| [17] | 王建波, 张文驹, 陈家宽. 核rDNA的ITS序列在被子植物系统与进化研究中的应用[J]. 植物分类学报 , 1999, 37 (4) :407–416. |
| [18] | Alvarez I, Wendel J F. Ribosomal ITS sequences and plant phylogenetic inference[J]. Mol Phylogenet Evol , 2003, 29 (3) :417–434. DOI:10.1016/S1055-7903(03)00208-2 |
| [19] | Kress W J, Liu A Z, Newman M, et al. The molecular phylogeny of Alpinia (Zingiberaceae):A complex and polyphyletic genus of gingers[J]. Am J Bot , 2005, 92 (1) :167–178. DOI:10.3732/ajb.92.1.167 |
| [20] | 樊杰, 白妍, 束明月. 远志属7种药用植物ITS1和ITS2序列分析[J]. 中草药 , 2015, 46 (4) :562–565. |
| [21] | 王迎, 李大辉, 张英涛. 鼠尾草属药用植物及其近缘种的ITS序列分析[J]. 药学学报 , 2007, 42 (12) :1309–1313. |
| [22] | 蒋明, 陈贝贝, 贺蔡明. 石豆兰属植物rDNA ITS序列的克隆与分析[J]. 中草药 , 2012, 43 (2) :343–349. |
| [23] | 桂仁意, 金爱武, 高培军, 等. 银杏核糖体DNA内转录间隔序列初步分析[J]. 浙江林学院学报 , 2007, 24 (1) :17–21. |
| [24] | 官宇.川牛膝(Cyathula officinalis Kuan.)种质资源遗传多样性的初步研究[D].雅安:四川农业大学, 1999. http://cdmd.cnki.com.cn/Article/CDMD-10626-2009259116.htm |
 2016, Vol. 47
2016, Vol. 47

