2. 云南省曲靖市第一人民医院 麻醉科, 云南 曲靖 655000
2. Department of Anesthesiology in Qujing First People's Hospital, Qujing 655000, China
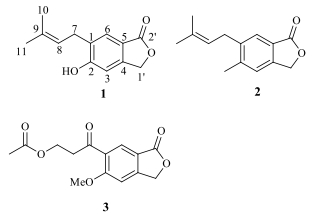
羊脆木Pittosporum kerrii Craib为海桐花科(Pittosporaceae)海桐花属Pittosporum Bank植物,在我国主要分布在云南的东南至西南部,其根皮及树皮可入药,具有疏风、解表、止疟功效[1]。李祖强等[2-5]研究了羊脆木枝叶树皮的化学成分,主要报道的化合物有脂肪酸、黄酮、苯丙素、甾醇、三萜等类型。为充分利用我国丰富的天然植物药资源,进一步从天然植物宝库中发掘活性化合物,本实验对羊脆木根皮的化学成分进行了研究,从中分离得到3个异苯并呋喃内脂类化合物,分别鉴定为5-羟基-6-异戊烯基-异苯并呋喃-1(3H)-酮(5-hydroxy-6-prenyl-isobenzofuran-1(3H)-one,1)、5-甲基-6-异戊烯基-异苯并呋喃-1(3H)-酮[5-methyl-6-prenyl-isobenzofuran-1(3H)-one,2]、5-甲氧基-6-(3-O-乙酰基)-丙酰基-异苯并呋喃-1(3H)-酮[3-(6-methoxy-3-oxo-1, 3-dihydroisobenzofuran-5-yl)-3-oxopropyl acetate,3]。化合物1~3均为首次从羊脆木根皮中分离得到,化合物1为新化合物,命名为羊脆木素A,该化合物对NB4、SH-SY5Y、PC3、A549和MCF-7细胞的IC50值分别为3.6、5.2、8.8、5.7和6.0 μmol/L,具有明显的细胞毒活性。
1 仪器与材料UV-2401A紫外光谱仪(日本岛津公司);Bio-Rad FTS-185傅里叶变换红外光谱仪(美国BIO-RAD公司);DRX-500型核磁共振仪(瑞士布鲁克公司);LC-8A型高效液相色谱仪(日本岛津公司);Zorbax PrepHT GF(250 mm×21.2 mm,7 μm)色谱柱和Zorbax C18(250 mm×9.4 mm,5 μm)色谱柱(美国安捷伦公司)。柱色谱硅胶(80~100、200~300目)、GF254(100 mm×100 mm)硅胶板,均为青岛海洋化工厂生产;Sephadex LH-20凝胶为美国通用电气公司生产;薄层色谱法显色,显色剂为5% H2SO4乙醇溶液,喷洒后适当加热即可;工业用三氯甲烷、甲醇、醋酸乙酯、石油醚;色谱纯乙腈、四氢呋喃;超纯水。
羊脆木样品采于云南红河州河口县,经云南民族大学杨青松副教授鉴定为海桐花科海桐花属植物羊脆木Pittosporum kerrii Craib。本实验中所用材料为该植物的根皮部分。
2 提取与分离取2.2 kg晒干的羊脆木根皮粉碎到30目,70%的丙酮水溶液提取4次,每次3.0 L,室温浸泡、超声4次(每次30 min),滤过。合并提取液,浓缩,醋酸乙酯萃取3次(每次2 L),减压浓缩得浸膏55.2 g。浸膏用80 g粗硅胶(80~100目)拌样,烘干,用320 g硅胶(150~200目)柱色谱分离,三氯甲烷-丙酮(9:1、8:2、7:3、6:4、5:5、1:2)梯度洗脱,分成6个部分。选取8:2洗脱部分(3.2 g)通过HPLC进一步分离,过葡聚糖凝胶柱净化,可得化合物1(10.6 mg)、2(12.2 mg)、3(14.5 mg)。
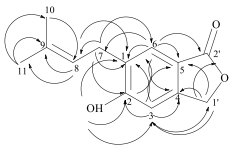
3 结构鉴定化合物1:浅黄色胶状物;HR-ESI-MS m/z: 241.083 2 [M+Na]+(计算值241.084 1,C13H14NaO3)。结合1H-NMR和13C-NMR谱确定分子式为C13H14O3,不饱和度为7。IR光谱显示化合物中有羟基(3 389 cm−1)、羰基(1 715 cm−1)和芳环(1 610、1 566和1 467 cm−1)信号,UV在305、272和210 nm有最大吸收,也证实化合物中存在芳环结构。从1H-和13C-NMR谱(表 1)信号可以看出化合物中有1个1, 2, 4, 5-四取代的苯环δC 126.0 (s), 159.2 (s), 111.2 (d), 144.7 (s), 116.4 (s), 130.2 (d);δH 6.74 (s), 7.78 (s);1个异戊烯基δC 27.2 (t), 124.2 (d), 133.3 (s), 17.6 (q), 25.8 (q);δH 3.27 (d, J=6.8 Hz)、5.30 (t, J=6.8 Hz)、1.57 (s)、1.81 (s);1个氧化亚甲基δC 68.9 (t)和δH 5.52 (s);1个酯羰基δC 168.6 (s);1个酚羟基δH 10.44 (s)信号。根据H2-1′ (δH 5.52)和C-2′ (δC 168.6)、C-3 (δC 111.2)、C-4 (δC 144.7)、C-5 (δC 116.4),H-3 (δH 6.74)和C-1 (δC 111.2),H-6 (δH 7.78)和C-2′ (δC 168.6)的HMBC相关(图 1)可证实化合物1为异苯并呋喃内酯类化合物[6],C-1′和C-2′通过氧原子连接形成了五元内酯环。根据H-8 (δH 5.30)和C-1 (δC 126.0),H-7 (δH 3.27)和C-1 (δC 126.0)、C-2 (δC 159.2)、C-6 (δC 130.2),H-6 (δH 7.78)和C-7 (δC 27.2)的HMBC相关可证实异戊烯基连接在苯环的1位,根据酚羟基(δH 10.44)和C-1 (δC 126.0)、C-2 (δC 159.2)、C-3 (δC 111.2)的HMBC相关可证实酚羟基取代在C-2位。至此化合物1的结构得以确定(图 2),命名为羊脆木素A。
|
|
表 1 化合物1的1H-NMR和13C-NMR数据(500/125 MHz, C5D5N) Table 1 1H-NMR and 13C-NMR data of compound 1 (500/125 MHz, C5D5N) |
|
图 1 化合物1的主要HMBC(  |
|
图 2 化合物1~3的结构 Fig.2 Structures of compounds 1-3 |
化合物2和3为已知化合物(图 2),通过其波谱数据与文献对比,分别鉴定为5-甲基-6-异戊烯基-异苯并呋喃-1(3H)-酮[7]、5-甲氧基-6-(3-O-乙酰基)-丙酰基-异苯并呋喃-1(3H)-酮[8]。
4 化合物的细胞毒活性生物碱类化合物具有明显的细胞毒活性,因此对化合物1进行了细胞毒活性筛选。细胞毒活性检测参照文献方法[9],采用改良的MTT测定法,以紫杉醇为阳性对照药,采用5种人源癌细胞株NB4、A549、SHSY5Y、PC3和MCF7。紫杉醇对5种癌细胞的IC50值分别为0.03、0.02、0.05、0.05和0.03 μmol/L,化合物1的IC50值分别为3.6、5.2、8.8、5.7和6.0 μmol/L,结果表明化合物1对所测试的人源肿瘤细胞具有细胞毒活性。
| [1] | 江苏省植物研究所, 中国医学科学院药物研究所. 新华本草纲要(第3册)[M]. 上海: 上海科学技术出版社, 1990 . |
| [2] | 罗蕾, 李祖强, 张吕丽, 等. 羊脆木的化学成分研究(I)[J]. 云南大学学报:自然科学版 , 2013, 35 (1) :83–86. |
| [3] | 罗蕾, 张吕丽, 李祖强, 等. 羊脆木的化学成分研究(Ⅱ)[J]. 云南大学学报:自然科学版 , 2014, 35 (6) :903–906. |
| [4] | 吴云飞, 罗蕾, 李祖强, 等. 羊脆木树皮的化学成分研究(I)[J]. 云南师范大学学报:自然科学版 , 2014, 34 (4) :61–64. |
| [5] | 张吕丽, 任明丽, 海清, 等. 羊脆木树皮的化学成分研究(Ⅱ)[J]. 云南师范大学学报:自然科学版 , 2015, 35 (6) :50–52. |
| [6] | Shen Q P, Li L, Xu X M, et al. Phenylpropanoids from the leaves of Nicotiana tabacum and their anti-tobacco mosaic virus activities[J]. Heterocycles , 2015, 91 (9) :1775–1780. DOI:10.3987/COM-15-13266 |
| [7] | Shen Q P, Xu X M, Zhang F M, et al. Two new benzolactones from the leaves of Nicotiana tabacum and their anti-tobacco mosaic virus activities[J]. Nat Prod Rep , 2016, 30 (13) :1464–1469. DOI:10.1080/14786419.2015.1104675 |
| [8] | Kong G H, Wu Y P, Shi J L, et al. Anti-tobacco mosaic virus phenylpropanoids from the stems of Nicotiana tabacum[J]. Phytochem Lett , 2015, 14 :230–233. DOI:10.1016/j.phytol.2015.10.023 |
| [9] | Hu Q F, Zhou B, Ye Y Q, et al. Cytotoxic deoxybenzoins and diphenylethylenes from Arundina Graminifolia[J]. J Nat Prod , 2013, 76 (10) :1854–1859. DOI:10.1021/np400379u |
 2016, Vol. 47
2016, Vol. 47



