2. 江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023 ;
3. 中药资源产业化与方剂创新药物国家地方联合工程研究中心, 江苏 南京 210023
2. Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China ;
3. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing 210023, China
腺毛是指植物中能分泌挥发油、树脂、黏液等物质的毛茸,由单细胞或多细胞构成,被誉为“生物合成工厂”,是一种极度特化的植物结构,相对于其他植物组织,腺毛的代谢过程非常鲜明地表现了植物体的代谢特点。因此腺毛的研究对于人们理解植物次生代谢的调控方式、次生代谢的演化历程乃至植物遗传谱系整体状态都有着重要意义。
腺毛广泛存在于唇形科、茄科、菊科等科属的药用植物中,随着精准技术和研究方案的成熟,以腺毛为着眼点的药用植物研究正在逐步受到更广大科研工作者的关注,其中薄荷Mentha haplocalyx Briq.、黄花蒿Artemisia annua Linn. 等药用植物的腺毛研究已非常成熟,本文就药用植物腺毛的研究现状进行综述。
1 腺毛形态腺毛主要由腺头、腺柄和基细胞3部分组成,广泛分布植物的茎、叶、花等器官表面。不同植物中腺毛的种类形态变化很大,在同一植物中常常同时存在2~3种,亦被作为植物的分类特征之一[1]。其中腺鳞为特化的腺毛组织,其腺头由6~8个分泌细胞组成,呈辐射状排列。腺鳞的分泌细胞外侧存在致密的角质层,角质层与分泌细胞所形成的空腔,为腺毛的分泌物提供了储存场所[2]。腺毛具有分泌功能,故腺毛的分泌细胞具有较发达亚细胞分泌结构如内质网、高尔基体等。对于植物体亚细胞结构的研究多采用组织化学染色结合透射电镜技术。由于该技术对化学定性的局限,腺毛亚细胞结构的研究主要集中于亲脂类物质与黏液类物质[3-5]。
2 腺毛分离及纯化腺毛的分离及纯化富集技术一直是开展腺毛研究的技术核心及难点,在成熟的分离技术出现之前,科研工作者多将植物体器官本身等同于腺毛,如溶剂直接萃取腺毛内含物,此类方法不可避免地导致腺毛研究具有较高的组织背景,特别是在分子机制研究中,较高的组织背景相当程度上掩盖了有效信息,给实验结果带来误差,因此成熟的分离技术的出现促使了腺毛研究有了长足的进步[6-8]。其中腺毛的分离方法大体可分为定向机械法、解离混悬法和原位分离法。
2.1 定向机械法定向机械法是指运用较简单的工具,对腺毛定向进行最直接的机械操作。Chiang等[9]用镊子将烟草Nicotiana tabacum L. 的腺毛取下,直接浸泡在有机溶剂中予以分析。Yamaura等[10]用胶带粘取的方法从植物百里香Thymus mongolicus Ronn. 表面粘取腺毛组织,辅以玻璃毛细管使其游离于溶媒中。亦有科研工作者在毛细管中加入少量溶媒,直接对腺毛进行机械破碎后分析。此类方法虽从某种程度上可以实现腺毛的分离,但其工作精度较差、对操作人员要求较高、工作效率低,难以满足短时间大量获得腺毛组织的实验需求,并不能很好地适应多种分析研究。
2.2 解离混悬法解离混悬法是指将植物组织置于解离培养液中,经过特定的处理后使腺毛游离于培养液中,其主要有球磨法、刷落法、酶解法。球磨法系指将植物组织与玻璃微珠共同混悬于解离培养液中,与此同时将混悬液整体做纵向机械运动,利用玻璃微珠的切向刮擦作用促使腺毛脱落[11]。该方法因其对薄荷、罗勒Ocimum basilicum L.、烟草等植物有良好的适用性,经过科研工作者不断的改良已成为腺毛分离的主流方法之一[12-14]。刷落法系指先将腺毛经特定处理使其与植物体的结合变弱,再使用软硬适中的毛刷将腺毛刷落,其中常用的前处理方法有超低温[15]和乙二醇双 (2-氨基乙基醚) 四乙酸(EGTA)孵育[16]。酶解法系指利用纤维素酶、半纤维素酶、果胶酶将植物细胞的细胞壁酶解去除,最终实现腺毛得以游离。
解离混悬法可在短时间内获得大量腺毛,但其不可避免地会带入大量其他植物组织,这为后期的纯化富集处理提出了更高的要求。腺毛的纯化富集多利用腺毛组织与其他组织在形状、大小、密度等特性的差异进行分离。Gershenzon等[2]在利用球磨法获得薄荷腺毛组织后,将其通过孔径为350、105、20 μm的细胞筛组获得了相对纯净的腺毛组织。Sallets等[14]将通过细胞筛组后的组织液进行梯度密度离心,进一步提高了腺毛组织液的纯度。但是,植物腺毛的尺寸、形状、种类繁多,故腺毛纯化富集方法在不同物种间存在适用性障碍。
2.3 原位分离法原位分离法主要包括显微操作法和激光显微切割法,系指植物组织不经繁复的前处理过程,直接从植物体上获得腺毛组织。Clark等[17]运用显微取样与负压装置,从总花荆芥Nepeta racemosa Lam.上分离得腺毛组织并进行了相关化学分析,但因其装置较为粗放并未收到较大程度的关注。Nonomura等[18]运用新一代显微操作系统研究了番茄Lycopersicon esculentum Mill. 腺毛分泌物对白粉菌的抗性,此种显微操作系统可以较为准确地获取腺毛表面分泌物,操作精度较高。
激光显微切割是一种新兴细胞分离技术,其将激光切割系统与显微光学系统相集成,对观察到的特定显微组织进行极高精度的定点切割,此种技术几乎可以适应各种显微切割案例。近年来已逐步用于腺毛及亚腺毛结构的研究中。Happyana等[19]利用激光显微切割系统将大麻Cannabis sativa Linn. 腺毛的腺头与腺柄分离,分别进行内含物化学研究。除此以外,Olofsson等[20]利用激光分割了黄花蒿腺毛,将黄花蒿腺毛不同部位的分泌细胞加以区别分析。原位分离法可以最大程度上保持腺毛在内生环境下的状态,精度高,无需进行纯化操作。但原位分离法需要一定的仪器支持,寻找和获取特定目标的效率较低,不具备短时间获大量腺毛的条件。
此外,本团队沿用冻刷法的同时,利用荆芥Schizonepeta tenuifolia (Benth.) Briq. 花穗腺鳞与其他植物组织在尺寸、密度、聚丙烯材料亲和性等性质的差异,建立了荆芥穗腺鳞的分离纯化方法,该方法具有简便、快速、低成本等优势[21]。
3 腺毛内含物分析技术及其合成代谢机制研究 3.1 腺毛内含物分析技术腺毛内含物分析系指对腺毛角质层下储存的分泌产物进行化学分析,是腺毛研究的关键步骤之一,由于样品量通常较少,其对检测器的灵敏度有着相对较高的要求。故高灵敏度的质谱技术在腺毛化合物的研究中应用最为广泛,根据所分析化合物的性质气相色谱、液相色谱和毛细管电泳色谱等分离系统常与其联用。
腺毛的分泌物主要为萜类等挥发性成分,故气质联用(GC-MS)技术最为常见。Fischedick等[22]利用GC-MS对大麻腺毛中大麻酚类和萜类化合物进行了代谢图谱研究。Gang等[23]运用GC-MS对罗勒腺毛中苯丙素的代谢过程进行研究。除此之外,经衍生化后的多糖、木质素、脂肪酸类成分亦可采用GC-MS予以分析,Marks等[16]对拟南芥Arabidopsis thaliana (L.) Heynh. 非腺毛的化学组成进行研究,明确了其中单糖和木质素的组分比例,但此类方法在具有分泌功能的腺毛中还未见运用报道。液质联用技术主要针对腺毛中非挥发性成分的研究,如黄酮类、糖苷、生物碱类等,该技术也被用于腺毛中生物大分子的鉴定[13, 24]。此外,核磁共振技术有着极强的化合物定性能力,在对腺毛代谢产物的研究中也有相关运用。研究对象主要为单一化合物,或研究者对研究对象有着较强的靶标目的[19]。
3.2 腺毛内含物合成代谢机制研究 3.2.1 萜类化合物萜类化合物是腺毛代谢物中最主要的成分,常以异戊烯二磷酸(isopentenyl diphosphate,IPP)为合成的初始原料,通过聚合作用不断延长碳链,依次形成半萜、单萜、倍半萜、二萜等多种化合物。IPP的主要形成途径为甲基赤藓糖磷酸(methylerythritol phosphate,MEP)途径及甲羟戊酸(mevalonic acid,MVA)途径,MEP途径主要定位于质体中,而MVA途径主要在细胞质中完成[25]。但哪一种方式是腺毛IPP合成的主要途径长期存在争议[26-33],近期研究表明2种途径在多个植物腺毛中并不完全独立,在下游合成中可出现某些代谢产物的交流和转移。其中单萜和二萜等主要由MEP途径合成,而倍半萜均可来源于二者,其中MEP途径占主导作用[34]。MVA与MEP途径在生物系统进化中有着重要的节点意义,如何更加客观地理解二者在腺毛中的协作关系,对人们科学地诠释植物的进化进程有着重要影响[35]。在药用植物的萜类合成的研究中,薄荷醇与青蒿素最为系统。
(1) 薄荷醇:薄荷醇是薄荷腺毛内含物中最主要的单萜,也是薄荷单萜代谢的最终产物。薄荷腺鳞作为一个完整的植物组织,其受到整体植株调控,同时腺毛自身也进行着相对独立的统筹,在稳定的自然环境中可以较为完整的储存其代谢产物,是研究植物萜类代谢的良好模式[36]。研究结果表明薄荷腺毛的萜类合成速率与植物体对CO2的固定速率呈正相关,且生成后20~30 h内代谢活动最为活跃,主要萜类成分大都在此时段内代谢合成[37]。
薄荷醇为对薄荷烷型单萜化合物(p-menthane monterpenoids),具有抗炎、镇痛、解热、杀菌等多种药理作用[38]。经过多年的科学研究[39-41],薄荷醇的代谢过程已较为清晰。其合成原料为牻牛儿基焦磷酸(geranyl diphosphate,GPP),经柠檬烯环化酶等的催化下形成下游产物,具体代谢过程见图 1。
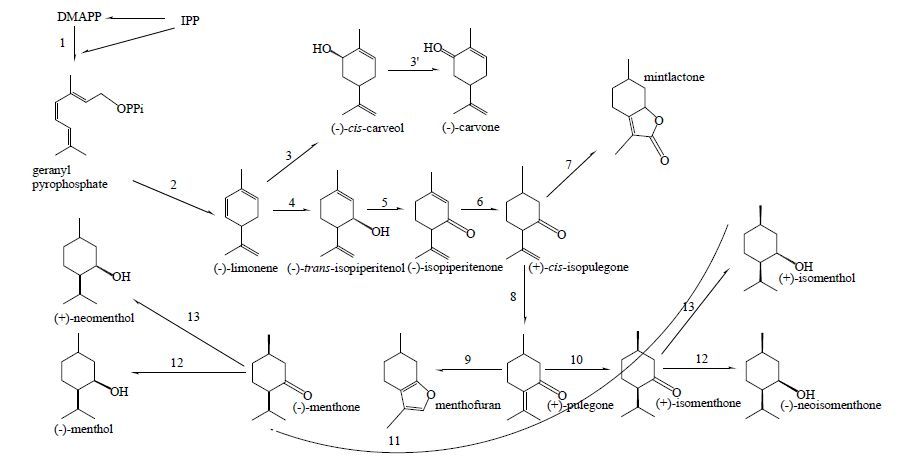
|
1-香叶基焦磷酸合酶 2-柠檬烯合成酶 3-柠檬烯6位羟化酶 4-柠檬烯3位羟化酶 5-异薄荷醇脱羟基酶 6-异薄荷酮还原酶 7-细胞色素P450 (-) 薄荷内酯合成酶 8-异胡薄荷酮异构酶 9- 细胞色素P450薄荷呋喃合成酶 10-胡薄荷酮-异薄荷酮还原酶 11-胡薄荷酮-薄荷酮还原酶 12-薄荷酮-薄荷醇还原酶 13-薄荷酮-反式薄荷醇还原酶 1-geranyl diphosphate synthase 2-limonene synthase 3-limonene 6-hydroxylase 4-limonene 3-hydroxylase 5-iso-piperitenol dehydroxylase 6-iso-piperitenone reductase 7-cytochrome P450 (−)-mintlactone synthase 8-iso-pulegone isomerase 9-cytochrome P450 menthofuran synthase 10-pulegone-iso-menthone reductase 11-pulegone-menthone reductase 12-menthone-menthol reductase 13-menthone-neomenthol reductase 图 1 薄荷烷型单萜类成分的代谢过程 Fig.1 Metabolic process of p-menthane monoterpenoids |
柠檬烯几乎是薄荷中所有对薄荷烷型单萜的直接或间接合成前体,其基本构建了此大类化合物的化学骨架,故对柠檬烯合成、修饰及代谢路径的研究具有重要意义。柠檬烯是通过柠檬烯环化酶对开环的GPP环化而得,柠檬烯环化酶在腺毛分泌细胞的细胞质中合成,后经跨膜运输进入质体进行修饰,并在质体中完成柠檬烯的合成和初步化学修饰[42],柠檬烯的主要代谢途径为3位及6位的羟化反应,分别形成反式薄荷烯醇及反式香芹醇,因此通过对3、6位羟化酶的沉默可以大幅度提高柠檬烯在薄荷腺毛中的量[43]。反式薄荷烯醇经还原、异构等反应最终合称为胡薄荷酮,该步反应主要发生于线粒体中,故猜测在此过程中的代谢底物存在质体-内质网-线粒体的转运过程[41, 44]。
胡薄荷酮在整个代谢过程中扮演着代谢中心的角色,它是多种单萜的合成前体,如薄荷呋喃、薄荷酮、薄荷醇等。其中薄荷酮是胡薄荷酮代谢的主要下游产物,共有2种构型,但有研究表明,胡薄荷酮还原酶不存在立体异构的选择特异性,其构型的转变可能为某种异构酶的催化结果[41]。薄荷呋喃被认为是薄荷醇合成过程中的副产物,其量受到外界环境因素的影响,故其亦被认为是植物受到胁迫时的信号成分。薄荷呋喃具有肝毒性,控制薄荷呋喃在薄荷油中的量,有助于提高薄荷油的整体品质,对此有关学者已进行初步尝试[45-46]。除此以外,研究表明薄荷醇作为代谢的最终产物,其在薄荷腺毛中的单一累积主要是由于腺毛结构的阻隔及相关代谢酶的调控所致[7]。本团队在对同为唇形科的裂叶荆芥腺鳞代谢规律研究中发现,其腺鳞中主要萜类的代谢过程与薄荷基本相似,但其最终主要富集产物为胡薄荷酮。本团队猜测此亦与荆芥腺鳞结构的阻隔及相关代谢酶的调控有关[47]。
综上所述,薄荷醇的合成是多种代谢酶相互协作的高效转化过程,可在较短时间内大量合成。在柠檬烯的环状骨架形成后,各催化酶对中间产物中羟基、羰基及双键等位点进行氧化还原修饰,整体过程明朗简洁,具有较高的模式研究意义。
(2) 青蒿素:青蒿素为倍半萜类成分,具有抗疟作用,其主要生成于黄花蒿的头状腺毛中[48-49]。青蒿素的合成主要发生于细胞质中,具体代谢过程见图 2[50],由图 2可知青蒿素的合成过程也主要基于羟基、羰基和双键的氧化还原过程,其发挥药效的环状氧桥结构并不能在腺毛中进行生物合成。黄花蒿的头状腺毛共由8个细胞4层垂直排列而成。对于青蒿素的各分泌过程在这4层细胞中的分布情况,现仍存在较大争议。Ollson等[51]通过激光显微切割及qRT-PCR技术发现,青蒿素合成过程中的关键酶紫穗槐-4,11-二烯合酶(amorpha-4,11-diene synthase,ADS)仅在顶端细胞中有所表达,故推测青蒿素在此合成。而Soetaert等[52]对各层细胞进行转录组学研究,结果表明各层细胞中皆具有青蒿素合成所需的各个催化酶。
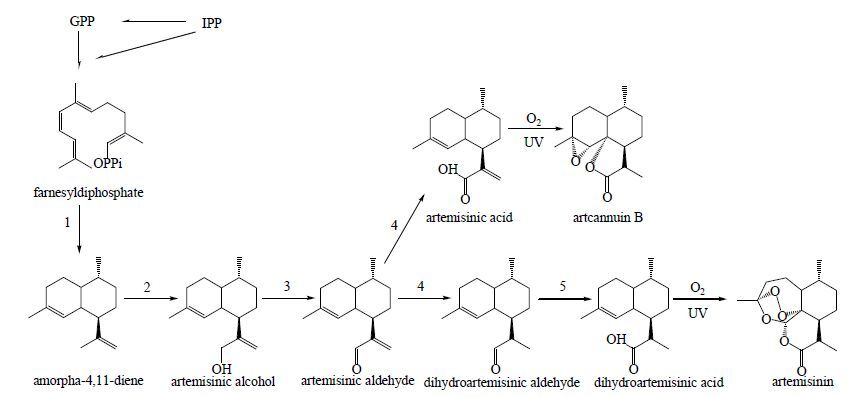
|
1-紫穗槐-4,11-二烯合酶 2-紫穗槐二烯-1,2-羟化酶 3-乙醇脱氢酶 4-青蒿醛Δ11(13) 还原酶 5-醛脱氢酶 1-amorpha-4,11-diene synthase 2-amorphadiene-1,2-hydroxylase 3-alcohol dehydrogenase 4-artemisinic aldehyde Δ11(13) reductase 5-aldehyde dehydrogenase 图 2 青蒿素的代谢过程 Fig.2 Metabolic process of artemisinin |
3.2.2 非萜类化合物
腺毛除了分泌特定的萜类成分外,还含有聚酮、多糖、生物碱等多种非萜类化合物,但这些化合物通常组织特异性不强。故针对该类成分在腺毛中的分布、合成和代谢研究较为冷门,多集中于模式植物[53-55]。对于药用植物,此方面研究仅处于初步定性阶段,大多还不能形成系统性理论体系[56-57]。但随着研究的深入,部分具有生物活性的化合物,已逐渐被证实在腺毛中合成。
金丝桃素是一种具有多种药理活性的聚酮类化合物,其合成场所为腺毛的液泡[58]。聚酮类化合物在腺毛中普遍存在,此类化合物常具有明显的光学特性,故腺毛在荧光显微下可观察到特有的荧光现象。现有的实验表明,聚酮类化合物主要分布于腺毛顶端的角质层下,具有抵抗光学损伤的生理作用[59]。苯丙素类化合物如丁香酚在罗勒的腺毛中能够检出,该类成分为该植物提供了辛辣的气味,以抵抗昆虫的入侵[23, 60]。大麻酚酸类化合物具有极强的镇静、止痛和麻醉生理活性。运用激光显微切割及液质联用技术,分别检测了大麻腺毛的腺头与腺柄,结果发现大麻酚酸类化合物在二者中的量皆非常丰富,由此推测腺头与腺毛可通过内部协作完成大麻酚酸的合成[19]。
4 腺毛代谢的分子调控机制分子调控机制研究一直是腺毛研究的出发点,传统方法是以植物个体作为研究对象,在浩如烟海的遗传信息中“钓取”目的序列,再逐一进行功能性验证。此种方法针对某种特定的酶或催化因子,分析针对性强,几乎所有经典的转化过程皆由此法研究而得[61-64]。但传统方法组织背景高、工作量大、成功率低,并不是一种优秀的研究方案。随着腺毛分离的方法日益成熟,以腺毛为单一研究对象的代谢机制研究逐渐受到关注。腺毛的分离纯化大大降低了研究中的组织背景,使腺毛的代谢特征更加明确。但是所获的腺毛组织样本量较少,从中发现并验证序列功能的研究并不多见。
而“组学”(代谢组学、蛋白质组学、转录组学)研究思路可较好地适应腺毛小样本量的特点。“组学”的研究方法并不单一拘泥于少量的靶向性信息,其旨在运用高灵敏度、高通量的技术手段获得多维度的大容量信息,并以其为分析主体,在更高维度上建立内在关联。在药用植物的腺毛研究中,“组学”的研究方法已逐步受到重视并加以运用。
4.1 蛋白质组学Wu等[65]运用二维凝胶技术比较了黄花蒿腺毛与全叶组织中的蛋白表达情况,共93个无重复蛋白得以定性,这些蛋白涉及电子链传递、青蒿素的生成、糖酵解等多种生物代谢过程。Champagne等[13]对薄荷腺鳞中的总蛋白进行蛋白质组学研究,共定性了1 666条蛋白,其中57条蛋白参与次生代谢,这些蛋白中主要参与单萜、苯丙素、酚醛等化合物的代谢以及相关产物的转运。
4.2 转录组学相比蛋白质组学,转录组学所需的样品量更少,这一技术特点十分贴合腺毛样品量少的特点。Jin等[12]分离了薄荷的腺鳞及无腺鳞的叶肉组织,对二者的转录本进行生物信息学分析。结果显示在鉴定的3 919条Unigenes中,近67%存在明显差异,其中涉及萜类合成、细胞色素P450及脂类转运等多个代谢过程。Soetaert等[52]在黄花蒿腺毛的转录组研究中发现,黄花蒿的头状腺毛为青蒿素等倍半萜类成分的主要合成场所,但非腺毛亦可能合成某些特定萜类成分。值得一提的是,针对单个细胞的转录组学研究已日渐成熟,并逐步运用动物细胞的研究,若此技术运用于腺毛的研究中将有效地提高研究精度,增加人们对腺毛个体化代谢的认识。
5 腺毛合成生物学研究腺毛是植物体中最重要的分泌组织之一,故针对腺毛的基因改造可实现对腺毛内含物的特定改造,主要目的可分为3类:一是提高有效或经济成分的产量;二是降低有害成分的量;三是利用腺毛生产异源性化合物。
5.1 提高有效或经济成分的产量提高有效成分的产量是基因工程不变的主题,在腺毛的实践中也是如此。腺毛基因改造多以上游基因为改造对象,以增加目的产物的量。Mahmoud等[66]通过上调了1-脱氧-D-木酮糖醇-5-磷酸还原异构酶(DXR)酶在薄荷腺毛中的表达,可将薄荷腺毛挥发油产量提高50%,此种改变不会对下游产物的比例造成影响。除此以外,柠檬烯-3-氧化酶是薄荷腺毛中单萜类合成的起始酶,通过抑制该酶活性可大幅度提高柠檬烯在挥发油中的比例(2%~80%)[43]。除了通过改变代谢酶的活性,增加腺毛的密度亦是提高化合物产量的可行方案。Singh等[67]运用农杆菌转化法,培育了携带β-glucosidase基因的黄花蒿品系,大幅度提高了黄花蒿叶与花中腺毛的比例及青蒿素的量。
5.2 降低有害成分的量部分腺毛内含物对人体具有明显的毒害作用,严重影响了挥发油品质,如胡薄荷酮、薄荷呋喃[46]。通过抑制薄荷呋喃生成酶和胡薄荷酮还原酶可以有效地控制二者的量,提升薄荷挥发油的总体品质[45]。
5.3 异源性化合物的生产异源性化合物的生产系指利用基因工程在腺毛中生产非改造对象的原本含有的代谢产物。此种改造技术需要研究者对改造对象的代谢调控情况有着较为全面的理解。贝恩德等[68]对在具有腺毛的植物中生产萜烯及萜类进行了研究并取得了专利,其中共涉及了近80种萜烯及萜类化合物,具有开创性的指导意义。
6 展望以腺毛为着眼点的药用植物研究,有助于在组织、细胞及分子水平上理解药用植物的代谢过程,为药用植物研究注入了更多“自然”和“动态”的研究思想。但腺毛研究现阶段仍然存在众多挑战和困境,这也将是未来腺毛研究的重点。
6.1 腺毛的分离和纯化腺毛的分离和纯化是研究展开的基础,现阶段以激光显微切割为代表的原位取样法可实现腺毛的特化取样,但此种方案需要人工识别目的细胞,无法在短时间内获得大量腺毛。而解离混悬法虽可在短时间内富集大量腺毛,但如此获得的样品即使经过纯化富集仍含有其他植物组织,从而对最终的实验结果造成干扰。如何综合两者的优势,实现短时间内富集大量干净的腺毛,仍值得科研工作者的重点关注。另外,在动物细胞的研究中已然可见类似技术如“Cell sorting”[69],不过如何将此技术真正运用于腺毛研究还需进一步地探讨。
6.2 腺毛内含物检测及非萜类化合物药用植物腺毛内含物中萜类化合物受到了重点关注,其他非萜类化合物的研究较少。此类现象的产生,一方面是由于腺毛自身富含萜类化合物,另一方面也是因为现有化合物检测技术的限制。非萜类化合物大都为非挥发性成分,故定性检测手段主要为液质联用技术。相比于应用于萜类化合物检测的GC-MS技术,液质联用不具备商业化的质谱谱库,对于化合物的鉴定能力较弱。除此以外非萜类化合物大都不具备明显的组织特异性,如黄酮、脂肪酸、烷烃[70]等化合物主要以附着的方式存在于植物体表面,这导致对于某个特定非萜类化合物在腺毛中的定位研究较少。
6.3 腺毛代谢分子调控机制“组学”的研究思路可从小样本量的研究对象中获得大量信息,对腺毛有着良好的适用性。但在保证信息样本“有效性”和“纯净度”的问题上,该方法存在天然的弊端。如在对氨基酸或核苷酸序列进行拼接及功能标注时,“组学”的研究方案需要研究对象具有上一级的生物信息数据以作参考。故研究对象需要有较好的生物信息学研究基础,这从某种程度上增加了实验设计的局限。故相比传统的“个体-钓取-验证”的研究方案,“腺毛-组学”虽然更加便捷,所获信息量也更为丰富与全面,但其仅对模式植物具有较强的适用性。其次该方法更加倾向于解释已知基因在腺毛这一有机生命体中,更高阶的“行为密码”,而不是针对简单的功能状态。综上所述如何实现在更为广泛的植物中,扩大“组学”研究的适用价值必然是叩开腺毛分子调控研究的关键步骤。
我国传统药用植物中存在相当部分的具腺毛的植物,如荆芥、广藿香Pogostemon cablin (Blanco) Benth.、艾叶Artemisia argyi Levl.、白英Solanum lyratum Thunb. 等,其中部分植物可以参考薄荷、黄花蒿等模式植物进行腺毛的代谢研究,这对揭示药用植物自身药性的形成和转变具有良好的指导意义。就现阶段来看国内对于传统药用植物的腺毛研究还仅处于简单的组织化学定性阶段,从植物微观组织下研究药效成分还不为多见,这也预示了其广阔的研究前景。
| [1] | 黄珊珊, 廖景平, 唐源江. 唇形科植物腺毛及其分泌研究进展[J]. 热带亚热带植物学报 , 2005, 13 (5) :452–456. |
| [2] | Gershenzon J, McCaskill D, Rajaonarivony J I, et al. Isolation of secretory cells from plant glandular trichomes and their use in biosynthetic studies of monoterpenes and other gland products[J]. Anal Biochem , 1992, 200 (1) :130–138. DOI:10.1016/0003-2697(92)90288-I |
| [3] | 闫先喜, 胡正海. 薄荷头状腺毛分泌过程的超微结构研究[J]. 生命科学研究 , 1998, 2 (4) :295–304. |
| [4] | 郑宝江, 于丽杰, 邢淑清, 等. 白花罗勒(Ocimum basilium L.)盾状腺毛分泌过程的超微结构研究[J]. 植物研究 , 2002, 22 (2) :176–178. |
| [5] | 丁小余, 施国新, 陈维培. 荇菜腺毛的发育及其分泌过程的超微结构研究[J]. 植物学报 , 1996, 38 (6) :426–430. |
| [6] | 杨永霞, 魏跃伟, 冯琦, 等. 典型生态区烟叶腺毛发育及其分泌物比较研究[J]. 中国烟草学报 , 2014, 20 (5) :38–42. |
| [7] | McConkey M E, Gershenzon J, Croteau R B. Developmental regulation of monoterpene biosynthesis in the glandular trichomes of peppermint[J]. Plant Physiol , 2000, 122 (1) :215–224. DOI:10.1104/pp.122.1.215 |
| [8] | Gershenzon J, Maffei M, Croteau R. Biochemical and histochemical localization of monoterpene biosynthesis in the glandular trichomes of spearmint (Mentha spicata)[J]. Plant Physiol , 1989, 89 (4) :1351–1357. DOI:10.1104/pp.89.4.1351 |
| [9] | Chiang S Y, Grunwald C. Duvatrienediol, alkanes, and fatty acids in cuticular wax of tobacco leaves of various physiological maturity[J]. Phytochemistry , 1976, 15 (6) :961–963. DOI:10.1016/S0031-9422(00)84380-0 |
| [10] | Yamaura T, Tanaka S, Tabata M. Localization of the biosynthesis and accumulation of monoterpenoids in glandular trichomes of thyme[J]. Planta Med , 1992, 58 (2) :153–158. DOI:10.1055/s-2006-961418 |
| [11] | Gershenzon J, Duffy M A, Karp F, et al. Mechanized techniques for the selective extraction of enzymes from plant epidermal glands[J]. Anal Biochem , 1987, 163 (1) :159–164. DOI:10.1016/0003-2697(87)90106-0 |
| [12] | Jin J J, Panicker D, Wang Q, et al. Next generation sequencing unravels the biosynthetic ability of Spearmint (Mentha spicata) peltate glandular trichomes through comparative transcriptomics[J]. BMC Plant Biol , 2014, 14 (1) :1–15. DOI:10.1186/1471-2229-14-1 |
| [13] | Champagne A, Boutry M. Proteomic snapshot of spearmint (Mentha spicata L.) leaf trichomes:a genuine terpenoid factory[J]. Proteomics , 2013, 13 (22) :3327–3332. DOI:10.1002/pmic.v13.22 |
| [14] | Sallets A, Beyaert M, Boutry M, et al. Comparative proteomics of short and tall glandular trichomes of Nicotiana tabacum reveals differential metabolic activities[J]. J Proteome Res , 2014, 13 (7) :3386–3396. DOI:10.1021/pr5002548 |
| [15] | McCaskill D, Gershenzon J, Croteau R. Morphology and monoterpene biosynthetic capabilities of secretory cell clusters isolated from glandular trichomes of peppermint (Mentha piperita L.)[J]. Planta , 1992, 187 (4) :445–454. |
| [16] | Marks M D, Betancur L, Gilding E, et al. A new method for isolating large quantities of Arabidopsis trichomes for transcriptome, cell wall and other types of analyses[J]. Plant J , 2008, 56 (3) :483–492. DOI:10.1111/tpj.2008.56.issue-3 |
| [17] | Clark L J, Hamilton J C, Chapman J V, et al. Analysis of monoterpenoids in glandular trichomes of the catmint Nepeta racemosa[J]. Plant J , 1997, 11 (6) :1387–1393. DOI:10.1046/j.1365-313X.1997.11061387.x |
| [18] | Nonomura T, Xu L, Wada M, et al. Trichome exudates of Lycopersicon pennellii form a chemical barrier to suppress leaf-surface germination of Oidium neolycopersici Conidia[J]. Plant Sci , 2009, 176 (1) :31–37. DOI:10.1016/j.plantsci.2008.09.002 |
| [19] | Happyana N, Agnolet S, Muntendam R, et al. Analysis of cannabinoids in laser-microdissected trichomes of medicinal Cannabis sativa using LC-MS and cryogenic NMR[J]. Phytochemistry , 2013, 87 (11) :51–59. |
| [20] | Olofsson L M, Lundgren A, Brodelius P E. Trichome isolation with and without fixation using laser microdissection and pressure catapulting followed by RNA amplification:Expression of genes of terpene metabolism in apical and sub-apical trichome cells of Artemisia annua L[J]. Plant Sci , 2012, 183 (3) :9–13. |
| [21] | 蒋征, 王红, 吴啟南, 等. 荆芥穗药材腺鳞内含物定性及三种主要萜类的定量研究[J]. 中药材 , 2016, 39 (1) :31–36. |
| [22] | Fischedick J T, Hazekamp A, T. Erkelens, et al. Metabolic fingerprinting of Cannabis sativa L., cannabinoids and terpenoids for chemotaxonomic and drug standardization purposes[J]. Phytochemistry , 2010, 71 (17/18) :2058–2073. |
| [23] | Gang D R, Wang J H, Dudareva N, et al. An investigation of the storage and biosynthesis of phenylpropenes in sweet basil[J]. Plant Physiol , 2001, 125 (2) :539–555. DOI:10.1104/pp.125.2.539 |
| [24] | McDowell E T, Kapteyn J, Schmidt A, et al. Comparative functional genomic analysis of solanum glandular trichome types[J]. Plant Physiol , 2011, 155 (1) :524–539. DOI:10.1104/pp.110.167114 |
| [25] | Wu S Q, Jiang Z D, Kempinski C, et al. Engineering triterpene metabolism in tobacco[J]. Planta , 2012, 236 (3) :867–877. DOI:10.1007/s00425-012-1680-4 |
| [26] | Lange B M, Ketchum R B, Croteau R B. Isoprenoid biosynthesis. metabolite profiling of peppermint oil gland secretory cells and application to herbicide target analysis[J]. Plant Physiol , 2001, 127 (1) :305–314. DOI:10.1104/pp.127.1.305 |
| [27] | Mahmoud S S, Croteau R B. Strategies for transgenic manipulation of monoterpene biosynthesis in plants[J]. Trends Plant Sci , 2002, 7 (8) :366–373. DOI:10.1016/S1360-1385(02)02303-8 |
| [28] | Ahn C S, Pai H S. Physiological function of IspE, a plastid MEP pathway gene for isoprenoid biosynthesis, in organelle biogenesis and cell morphogenesis in Nicotiana benthamiana[J]. Plant Mol Biol , 2008, 66 (5) :503–517. DOI:10.1007/s11103-007-9286-0 |
| [29] | Wang G D, Tian L, Aziz N, et al. Terpene biosynthesis in glandular trichomes of hop[J]. Plant Physiol , 2008, 148 (3) :1254–1266. DOI:10.1104/pp.108.125187 |
| [30] | Xie Z Z, Kapteyn J, Gang D R. A systems biology investigation of the MEP/terpenoid and shikimate phenylpropanoid pathways points to multiple levels of metabolic control in sweet basil glandular trichomes[J]. Plant J , 2008, 54 (3) :349–361. DOI:10.1111/j.1365-313X.2008.03429.x |
| [31] | Lane A, Boecklemann A, Woronuk G N, et al. A genomics resource for investigating regulation of essential oil production in Lavandula angustifolia[J]. Planta , 2010, 231 (4) :835–845. DOI:10.1007/s00425-009-1090-4 |
| [32] | Paetzold H, Garms S, Bartram S, et al. The isogene 1-deoxy-D-xylulose 5-phosphate synthase 2 controls isoprenoid profiles, precursor pathway allocation, and density of tomato trichomes[J]. Mol Plant , 2010, 3 (5) :904–916. DOI:10.1093/mp/ssq032 |
| [33] | Mandal S, Upadhyay S, Wajid S, et al. Arbuscular mycorrhiza increase artemisinin accumulation in Artemisia annua by higher expression of key biosynthesis genes via enhanced jasmonic acid levels[J]. Mycorrhiza , 2015, 25 (5) :345–357. DOI:10.1007/s00572-014-0614-3 |
| [34] | Wolwer-Rieck U, May B, Lankes C, et al. Methylerythritol and mevalonate pathway contributions to biosynthesis of mono-, sesqui-, and diterpenes in glandular trichomes and leaves of Stevia rebaudiana Bertoni[J]. J Agric Food Chem , 2014, 62 (11) :2428–2435. DOI:10.1021/jf500270s |
| [35] | Lange B M, Rujan T, Martin W, et al. Isoprenoid biosynthesis:the evolution of two ancient and distinct pathways across genomes[J]. Proc Natl Acad Sci USA , 2000, 97 (24) :13172–13177. DOI:10.1073/pnas.240454797 |
| [36] | Gershenzon J, McConkey M E, Croteau R B. Regulation of monoterpene accumulation in leaves of peppermint[J]. Plant Physiol , 2000, 122 (1) :205–214. DOI:10.1104/pp.122.1.205 |
| [37] | Turner G W, Gershenzon J, Croteau R B. Distribution of peltate glandular trichomes on developing leaves of peppermint[J]. Plant Physiol , 2000, 124 (2) :655–664. DOI:10.1104/pp.124.2.655 |
| [38] | 房海灵, 李维林, 任冰如, 等. 薄荷属植物的化学成分及药理学研究进展[J]. 中国药业 , 2010, 19 (10) :13–17. |
| [39] | Turner G W, Davis E M, Croteau R B. Immunocytochemical localization of short-chain family reductases involved in menthol biosynthesis in peppermint[J]. Planta , 2012, 235 (6) :1185–1195. DOI:10.1007/s00425-011-1567-9 |
| [40] | Srividya N, Davis E M, Croteau R B, et al. Functional analysis of (4S)-limonene synthase mutants reveals determinants of catalytic outcome in a model monoterpene synthase[J]. Proc Natl Acad Sci USA , 2015, 112 (11) :3332–3337. DOI:10.1073/pnas.1501203112 |
| [41] | Croteau R B, Davis E M, Ringer K L, et al. (-)-Menthol biosynthesis and molecular genetics[J]. Naturwissenschaften , 2005, 92 (12) :562–577. DOI:10.1007/s00114-005-0055-0 |
| [42] | Turner G, Gershenzon J, Nielson E E, et al. Limonene synthase, the enzyme responsible for monoterpene biosynthesis in peppermint, is localized to leucoplasts of oil gland secretory cells[J]. Plant Physiol , 1999, 120 (3) :879–886. DOI:10.1104/pp.120.3.879 |
| [43] | Mahmoud S S, Williams M, Croteau R. Cosuppression of limonene-3-hydroxylase in peppermint promotes accumulation of limonene in the essential oil[J]. Phytochemistry , 2004, 65 (5) :547–554. DOI:10.1016/j.phytochem.2004.01.005 |
| [44] | Turner G W, Croteau R. Organization of monoterpene biosynthesis in mentha. immunocytochemical localizations of geranyl diphosphate synthase, limonene-6-hydroxylase, isopiperitenol dehydrogenase, and pulegone reductase[J]. Plant Physiol , 2004, 136 (4) :4215–4227. DOI:10.1104/pp.104.050229 |
| [45] | Mahmoud S S, Croteau R B. Menthofuran regulates essential oil biosynthesis in peppermint by controlling a downstream monoterpene reductase[J]. Proc Natl Acad Sci USA , 2003, 100 (24) :14481–14486. DOI:10.1073/pnas.2436325100 |
| [46] | Engel W. In vivo studies on the metabolism of the monoterpene pulegone in humans using the metabolism of ingestion-correlated amounts (MICA) approach:explanation for the toxicity differences between (S)-(-)-and (R)-(+)-pulegone[J]. J Agric Food Chem , 2003, 51 (22) :6589–6597. DOI:10.1021/jf034702u |
| [47] | 蒋征, 王红, 张小龙, 等. 裂叶荆芥花穗腺鳞代谢规律研究[J]. 植物科学学报 , 2016, 34 (2) :299–307. |
| [48] | Duke S O, Paul R N. Development and fine structure of the glandular trichomes of Artemisia annua L[J]. Int J Plant Sci , 1993, 154 (1) :107–118. DOI:10.1086/297096 |
| [49] | Duke M V, Paul R N, Elsohly H N, et al. Localization of artemisinin and artemisitene in foliar tissues of glanded and glandless biotypes of Artemisia annua L[J]. Int J Plant Sci , 1994, 155 (3) :365–372. DOI:10.1086/297173 |
| [50] | Wang H Z, Kanagarajan S, Han J L, et al. Studies on the expression of linalool synthase using a promoter-beta-glucuronidase fusion in transgenic Artemisia annua[J]. J Plant Physiol , 2014, 171 (2) :85–96. DOI:10.1016/j.jplph.2013.09.019 |
| [51] | Olsson M E, Olofsson L M, Lindahl A L, et al. Localization of enzymes of artemisinin biosynthesis to the apical cells of glandular secretory trichomes of Artemisia annua L[J]. Phytochemistry , 2009, 70 (9) :1123–1128. DOI:10.1016/j.phytochem.2009.07.009 |
| [52] | Soetaert S S, Van Neste C M, Vandewoestyne M L, et al. Differential transcriptome analysis of glandular and filamentous trichomes in Artemisia annua[J]. BMC Plant Biol , 2013 . DOI:10.1186/1471-2229-13-220 |
| [53] | Schmidt A, Li C, Shi F, et al. Polymethylated myricetin in trichomes of the wild tomato species Solanum habrochaites and characterization of trichome-specific 3'/5'-and 7/4'-myricetin O-methyltransferases[J]. Plant Physiol , 2011, 155 (4) :1999–2009. DOI:10.1104/pp.110.169961 |
| [54] | Kang J H, McRoberts J, Shi F, et al. The flavonoid biosynthetic enzyme chalcone isomerase modulates terpenoid production in glandular trichomes of tomato[J]. Plant Physiol , 2014, 164 (3) :1161–1174. DOI:10.1104/pp.113.233395 |
| [55] | Patra B, Pattanaik S, Yuan L. Ubiquitin protein ligase 3 mediates the proteasomal degradation of glabrous 3 and enhancer of glabrous 3, regulators of trichome development and flavonoid biosynthesis in Arabidopsis[J]. Plant J , 2013, 74 (3) :435–447. DOI:10.1111/tpj.2013.74.issue-3 |
| [56] | 刘孟奇, 杨世勇, 李寒冰. 冬凌草腺毛的形态学及组织化学研究[J]. 西北植物学报 , 2011, 31 (11) :2204–2209. |
| [57] | 彭励, 胡正海. 甘草腺毛的形态发生和组织化学研究[J]. 分子细胞生物学报 , 2007, 40 (6) :395–402. |
| [58] | Duke S O, Canel C, Rimando A M., et al. Current and potential exploitation of plant glandular trichome productivity[J]. Adv Bot Res , 2000, 31 (7) :121–151. |
| [59] | Guo J S, Yuan Y M, Liu Z X, et al. Development and structure of internal glands and external glandular trichomes in pogostemon cablin[J]. PLoS One , 2013, 8 (10) :e77862. DOI:10.1371/journal.pone.0077862 |
| [60] | Deschamps C, Simon J E. Phenylpropanoid biosynthesis in leaves and glandular trichomes of basil (Ocimum basilicum L[J]. Methods Mol Biol , 2010, 643 (4) :263–73. |
| [61] | Crock J, Wildung M, Croteau R. Isolation and bacterial expression of a sesquiterpene synthase cDNA clone from peppermint (Mentha×piperita L.) that produces the aphid alarm pheromone (E)-beta-farnesene[J]. Proc Natl Acad Sci USA , 1997, 94 (24) :12833–12838. DOI:10.1073/pnas.94.24.12833 |
| [62] | Zhang Y, Teoh K H, Reed D W, et al. The molecular cloning of artemisinic aldehyde Delta 11(13) reductase and its role in glandular trichome-dependent biosynthesis of artemisinin in Artemisia annua[J]. J Biol Chem , 2008, 283 (31) :21501–21508. DOI:10.1074/jbc.M803090200 |
| [63] | Ma D, Pu G, Lei C, et al. Isolation and characterization of AaWRKY1, an Artemisia annua transcription factor that regulates the amorpha-4,11-diene synthase gene, a key gene of artemisinin biosynthesis[J]. Plant Cell Physiol , 2009, 50 (12) :2146–2161. DOI:10.1093/pcp/pcp149 |
| [64] | Iijima Y, Gang D R, Fridman E, et al. Characterization of geraniol synthase from the peltate glands of sweet basil[J]. Plant Physiol , 2004, 134 (1) :370–379. DOI:10.1104/pp.103.032946 |
| [65] | Wu T, Wang Y, Guo D. Investigation of glandular trichome proteins in Artemisia annua L. using comparative proteomics[J]. PLoS One , 2012, 7 (8) :e41822. DOI:10.1371/journal.pone.0041822 |
| [66] | Mahmoud S S, Croteau R B. Metabolic engineering of essential oil yield and composition in mint by altering expression of deoxyxylulose phosphate reductoisomerase and menthofuran synthase[J]. Proc Natl Acad Sci USA , 2001, 98 (15) :8915–8920. DOI:10.1073/pnas.141237298 |
| [67] | Singh N D, Kumar S, Daniell H. Expression of beta-glucosidase increases trichome density and artemisinin content in transgenic Artemisia annua plants[J]. Plant Biotechnol J , 2016, 14 (3) :1034–1045. DOI:10.1111/pbi.2016.14.issue-3 |
| [68] | 贝恩德·马库斯·兰格, 里格伯托·里奥斯-埃斯特帕, 葛兰·W·特纳. 在具有腺毛的植物中产生萜烯和萜类:中国, CN102413681A[P]. 2012-04-11. |
| [69] | Birchler A, Berger M, Jaggin V, et al. Seamless combination of fluorescence-activated cell sorting and hanging-drop networks for individual handling and culturing of stem cells and microtissue spheroids[J]. Anal Chem , 2016, 88 (2) :1222–1229. DOI:10.1021/acs.analchem.5b03513 |
| [70] | Samuels L, Kunst L, Jetter R. Sealing plant surfaces:Cuticular wax formation by epidermal cells[J]. Annu Rev Plant Biol , 2008, 58 (3) :683–707. |
 2016, Vol. 47
2016, Vol. 47


