藤茶原植物为葡萄科(Vitaceae)蛇葡萄属Ampelopsis Michx.的显齿蛇葡萄Ampelopsis grossedentata (Hand. -Mazz) W. T. Wang[1],又名甜茶、龙须茶、白茶、霉茶等,主要分布于我国湖南、湖北、贵州、广西、福建等长江以南地区,是近年来研究较多的药食两用植物资源之一。湖南省[2]、福建省[3]、广西壮族自治区[4]等地方中药材标准均有收载。藤茶味甘性凉,有清热解毒、消炎利咽、祛风寒等功效,我国客家、土家族、瑶族、拉祜族、侗族、基诺族等少数民族将嫩叶经加工炮制后服用,用于治疗咽喉炎、皮肤病、感冒发烧、糖尿病、解酒等[5-6]。现代研究表明,藤茶有效成分为黄酮类物质,主要成分有二氢杨梅素、杨梅素、杨梅苷、没食子酸等,具有抗炎、抗肿瘤、降血糖等药理作用[7-8]。
藤茶资源于长江以南地区分布广泛,由于各地气候、生境等条件的差异,必然导致所产藤茶质量上有差异,目前虽然有研究对藤茶资源进行过较大样本的考察[6],但其质量评价研究大多局限于不同产地、不同季节藤茶中二氢杨梅素和总黄酮的测定[9],评价指标单一,相关方面仍缺乏系统全面的研究。目前,指纹图谱已广泛应用于多种药材的质量评价当中,但是其模糊性的特点使其难以充分用于实际生产中,所以在指纹图谱的研究基础上,对其代表性化合物进行定量测定,将指纹图谱与一测多评法相结合起来已经成为了中药质量控制的趋势[10-13]。本研究旨在建立不同产地藤茶的HPLC指纹图谱,通过与对照品对照、相似度评价、主成分分析、聚类分析等识别技术,对所收集的14个样品进行分析归类,并采用一测多评法对代表性化合物进行测定,为藤茶的质量评价与可持续发展提供实验依据。
1 仪器与材料Waters e2695型高效液相色谱仪(在线脱气机、四元泵、自动进样器和DAD检测器);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);SHIMADZU AUW220D电子天平(日本岛津公司)。
乙腈、甲醇为色谱纯(Tedia公司);无水甲醇、无水乙醇、甲酸、磷酸、乙酸均为分析纯(国药集团化学试剂有限公司);二氢杨梅素对照品(自制,质量分数为99.5%)、杨梅素(批号529-44-5,质量分数≥98%)、杨梅苷(批号529-44-2,质量分数≥98%)对照品购于成都德天生物有限公司。
藤茶样品由本课题组于2014年采集,经华中科技大学同济医学院附属同济医院药学部方建国教授鉴定为葡萄科蛇葡萄属显齿蛇葡萄Ampelopsis grossedentata (Hand. -Mazz) W. T. Wang的嫩茎叶,样品经晾干粉碎过筛,装袋保存,样品来源见表 1。
|
|
表 1 样品信息 Table 1 Samples of A. grossedentata |
2 方法与结果 2.1 色谱条件
色谱柱:Agilent Eclipse Plus C18(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.5%甲酸水溶液(B);梯度洗脱条件为0~30 min,10%~18% A;30~70 min,18%~30% A;70~90 min,30%~40% A;90~100 min,40%~10% A;检测波长292 nm(指纹图谱测定、测定二氢杨梅素)、258 nm(测定杨梅苷)、369 nm(测定杨梅素);柱温50 ℃;体积流量0.8 mL/min。
2.2 对照品溶液的制备分别精密称取二氢杨梅素、杨梅素、杨梅苷32.82、0.81、1.40 mg,置于同一10 mL量瓶中,用60%甲醇溶解,定容至刻度,摇匀,即得混合对照品溶液。
2.3 供试品溶液的制备取藤茶粉末0.5 g,加60%甲醇50 mL,称定质量,加热回流提取90 min,冷却至室温,称定质量,补足减失的质量,滤过,取续滤液过0.45 μm滤膜,即得。
2.4 方法学验证 2.4.1 精密度试验精密吸取同一供试品(S14)溶液,在“2.1”项下色谱条件下重复进样6次,记录峰面积,结果二氢杨梅素、杨梅素、杨梅苷质量分数的RSD值分别为0.36%、1.60%、0.99%,以二氢杨梅素的保留时间和峰面积为参照,测得其他共有峰相对保留时间的RSD值为0.06%~0.49%,相对峰面积的RSD为0.09%~1.89%,表明仪器精密度良好,符合指纹图谱的技术要求。
2.4.2 稳定性试验取同一供试品(S14)溶液,按“2.1”项色谱条件,分别在溶液制备后0、2、4、8、12、24 h进行色谱分析,记录峰面积,结果二氢杨梅素、杨梅素、杨梅苷质量分数的RSD值分别为1.42%、1.08%、1.47%,以二氢杨梅素的保留时间和峰面积为参照,测定其他共有峰相对保留时间的RSD为0.38%~1.56%,相对峰面积的RSD为0.44%~3.85%,样品溶液在24 h内基本稳定,符合指纹图谱的相关要求。
2.4.3 重复性试验取同一批药材(S14)6份,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下测定,记录峰面积,结果二氢杨梅素、杨梅素、杨梅苷质量分数的RSD值分别为1.53%、2.04%、1.58%,以二氢杨梅素的保留时间和峰面积为参照,测定其他共有峰相对保留时间的RSD为0.02%~0.39%,相对峰面积的RSD为0.24%~3.91%,表明该方法重复性良好,符合指纹图谱的相关要求。
2.4.4 线性关系考察将混合对照品溶液按2倍稀释法依次稀释4次,得到不同质量浓度的混合对照品溶液,按“2.1”项色谱条件进样分析,以对照品溶液的质量浓度对峰面积积分值进行线性回归分析,得回归方程、相关系数(r)和线性范围,分别为二氢杨梅素:Y=4×107 X-1×106,r=0.999 9,线性范围为0.205~3.28 mg/mL;杨梅素:Y=4×107 X-81 459,r=0.999 7,线性范围为0.005~0.08 mg/mL;杨梅苷:Y=3×107 X-67 278,r=0.999 6,线性范围为0.008 75~0.14 mg/mL。结果表明,二氢杨梅素、杨梅素、杨梅苷在各自的质量浓度范围内与峰面积呈良好的线性关系。
2.4.5 加样回收率试验分别称取6份采自重庆酉阳的藤茶粉末(S14)0.5 g,精密加入适量的二氢杨梅素、杨梅素、杨梅苷对照品,按“2.1”项下色谱条件进样分析。计算二氢杨梅素、杨梅素、杨梅苷的回收率依次为98.35%、102.6%、99.79%,RSD值依次为1.2%、1.7%、1.5%。
2.5 不同产地藤茶指纹图谱共有模式的建立及部分共有峰的指认将14批藤茶按照“2.3”项下方法制备成供试品溶液,按照“2.1”项下色谱条件进样分析,记录各批藤茶的色谱图。将色谱数据(AIA格式)导入“中药色谱指纹图谱相似度评价系统”(2004年A版),首先选定参比图谱及相应参比峰,设定匹配参数,采用中位数的方法进行多点校正,生成指纹图谱共有模式的对照图谱见图 1,其中主要共有峰24个。精密吸取混合对照品溶液10 μL进样测定,通过对照保留时间及紫外扫描光谱,指认了其中3个峰,分别为5号峰(二氢杨梅素)、19号峰(杨梅素)、21号峰(杨梅苷)。

|
5-二氢杨梅素 19-杨梅素 21-杨梅苷 5-dihydromyricetin 19-myricitrin 21-myricetin 图 1 藤茶的对照指纹图谱 Fig.1 Reference fingerprint of A. grossedentata |
2.6 不同产地藤茶指纹图谱的相似度评价
以共有模式作为对照指纹图谱,对14批样品指纹图谱进行相似度评价,结果14批样品图谱的相似度依次为0.997、0.999、0.904、0.998、0.980、0.997、0.997、0.905、1.000、1.000、0.997、0.998、0.996、0.999,结果相似度均大于0.9,表明14批药材相似度良好,各批样品的指纹图谱结果见图 2。

|
图 2 各个藤茶样品的叠加色谱图 Fig.2 Overlapping chromatograms of A. grossedentata |
2.7 指纹图谱的模式识别研究 2.7.1 聚类分析
分别以藤茶指纹图谱中标定的共有峰的峰面积为变量,采用SPSS 19.0数据统计软件,先对原始数据进行标准化,再采用欧氏距离进行系统聚类分析,结果见图 3。根据聚类分析结果,将藤茶药材大致可分为3类,I类包括S3、S4、S5、S7、S8,II类包括S1、S6、S11、S12,III类包括S2、S9、S10、S13、S14。
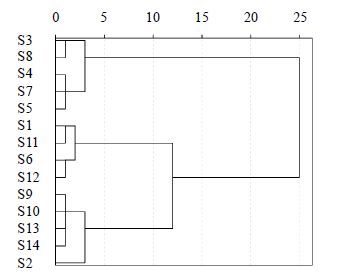
|
图 3 聚类分析树状图 Fig.3 Dendrogram of clustering analysis |
2.7.2 主成分分析
将14批样品24个共有峰的峰面积导入SPSS 19.0软件,数据经标准化后进行主成分分析,主成分个数提取原则是提取主成分对应的特征值大于1的前3个主成分,其累积贡献率达到89.456%,包括大部分信息,其中第1主成分特征值为16.317,方差贡献率为67.989%;第2主成分特征值为3.739,方差贡献率为15.578%;第3主成分特征值为1.413,方差贡献率为5.889%。分别以其第1、2、3主成分建立坐标系,进行投影后可得到所有样本的3D投影图见图 4,图中每个点对应一个样品。结果显示可将藤茶药材分为3类:S3、S5、S8、S13归为I类,S1、S6、S11、S12归为II类,S2、S4、S7、S9、S10、S14归为III类。该结果与聚类分析结果基本一致,但是也存在一定的差异性,主要是因为聚类分析是以各峰的相对峰面积进行数据处理,主成分分析是以各峰的绝对峰面积进行数据处理。
2.8 一测多评法测定藤茶中3种黄酮类化合物的量 2.8.1 相对校正因子(f)的计算以二氢杨梅素作为内参物,按公式fk/m=fk/fm=Ck×Am/(Cm×Ak) 计算,式中Ak为内标物峰面积,Ck为内标物质量浓度,Am为其他组分的峰面积,Cm为其他组分的质量浓度。精密吸取不同质量浓度混合对照品溶液10 μL进样测定,计算杨梅素、杨梅苷的f值,结果显示杨梅素、杨梅苷相对于二氢杨梅素的平均f分别为1.074、1.373,RSD值分别为0.88%、1.53%。

|
图 4 主成分3D得分图 Fig.4 3D score graph of principal component |
2.8.2 高效液相色谱仪及色谱柱耐用性考察
实验考察了LC-20A、Waters e2695 2种高效液相色谱仪,Agilent TC-C18(250 mm×4.6 mm,5 μm)、Agilent Eclipse Plus C18(250 mm×4.6 mm,5 μm)、Ultimate XB-C18(250 mm×4.6 mm,5 μm)3种色谱柱,并计算其f,结果见表 2,说明在不同的色谱柱和色谱系统下耐用性良好。
|
|
表 2 不同色谱柱和色谱系统所测定的f值 Table 2 Relative correction factors determined by different columns and chromatographic systems |
2.8.3 待测组分色谱峰的定位
通过计算在不同色谱仪器或不同色谱柱中各待测成分色谱峰与二氢杨梅素色谱峰的相对保留值(rk/m=tRk/tRm),并结合色谱峰的峰形及紫外光谱,判断其他目标峰的位置。结果显示,相对保留值的波动相对较小,因此采用相对保留值进行成分的定性可行,杨梅苷和杨梅素的相对保留值的平均值为2.667、1.210,其RSD值分别为0.3%、1.7%。
2.8.4 一测多评法与外标法测定结果的比较采用一测多评法和外标法分别计算各批藤茶样品中二氢杨梅素、杨梅素、杨梅苷的量,见表 3。结果显示,这2种方法计算所得的结果不存在显著性的差异,且一测多评法相较于外标法更为简便、易操作、低成本,具有明显的优势。
|
|
表 3 外标法和一测多评法测定藤茶中3种成分结果 (n = 3) Table 3 Determination of three components by external standard method and quantitative analysis of multi-components by single marker (n = 3) |
3 讨论 3.1 提取条件及色谱条件的优化 3.1.1 溶液提取条件的优化
本研究先后考察了水、不同体积分数的甲醇-水、乙醇-水作为溶剂进行冷浸、加热回流、超声提取,并对提取时间和提取次数进行了考察,发现在用水提取时,由于部分二氢杨梅素量极高且二氢杨梅素水溶性较差,溶液不稳定,不宜采用,不同浓度的甲醇和乙醇提取率差别不大,最终通过比较选择得到色谱峰最多、峰面积最大的提取条件为最优条件,最终确定以60%甲醇加热回流提取90 min作为供试品溶液的制备方法。
3.1.2 流动相条件的优化曾用乙腈、甲醇等溶剂系统进行等度洗脱,发现分离效果不理想,较难将藤茶中化学成分逐一分离开来,随后采用梯度洗脱,由于藤茶中主要含有黄酮类化合物,该种成分含有羧基及羟基,为了避免色谱峰的拖尾情况,加酸以改善峰形,进而比较了甲醇-0.5%甲酸、甲醇-0.1%磷酸等流动相,根据所得峰的分离度及重现性,最终确定甲醇-0.5%甲酸水溶液作为流动相。
3.1.3 检测波长的选择采用二极管阵列检测器对藤茶提取物色谱图在200~400 nm波长内进行三维图谱扫描,并比较波长258、292、369 nm处的色谱图,选择色谱峰信息最全面、色谱图的特征性最强的波长为检测波长。结果表明,292 nm处的色谱峰峰面积及峰数量最大,且为二氢杨梅素的最大吸收波长,因此选择292 nm为指纹图谱检测波长及二氢杨梅素测定波长,258、369 nm分别为杨梅苷、杨梅素的最大吸收波长,因此选择该波长作为其测定波长。
3.1.4 色谱柱的考察和优化实验中考察了Agilent TC-C18(250 mm×4.6 mm,5 μm)、Agilent ZORBAX Bonus-RP(250 mm×4.6 mm,3.5 μm)、Agilent Eclipse Plus C18(250 mm×4.6 mm,5 μm)、Diamonsil C18(2)(250 mm×4.6 mm,5 μm)、Ultimate XB-C18(250 mm×4.6 mm,5 μm)5种不同型号色谱柱的分离效果,结果表明在初始选择的色谱条件下,Agilent Eclipse Plus C18(250 mm×4.6 mm,5 μm)色谱柱的分离度、对称性最好,所以选择Agilent Eclipse Plus C18(250 mm×4.6 mm,5 μm)柱为分析色谱柱。
3.2 藤茶的质量评价本实验首次结合指纹图谱和一测多评法对藤茶进行质量评价研究,在建立指纹图谱的基础上,采用一测多评法同时测定藤茶中3种代表性活性成分的量,定性的指纹图谱结合定量的一测多评,为藤茶质量标准的提高研究提供了科学依据。本研究建立了不同产地藤茶指纹图谱的共有模式,得到了24个主要共有峰,指认了其中3个代表性活性成分,并建立了一测多评法对该3种化合物进行测定。将建立的指纹图谱应用于藤茶的质量评价中,对其进行数据分析,相似度结果表明不同产地的藤茶在化学成分组成上基本一致,但仍存在一定的差异,聚类分析及主成分分析结果表明可将上述产地的藤茶大致分为3大类,但是对于藤茶最终的质量评价仍需进行后续谱效关系等方面的研究。
由一测多评结果可知,各批藤茶药材中二氢杨梅素、杨梅素和杨梅苷3种主要活性成分的量存在一定的地区差异性,其中二氢杨梅素量的地区差异尤为明显,这可能与不同产地的地理环境、生态系统、气候条件不同有关,课题组前期研究也发现海拔在500 m以上的环境可能有利于二氢杨梅素的积累。本实验测得藤茶中二氢杨梅素量普遍在12%以上,部分产地的藤茶二氢杨梅素量达20%以上,在植物界极为罕见,同时现有研究也表明藤茶春夏嫩茎叶中二氢杨梅素的量可达干质量的20%以上,幼叶中的心叶可达40%以上[14],藤茶中二氢杨梅素的量与产地生境及采收加工方式有着密切的关系,仍需进一步深入系统探讨。中药材的质量与其植物次生代谢产物的积累密切相关,本实验通过测定藤茶中与二氢杨梅素结构类似的杨梅苷、杨梅素,可有助于藤茶药材的质量控制。同时课题组其他研究中发现藤茶经加工后二氢杨梅素量有极大的提高,在加工过程中是否发生化学成分的变化仍需后续研究,可将本实验所建立的方法应用于不同加工环节藤茶的质量评价及控制当中。此外,藤茶为显齿蛇葡萄,易与大叶蛇葡萄、广东蛇葡萄等同属植物混淆,后续研究中可参考本实验建立的指纹图谱结合一测多评法质量控制模式对藤茶及其易混淆品进行进一步的甄别研究。
| [1] | 中国科学院植物研究所. 中国高等植物图鉴(二册)补编[M]. 北京:科学出版社, 1983. |
| [2] | 湖南省中药材标准[S]. 2009. |
| [3] | 福建省中药材标准[S]. 2006. |
| [4] | 广西壮族自治区壮药质量标准[S]. 2008. |
| [5] | 王婉莹. 藤茶传统药物学及抗氧化活性的初步研究[D]. 北京:北京协和医学院药用植物研究所, 2014. |
| [6] | 许利嘉, 马培, 肖伟, 等. 别样茶-藤茶的古今应用历史初步调查[J]. 中国现代中药 , 2012, 14 (4) :62–66. |
| [7] | Hou X L, Tong Q, Wang W Q, et al. Dihydromyricetin protects endothelial cells from hydrogen peroxide-induced oxidative stress damage by regulating mitochondrial pathways[J]. Life Sci , 2015, 130 :38–46. DOI:10.1016/j.lfs.2015.03.007 |
| [8] | 侯小龙, 王文清, 施春阳, 等. 二氢杨梅素药理作用研究进展[J]. 中草药 , 2015, 46 (2) :603–609. |
| [9] | 王家胜, 何磊磊, 张琪, 等. 不同产地显齿蛇葡萄中二氢杨梅素测定[J]. 中成药 , 2014, 36 (1) :145–147. |
| [10] | 吴玲芳, 林琛, 袁永兵, 等. 叶下珠指纹图谱及模式识别研究[J]. 中草药 , 2015, 46 (4) :572–575. |
| [11] | 袁辉, 赵建勇, 杨文菊. 新疆不同产地雪菊UPLC指纹图谱的建立及其成分测定[J]. 中草药 , 2015, 46 (8) :1223–1226. |
| [12] | Liu X S, Wu Z Z, Yang K, et al. Quantitative analysis combined with chromatographic fingerprint for comprehensive evaluation of Danhong injection using HPLC-DAD[J]. J Pharm Biomed Anal , 2013, 76 :70–74. DOI:10.1016/j.jpba.2012.12.013 |
| [13] | Arceusz A, Wesolowsk M. Quality consistency evaluation of Melissa officinalis L. commercial herbs by HPLC fingerprint and quantitation of selected phenolic acids[J]. J Pharm Biomed , 2013, 83 :215–220. DOI:10.1016/j.jpba.2013.05.020 |
| [14] | 杨志坚, 袁弟顺, 陈凌华, 等. 藤茶中二氢杨梅素的研究概况[J]. 中国茶叶加工 , 2010 (1) :20–22. |
 2016, Vol. 47
2016, Vol. 47



