2. 绥化学院食品与制药工程学院, 黑龙江 绥化 152061
2. School of Food and Pharmaceutical Engineering, Suihua University, Suihua 152061, China
目前肿瘤的治疗主要以化疗为主,其主要通过直接抑制肿瘤细胞增殖、促进肿瘤细胞凋亡达到直接抗肿瘤作用,但化疗药物对正常细胞具有一定的毒副作用,因此寻找治疗肿瘤的靶向药物成为肿瘤药物研发的必然趋势。肿瘤的生物学特点包括:无限增殖性、侵袭与迁移性、自我复制性、抗凋亡性、信号钝化性及无限血管生成性六大特征[1]。近年来“瓦伯格效应”即肿瘤细胞即使在有氧的情况下仍选择糖酵解而不是氧化磷酸化方式提供能量的特点被认为是肿瘤的第七特征[2]。糖酵解提供能量较少,而肿瘤细胞快速增殖需要大量能量,所以肿瘤细胞有氧糖酵解能力大大增强,抑制肿瘤细胞糖酵解将成为靶向抗肿瘤药物研发的一个方向。抑制肿瘤细胞的有氧糖酵解,降低肿瘤细胞能量,就可以抑制肿瘤细胞的增殖、转移、侵袭和耐药性,同时可以改变肿瘤所处的酸性微环境,抑制肿瘤细胞的增殖。
雷公藤属于卫矛科藤本植物,是一味传统中药,主要用于治疗自身免疫性疾病、类风湿性关节炎等疾病,被国内外学者广泛关注[3-5]。但其成分复杂,毒性较大,限制了其临床应用[6]。雷公藤红素为雷公藤的主要活性成分之一,通过抑制蛋白酶体活性进而诱发肿瘤细胞凋亡,其还具有很强的抗氧化作用和抗新生血管生成作用,是值得关注的具有抗肿瘤活性的天然活性产物。雷公藤红素可促进肝癌[7]、非小细胞肺癌A549[8]、人乳腺癌MCF-7[9]、前列腺癌PC-3[10]、慢性白血病T315[11]等肿瘤细胞凋亡,达到广泛的抗肿瘤作用。本研究在观察雷公藤红素对人胃癌细胞SGC-7901和人脐静脉内皮细胞ECV304增殖抑制作用的基础上,研究其对肿瘤细胞和内皮细胞能量代谢中有关糖酵解和氧化磷酸化酶活力和能量代谢调控蛋白表达的影响,初步揭示雷公藤红素对肿瘤细胞和肿瘤血管内皮细胞能量代谢的干预和作用机制。
1 材料 1.1 主要仪器Mco-15AC CO2培养箱(日本SANYO El公司);CX21显微镜、CKX 41倒置显微镜(日本Olympus公司);3K30高速冷冻离心机(德国Sigma);核酸蛋白测定仪RS232C(德国Eppendorf公司);Tanon Gis-2019凝胶成像系统(天能科技有限公司);紫外可见分光光度计(北京普析通用有限责任公司);Model 680酶标仪、Mini-Protein电泳仪、TRANS OT-SD电转槽(美国Blo-rad)。
1.2 药品与试剂雷公藤红素(成都曼斯特生物技术有限公司,质量分数≥99.5%,批号MUST-13121802);RPMI 1640培养液(美国Gibco试剂公司);己糖激酶(HK)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)、琥珀酸脱氢酶(SDH)、三磷酸腺苷(ATP)试剂盒(均购自南京建成生物工程研究所);BCA试剂盒(碧云天生物技术公司);低氧诱导因子-1α(HIF-1α)抗体(武汉博士德生物工程有限公司);单羧基转运体(MCT-4)抗体(武汉博士德生物工程有限公司);小鼠抗β-actin、山羊抗兔IgG、山羊抗小鼠IgG、DAB显色液(北京中杉金桥生物科技有限公司)。5-氟尿嘧啶(5-Fu,上海旭东海普药业有限公司),MTT、台盼蓝(Biosharp生物科技有限公司)。
1.3 细胞株人胃癌SGC-7901细胞株、人脐静脉内皮ECV304细胞株(中国科学院上海细胞生物研究所)。
2 方法 2.1 细胞培养将SGC-7901和ECV304细胞复苏后接种于无菌的培养瓶中,5% CO2、37 ℃、含10%胎牛血清的RPMI 1640培养液中培养,当细胞长满培养瓶80%以上时,0.25%胰酶消化传代。培养代数在30~40代内。
2.2 雷公藤红素对细胞生长和形态的影响 2.2.1 MTT法取对数生长期的SGC-7901和ECV304细胞,胰蛋白酶消化后制成密度为5×104/mL的细胞悬液,每孔加入100 μL细胞悬液于96孔板内,培养24 h。设置不同质量浓度的雷公藤红素(1.5、2.0、2.5、3.0、3.5、4.0 μg/mL)6个剂量组,阳性对照为5-Fu(10 μg/mL),对照组为无血清RPMI 1640培养基,每组各设3个复孔,给药后继续培养48 h。每孔加10 μL MTT继续培养4 h。弃原液,每孔加150 μL DMSO混匀,于490 nm波长检测吸光度(A)值。计算细胞增殖抑制率,确定给药浓度。

|
取对数生长期的SGC-7901和ECV304细胞,胰蛋白酶消化后制成密度为5×104/mL的细胞悬液,每孔加入400 μL细胞悬液于24孔板内。37 ℃、5% CO2培养24 h。吸弃原培养液,雷公藤红素组每孔分别加400 μL雷公藤红素,使其终质量浓度为3 μg/mL,对照组加400 μL无血清RPMI 1640培养液,继续培养24 h,弃原培养液,PBS漂洗3次,加入胰蛋白酶消化,将细胞悬液与台盼蓝(0.4%)溶液按9:1混合,光镜下计数活细胞数,每天取3孔,每孔计数3次,求平均值,以存活细胞数为纵坐标,培养时间为横坐标,绘制7 d的细胞生长曲线。
2.2.3 HE染色取对数生长期的SGC-7901和ECV304细胞,胰蛋白酶消化后制成密度为5×104/mL的细胞悬液,每孔1 mL细胞悬液加于放有盖玻片的6孔板内,37 ℃、5% CO2培养箱中培养24 h。吸弃原培养液,实验组每孔分别加入1 mL雷公藤红素,使得雷公藤红素终质量浓度为3 μg/mL,对照组每孔加入等体积的无血清RPMI 1640培养基,培养48 h。吸弃原培养液,PBS溶液漂洗,95%乙醇固定,苏木精、伊红染液,不同梯度乙醇脱水,二甲苯透明,镜下观察拍照。
2.3 雷公藤红素对细胞能量代谢的影响 2.3.1 能量代谢相关酶的活力测定取对数生长期的SGC-7901和ECV304细胞,胰蛋白酶消化后制成密度为5×104/mL的细胞悬液,每瓶6 mL细胞悬液接种培养瓶后,37 ℃、5% CO2培养箱中培养24 h。每种细胞分为雷公藤红素(3 μg/mL)组、无血清RPMI 1640培养基对照组,给药48 h后,胰蛋白酶消化,加2 mL含血清RPMI 1640培养基吹打制成均匀的细胞悬液。2 000 r/min离心5 min,弃上清。用生理盐水洗涤制成细胞悬液,将细胞悬液加入到石英细胞匀浆器中,冰上手动匀浆6~8次,每次匀浆1 min,间隔0.5 min,BCA法绘制标准曲线并计算样品蛋白浓度。根据试剂盒测定HK、PK、LDH活力来研究雷公藤红素对2种细胞糖酵解过程的影响。测定SDH的活力来研究雷公藤红素对2种细胞氧化磷酸化的影响,具体操作过程见试剂盒说明书。
2.3.2 能量代谢ATP的定量测定细胞培养、分组及加药同“2.3.1”项,给药48 h后,胰蛋白酶消化,加2 mL含血清RPMI 1640培养基吹打制成均匀的细胞悬液。2 000 r/min离心5 min,弃上清。用生理盐水洗涤制成细胞悬液。将细胞悬液加入适量双蒸水中,沸水浴中匀浆破碎后继续加热10 min,将悬液取出涡旋混匀1 min,离心后取上清液测定。根据ATP测定试剂盒来测定2种细胞ATP的量,具体操作过程见试剂盒说明书。
2.3.3 能量代谢相关调控蛋白表达的测定细胞培养、分组及加药同“2.3.1”项,给药培养48 h,每组细胞冷PBS(4 ℃)洗涤3次,每瓶细胞加150 μL裂解液裂解完后,用细胞刮刀将细胞刮下,收集至1.5 mL离心管中。取出蛋白提取液,加入上样缓冲液,煮沸离心-20 ℃保存。Western blotting法检测细胞中HIF-1α和MCT-4蛋白表达水平。
2.4 数据统计学分析实验数据采用x±s表示,应用SPSS 20.0软件进行统计分析,组间比较采用t检验。
3 结果与分析 3.1 雷公藤红素对2种细胞生长的影响 3.1.1 对细胞增殖的影响雷公藤红素对SGC-7901和ECV304细胞具有一定的增殖抑制作用,较小剂量可达到明显抑制作用,其对SGC-7901和ECV304的半数抑制浓度(IC50)值分别为4.23、3.50 μg/mL,雷公藤红素对SGC-7901细胞增殖抑制梯度变化明显,具有剂量依赖性,对ECV304细胞增殖抑制作用未见明显的梯度变化,1.5 μg/mL时对ECV304细胞的增殖抑制率达38%。结果见图 1。
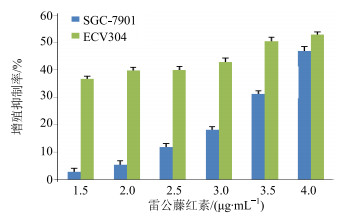
|
图 1 雷公藤红素对SGC-7901和ECV304细胞增殖的影响(x±s, n=3) Fig.1 Effect of celastrol on proliferation of SGC-7901 cells and ECV304 cells by MTT (x±s, n=3) |
3.1.2 对细胞生长曲线的影响
由生长曲线图 2可知,与对照组相比,雷公藤红素对SGC-7901和ECV304细胞有较强的增殖抑制作用。在给药48 h后细胞浓度开始降低,雷公藤红素对SGC-7901和ECV304细胞分别在第6天和第4天可达到最大抑制效应。
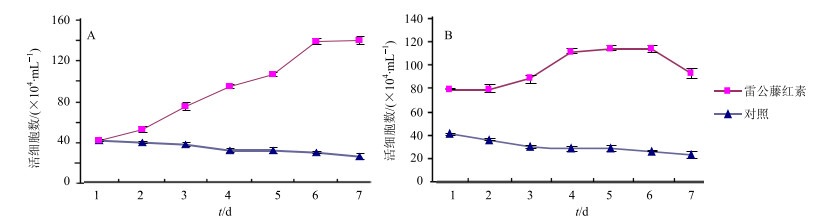
|
图 2 雷公藤红素对SGC-7901 (A)和ECV304 (B)细胞增殖影响的生长曲线 Fig.2 Growth curves of celastrol effect on proliferation of SGC-7901 (A) and ECV304 (B) cells |
3.1.3 对细胞形态的影响
HE染色结果如图 3所示,与对照组相比,雷公藤红素可引起SGC-7901和ECV304细胞数量减少,细胞形态发生变化,细胞变圆,体积缩小,核深染,胞质凝集,颜色变深,雷公藤红素对ECV304细胞作用强于SGC-7901,表明雷公藤红素对SGC-7901细胞增殖具有抑制作用,对肿瘤血管生成可能具有抑制作用。
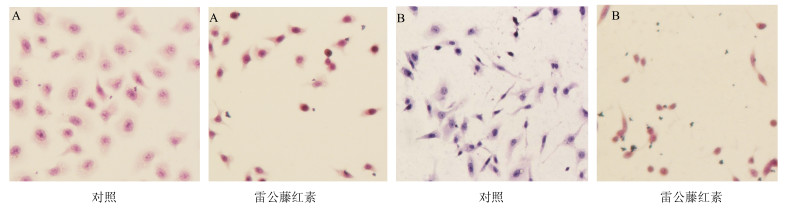
|
图 3 雷公藤红素对SGC-7901 (A)及ECV304 (B)细胞形态的影响 Fig.3 Effect of celastrol on cell morphology of SGC-7901 (A) and ECV3041 (B) cells |
3.2 雷公藤红素对细胞能量代谢的影响 3.2.1 雷公藤红素对能量代谢相关酶活力的影响
结果表明雷公藤红素能够显著降低SGC-7901和ECV304细胞内HK和LDH的活力,与对照组相比,雷公藤红素使SGC-7901和ECV304细胞HK活力分别降低了48%、35%,LDH的活力分别降低了76%、64%。雷公藤红素对SGC-7901作用强于ECV304细胞,雷公藤红素对2种细胞内的PK活力均无明显影响。雷公藤红素主要通过影响糖酵解途径的HK和LDH而抑制糖酵解,降低糖酵解产物-乳酸的生成,改善2种细胞酸性微环境。结果见表 1。
|
|
表 1 雷公藤红素对SGC-7901和ECV-304细胞内能量代谢相关酶及ATP的影响 Table 1 Effect of celastrol on relevant energy metabolism enzymes and ATP of SGC-7901 and ECV304 cells |
线粒体是细胞有氧氧化的主要载体,SDH是线粒体的标志性酶。结果显示,与对照组比较,雷公藤红素作用的SGC-7901和ECV304细胞内SDH活力值分别下降了27%、66%,雷公藤红素影响SDH活力降低氧化磷酸化能量的生成,对内皮细胞的影响大于肿瘤细胞。结果见表 1。
3.2.2 雷公藤红素对细胞ATP量的影响ATP是能量代谢的主要产物,是能量贮存和利用中心,雷公藤红素显著降低了SGC-7901和ECV304细胞内ATP总量。与对照组相比,雷公藤红素使SGC-7901和ECV304细胞的ATP量分别降低了39%和42%,对ECV304细胞的作用强于SGC-7901,其对SGC-7901和ECV304细胞的能量生成都具有一定的抑制作用。结果见表 1。
3.2.3 雷公藤红素对细胞内HIF-1α和MCT-4蛋白表达的影响实验结果显示,2种细胞β-actin条带整齐且灰度值差别在±10以内,说明各组蛋白的量相同,有可比性,对照组中SGC-7901内HIF-1α和MCT-4蛋白的相对表达率均较高,达70%以上,ECV304中表达较低,不足35%。与对照组相比,雷公藤红素作用后的SGC-7901和ECV304细胞HIF-1α和MCT-4蛋白相对表达率明显降低(P<0.05),对SGC-7901细胞的抑制作用明显大于ECV304细胞。结果见图 4。结果表明雷公藤红素通过抑制2种细胞内HIF-1α和MCT-4的表达,干扰2种细胞能量生成达到抑制肿瘤细胞增殖和肿瘤血管生成的双重抗肿瘤作用。
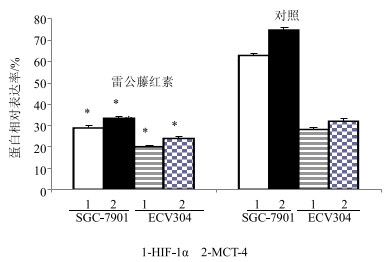
|
与对照组比较:P<0.05 **P<0.01 P < 0.05 **P < 0.01 vs control group 图 4 雷公藤红素对SGC-7901和ECV304细胞内HIF-1α和MCT-4蛋白表达的影响 Fig.4 Effect of celastrol on protein expression of HIF-1α and MCT-4 in SGC-7901 and ECV304 cells |
4 讨论
肿瘤已成为危害人类健康的主要疾病,肿瘤的防治成为全世界面临的难题。目前,虽然已经有很多的化学合成类抗肿瘤药物问世并进入临床,但这类药物副作用较强,限制了抗肿瘤药物的应用范围。随着人们对中药抗肿瘤的研究,天然活性成分由于易合成、疗效稳定、机制明确等特点得到了越来越多学者的关注[12]。雷公藤红素通过抑制蛋白酶体活性进而诱发癌细胞凋亡,其还具有很强的抗氧化作用和抗血管生成作用,是值得关注的具有抗肿瘤活性的天然活性产物[13]。
本实验采用MTT法、生长曲线法和HE染色法观察雷公藤红素对SGC-7901、ECV304细胞的增殖抑制作用。雷公藤红素对SGC-7901细胞、ECV304细胞均具有增殖抑制作用,具有剂量和时间的依赖性。雷公藤红素还可引起SGC-7901、ECV304细胞数目减少、形态变化明显,表现为细胞变圆,体积缩小,核深染,胞质凝集,颜色变深。说明雷公藤红素可抑制肿瘤细胞增长和肿瘤血管生成,达到较强的抗肿瘤作用。
肿瘤细胞的增殖、浸润、转移、自噬、耐药性、对化疗的敏感性、癌基因和胞内信号通路激活等需要大量能量,开启肿瘤不断适应环境和自我防御机制,所以恶性肿瘤可能是“代谢和能量失衡疾病”,通过抑制肿瘤细胞能量代谢,可以达到抑制肿瘤生长和转移目的[14]。肿瘤细胞受低氧环境的诱导,基因突变等因素的影响使糖酵解相关酶活性增高,并上调细胞内HIF-1α、MCT-4、血管内皮生长因子(VEGF)、葡萄转运体(GLUT)等蛋白的表达,致使肿瘤细胞内乳酸大量堆积。肿瘤细胞选择糖酵解代谢以便获得更多的能量ATP,这在某种程度上触发一种恶性肿瘤表型。一些药物通过干扰肿瘤细胞能量代谢的关键酶活性可影响到肿瘤生长,并可能成为肿瘤的靶向治疗药物[15]。
实验通过检测雷公藤红素对于SGC-7901、ECV304细胞内糖酵解途径关键酶(HK、PK、LDH)、氧化磷酸化酶(SDH)的活力,初步表明雷公藤红素对2种细胞能量代谢影响的作用机制。HK、PK是糖酵解过程中的主要限速酶,其活性受到变构效应物及共价修饰的调节,HK是糖酵解的第1个关键酶,使得葡萄糖生成6磷酸葡萄糖;PK是最后1个关键酶,能够使得磷酸烯醇式丙酮酸生成丙酮酸;LDH是糖酵解过程中最后1个酶,使得丙酮酸生成乳酸,决定糖酵解最终产物乳酸生成量的多少,也决定了肿瘤细胞形成独特的酸性微环境。雷公藤红素可明显降低SGC-7901和ECV304细胞的HK和LDH活力,抑制糖酵解的产能过程,抑制糖酵解的终产物-乳酸生成,雷公藤红素对SGC-7901糖酵解的酶活力影响大于ECV304,表明其对肿瘤细胞的增殖抑制过程主要通过干扰糖酵解过程实现的,改善肿瘤酸性微环境,抑制肿瘤细胞增殖、转移和抗药性,对2种细胞内PK活力影响不敏感,说明雷公藤红素对细胞能量代谢不同酶的作用具有选择性。
柠檬酸循环(TCA)为有氧条件下葡萄糖供能的主要过程,此过程在线粒体内完成。线粒体的标志性酶SDH催化琥珀酸氧化生成延胡索酸并以FAD为电子受体生成FADH2,释放1.5个ATP。实验中对SDH的活力测定表明,与对照组比较,雷公藤红素明显抑制SGC-7901、ECV304细胞内SDH活力,导致细胞内氧化磷酸供能减少,影响糖有氧氧化产能,从而抑制2种细胞增殖和转移。雷公藤红素对ECV304细胞的SDH活力抑制作用远远强于SGC-7901,这说明雷公藤红素主要通过干扰糖的氧化磷酸化过程抑制血管内皮细胞的增殖。
无氧糖酵解和氧化磷酸化最终的目的都是为肿瘤细胞增殖、转移等活动提供能量(ATP)。雷公藤作用后SGC-7901、ECV304细胞能量代谢产物ATP明显降低,能量生成受到抑制,与前面酶活性检测结果相一致。
肿瘤细胞由于快速增殖,处于低氧状态,从而促进了HIF-1α的表达,一方面通过信号传导使得肿瘤细胞快速增殖,另一方面,HIF-1α可以提高糖酵解酶的活性,促进肿瘤细胞产生大量能量,加速肿瘤增殖速率。MCT-4为细胞膜上的转运蛋白,促进糖酵解产生的乳酸运输到细胞外,形成细胞酸性微环境,这种酸性微环境可进一步促进肿瘤细胞增殖和提高肿瘤细胞耐药性。实验采用Western blotting法,探究雷公藤红素对SGC-7901和ECV304细胞HIF-1α和MCT-4蛋白相对表达的影响,从分子水平来揭示影响细胞能量代谢的作用机制。实验结果显示,对照组中SGC-7901内HIF-1α和MCT-4蛋白的相对表达率均较高,ECV304中表达较少。雷公藤红素作用后的SGC-7901和ECV304细胞中HIF-1α和MCT-4蛋白相对表达率与对照组相比明显降低(P<0.05),雷公藤红素对SGC-7901细胞的抑制作用明显大于ECV304细胞。进一步说明雷公藤红素主要通过干扰肿瘤细胞糖酵解酶(HK和LDH)和糖酵解最终产物(乳酸)来达到抑制肿瘤细胞增殖的作用。
综上所述,雷公藤红素对SGC-7901和ECV304增殖活性及能量代谢相关酶和直接供能物质ATP生成抑制作用显著,表明雷公藤红素具有抑制肿瘤细胞增殖和肿瘤血管生成的双重抗肿瘤作用,且其作用是通过干扰能量代谢的相关蛋白和酶而使得产生能量的ATP降低所造成的。
| [1] | Hanahan D, Weinberg R A. The hallmarks of cancer[J]. Cell , 2000, 100 (1) :57–70. DOI:10.1016/S0092-8674(00)81683-9 |
| [2] | Kroemer G, Pouyssegur J. Tumor cell metabolism: cancers Achilles heel[J]. Cancer Cell , 2008, 13 (6) :472–482. DOI:10.1016/j.ccr.2008.05.005 |
| [3] | 刘为萍, 刘素香, 唐慧珠, 等. 雷公藤研究新进展[J]. 中草药 , 2010, 41 (7) :215–1218. |
| [4] | Qin D P, Zhou Y J, Zhang S Z, et al. Anti-inflammation of Tripterygium wilfordii polycoride on macrophages and its regulation to inflammation via TLR4/NF-κB[J]. Chin Herb Med , 2015, 7 (2) :155–161. DOI:10.1016/S1674-6384(15)60032-6 |
| [5] | 张敏, 王守安, 刘黎星. 雷公藤多苷干预TLR-NF-κB通路发挥免疫抑制作用[J]. 中草药 , 2014, 45 (9) :1288–1292. |
| [6] | 李春杏, 李太生, 朱珠, 等. 雷公藤抗炎免疫调节活性单体的研究进展[J]. 中国中药杂志 , 2014, 39 (21) :4159–4164. |
| [7] | Jiang H L, Jin J Z, Wu D, et al. Celastrol exerts synergistic effects with PHA-665752 and inhibits tumor growth of c-Met-deficient hepatocellular carcinoma in vivo[J]. Mol Biol Rep , 2013, 40 (1) :4203–4209. |
| [8] | Mou H, Zheng Y, Zhao P, et al. Celastrol induces apoptosis in non-small-cell lung cancer A549 cells through activation of mitochondria and Fas/FasL mediated pathways[J]. Toxicol In Vitro , 2011, 25 (5) :1027–1032. DOI:10.1016/j.tiv.2011.03.023 |
| [9] | Yang H S, Kim J Y, Lee J H, et al. Celastrol isolated from Tripterygium regelii induces apoptosis through both caspase -dependent and-independent pathways in human breast cancer cells[J]. Food Chem Toxicol , 2011, 49 (2) :527–532. DOI:10.1016/j.fct.2010.11.044 |
| [10] | Sha M, Ye J, Zhang L X, et al. Celastrol induces apoptosis of gastric cancer cells by miR-146a inhibition of NF-κB activity[J]. Cancer Cell Intern , 2013, 13 (50) :2–8. |
| [11] | Lu Z, Jin Y, Qiu L, et al. Celastrol, a novel HSP90 inhibitor, depletes Bcr-Abl and induces apoptosis in imatinib-resi stant chronic myelogenous leukemia cells harboring T315 I mutation[J]. Cancer Lett , 2010, 290 (2) :182–191. DOI:10.1016/j.canlet.2009.09.006 |
| [12] | Cheng J K, Lee P, Wang Z X, et al. Regulation of cell proliferation and cell cycle progression by SUMO specific protease I is ediated through cyclin D1 induction [C]. AACR Meeting Abstracts, 2006, 47: 755-756. |
| [13] | 谢勇, 闫燕艳, 尉杰忠, 等. 雷公藤红素诱导胃癌细胞株MGC803凋亡作用研究[J]. 中国药理与临床 , 2010, 26 (5) :31–33. |
| [14] | Bartrons R, Caro J. Hypoxia, glucose metabolism and the Warburgs effect[J]. J Bioenerg Biomembr , 2007, 39 (3) :223–229. DOI:10.1007/s10863-007-9080-3 |
| [15] | 刘宇, 季宇彬. 肿瘤细胞的凋亡及其分子机制研究[J]. 哈尔滨商业大学学报:自然科学版 , 2008, 24 (5) :524–527. |
 2016, Vol. 47
2016, Vol. 47

