2. 江西中医药大学, 江西 南昌 330004
2. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
百药煎Chinese gall leaven为五倍子Chinensis Galla和茶叶、酵曲的发酵品。五倍子经发酵后,功效发生改变。明•李时珍《本草纲目》记载“其体轻虚,其性浮收,且味带餘甘。治上焦心肺、咳嗽、痰饮、热渴诸病,含噙尤为相宜”。百药煎味酸、咸、微甘,性平;归肺、胃经;具有润肺化痰、生津止渴的功效[1];用于治疗呼吸系统和消化系统疾病,如支气管炎、哮喘、咽喉、胃肠炎有显著的疗效[2-3]。没食子酸、鞣花酸均具有抗菌作用,为其主要有效成分[4-6]。本品名称始见于宋•《三因极一病症方论》,而其炮制方法始载于明代,《本草蒙筌》《本草纲目》《医学入门》和《医宗粹言》中均有记载。目前,《中国药典》各版和《全国炮制规范》均无百药煎炮制工艺的相关记载;《中华本草》《中药大辞典》,浙江、江西地方炮制规范,北京中药材标准,京帮、武汉文帮[7-13]均有其炮制工艺的记载。这些炮制工艺的特点在于采用传统发酵法进行发酵,即自然发酵法,不足之处在于自然环境下发酵,温度湿度容易受天气变化的影响,也易参杂致病菌种,很难保证用药安全。且这些工艺各异,所用的辅料也各不相同,操作过程中,人为影响因素过多。
现代发酵法则改善了发酵条件,即采用单一菌种在恒温恒湿条件下发酵。本实验对现代百药煎炮制工艺研究结果[14-16]进行总结后发现,影响发酵质量的3大因素为发酵菌种、发酵基质(茶叶种类)和发酵条件(温度、湿度)。本研究经过预试验确定了发酵的温度和湿度,采用正交设计法[17-18],以没食子酸、鞣花酸的质量分数和抗菌活性为评价指标,通过多指标综合加权评分法,考察发酵菌种类、茶叶种类、物料比对百药煎工艺的影响,以对百药煎的炮制工艺进行考察,为其工艺的规范化提供参考。
1 仪器与材料岛津LC-20AT型高效液相色谱仪,SPDM20A检测器,岛津企业管理(中国)有限公司;CPA2250型万分之一的电子分析天平,赛多利斯科学仪器北京有限公司;KQ-300DE型数控超声波清洗器,昆山市超声仪器有限公司;101型电热鼓风干燥箱,北京中兴伟业仪器有限公司;YX-24LDJ型号高压灭菌锅,广州江滨贸易有限公司;YT-CJ-2ND型超洁净工作操作台,北京亚泰科隆仪器技术公司;SC-3610低速离心机,安徽中科中佳科学仪器有限公司;BIC-400型培养箱,北京科实兴业科技有限公司。
没食子酸对照品,批号110831-200803,质量分数大于99%,购自中国食品药品检定研究院,供定量测定用;鞣花酸对照品,批号130810,购自深圳博泰康泰医药科技有限公司,供定量测定用,质量分数大于98%。根霉曲购自广西桂林全州宝山酒曲厂,黑曲霉购自沂源康源生物科技(山东)有限公司,安琪曲购自安琪酵母股份有限公司。绿茶、红茶、普洱茶均购自北京张一元茶庄,产地均为云南。金黄色葡萄球菌ATCC6538,批号A1008B,购自上海鲁微科技有限公司。牛津杯(规格:内径6 mm,外径7.8 mm,高10 mm)购自北京易秀博古生物科技有限公司。色谱纯甲醇、乙腈购自美国Fisher公司;三氟乙酸购自国药集团化学试剂有限公司,水为娃哈哈纯净水。
五倍子Chinensis Galla原药购自北京同仁堂,产地为四川,经中国中医科学院中药研究所冯学锋研究员鉴定为漆树科植物盐肤木Rhus chinensis Mill.和青麸杨Rhus potaninii Maxim.叶上的虫瘿,主要由五倍子蚜Melaphis chinensis (Bell) Baker寄生而形成。
净五倍子粉末的制备方法:敲开,除去杂质,粉碎,过80目筛,即得。
2 方法与结果 2.1 HPLC法测定没食子酸和鞣花酸 2.1.1 色谱条件色谱柱为Kromasil C18柱(150 mm×4.6 mm,5 μm);流动相乙腈-0.1%三氟乙酸水溶液,梯度洗脱:0~8 min,5%乙腈;8~14 min,5%~10%乙腈;14~17 min,10%~15%乙腈;17~26 min,15%乙腈;26~42 min,15%~20%乙腈;42~55 min,20%乙腈;55~65 min,20%~40%乙腈;65~70 min,40%乙腈;色谱记录时间45 min;体积流量0.8 mL/min;柱温25 ℃;检测波长280 nm;进样量10 μL;色谱图见图 1。
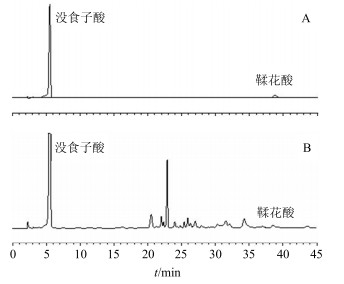
|
图 1 混合对照品(A)及百药煎样品(B)的HPLC图 Fig.1 HPLC of mixed reference substances (A) and sample of Chinese gall leaven (B) |
2.1.2 对照品溶液的制备
精密称取没食子酸和鞣花酸对照品适量,置25 mL量瓶中,加甲醇溶解稀释至刻度,摇匀,得含没食子酸0.106 g/L,鞣花酸0.103 g/L对照品储备液。
2.1.3 供试品溶液的制备取百药煎粉末(过4号筛)约0.25 g,精密称定,置100 mL具塞锥形瓶中,精密加入甲醇25 mL,称定质量,超声处理(功率300 W,频率40 kHz)30 min,放冷置室温,称定质量,用甲醇补减失的质量,摇匀,滤过,去初滤液,取续滤液,过0.2 μm微孔滤膜,即得。
2.1.4 线性关系考察分别取没食子酸、鞣花酸对照品适量,精密称定,置同一25 mL量瓶中,加甲醇至刻度,摇匀。依次进行等度稀释,得没食子酸质量浓度分别为0.605 5、0.807 3、1.009 1、1.210 9、1.412 7、1.614 6、2.018 2 g/L的溶液,鞣花酸质量浓度分别为31.24、62.48、78.10、93.72、109.34、156.20、218.68 mg/L的溶液,每个质量浓度均进样10 μL。以进样量为横坐标(X),峰面积积分值为纵坐标(Y)绘制标准曲线,计算得回归方程为没食子酸Y=2.71×107 X+2.38×106,r=0.999 9;鞣花酸Y=2.28×107 X-8.29×106,r=0.999 7;结果表明没食子酸在6.01~20.18 μg、鞣花酸在0.31~2.19 μg呈良好线性关系。
2.1.5 精密度试验取表 1中的7号样品供试品溶液10 μL,连续进样6次,分别记录没食子酸、鞣花酸的峰面积,计算2个成分峰面积的RSD分别为0.31%、0.87%,表明仪器性能良好。
|
|
表 1 L9(34)正交试验设计与结果 Table 1 Design and results of L9(34) orthogonal test |
2.1.6 稳定性试验
取同一供试品(表 1中的7号)溶液10 μL,于0、1、2、6、12、24 h分别进样测定,分别记录没食子酸和鞣花酸的峰面积,计算2个成分峰面积的RSD分别为1.60%、1.99%,表明供试品溶液在24 h内稳定。
2.1.7 重复性试验取表 1中的7号样品约0.25 g,精密称定,制备供试品溶液,平行6份,分别进样测定,计算得没食子酸、鞣花酸质量分数的RSD分别为0.77%、1.80%,表明样品制备方法重复性良好。
2.1.8 加样回收率试验取同一百药煎(表 1中的7号)粉末6份,每份约0.125 g,精密称定,分别精密加入没食子酸和鞣花酸对照品适量,制备供试品溶液,测定,计算得没食子酸、鞣花酸的平均回收率分别为97.28%、104.62%,RSD分别为2.11%、1.60%。
2.1.9 样品测定取正交试验制备的9份百药煎样品,按“2.1.3”项下方法制备供试品溶液,按照“2.1.1”项色谱条件进行测定,测定各个样品的峰面积,计算其没食子酸和鞣花酸的质量分数。
2.2 体外抗菌实验 2.2.1 样品溶液制备将正交试验的9份样品,粉碎过80目筛,分别称取25 g,用水100 mL煎煮2次,每次30 min。合并2次滤液,浓缩成质量浓度为0.25 g/mL的药液备用。
2.2.2 菌液的制备将金黄色葡萄球菌(菌落)制成菌液,浓度相当于0.5麦氏比浊度。
2.2.3 牛津杯法[19]先在无菌平皿内加入已熔化的M-H琼脂培养基20 mL,作为底层,待凝固后再加入已经制备好的菌液100 μL,用涂布棒涂布均匀,再将已经灭菌好的牛津杯(不锈钢,内径6 mm,外径7.8 mm,高10 mm)均匀放置培养皿中。每个平板中放置5个牛津杯,其中4个加入同种药液200 μL,其中1个加入相应的溶剂作阴性对照并做好标记。所有的培养皿直接放置于37℃恒温培养箱中培养24 h;观察菌落生产情况,用游标卡尺测量抑菌圈,计算平均值,进行对比研究。
2.3 正交试验 2.3.1 发酵温度和湿度的选择通过前期的预试验,考察了温度和湿度对百药煎制备的影响,温度设定为24、28、37 ℃,湿度设定为30%、50%、80%、90%。通过观察百药煎的外观性状如菌丝生长情况,确定了温度为28 ℃,湿度为80%。
2.3.2通过文献资料并结合预试验确定因素水平,选择酵曲种类(A)、茶叶种类(B)和物料比(原药量-菌种量-茶叶量,C)作为考察因素,以没食子酸、鞣花酸的质量分数、抑菌圈的大小为考察指标,各因素分别安排3个水平进行试验,选用L9(34)正交表安排试验,见表 1。
2.3.3 百药煎制备方法取净生五倍子粉末9份,每份约25 g,放于直径10 cm培养皿中,灭菌(120 ℃,30 min)。参照表 1分别加入各自的酵曲。取各种茶叶,均加入等量水煎煮15 min,放冷,取其茶汁15 mL,加到上述五倍子酵曲混合物中,不断搅拌,制成握至成团,松至即散的状态。放于恒温(28 ℃)恒湿(80%)的培养箱中培养72 h。取出,阴干,打粉,共制成9份样品。
2.3.4 加权法综合评价百药煎炮制工艺[20-23]采用综合加权评分法对其进行评价,百药煎中没食子酸质量分数最高,为主要有效成分;鞣花酸质量分数较低,为次主要有效成分;抑菌圈大小能直接反映百药煎的抗菌药理作用,对工艺选择的重要程度不同;故3个指标分别按0.6、0.1和0.3的权重系数计分,综合评分=没食子酸质量分数/没食子酸最大质量分数×0.6+鞣花酸质量分数/鞣花酸最大质量分数×0.1+抑菌圈直径/抑菌圈直径最大值×0.3,结果见表 1,方差分析见表 2。
|
|
表 2 方差分析 Table 2 Analysis of variance |
采用L9(34)正交表,以没食子酸、鞣花酸的质量分数和抗菌活性为评价指标,通过多指标综合加权评分法,考察3因素3水平,即发酵菌种类(根霉曲、安琪曲、黑曲霉)、茶叶种类(绿茶、红茶、普洱茶)、物料比(原药-菌种量-茶叶量分别为25:7.5:2.5、25:6.25:1.1、25:2.5:1.9)对百药煎炮制工艺的影响。由上述直观分析可知,影响因素的大小顺序为A>B>C,方差分析表明A因素对试验结果具有显著性影响(P<0.05)。取各因素较高水平的组合,得到最佳工艺条件为A1B2C1,即酵曲选用根霉曲,茶叶选用绿茶,物料比选择原药量-菌种量-茶叶量25:7.5:2.5。
2.3.5 验证试验称取25 g五倍子生品,共3份,采取所优选的百药煎的最佳炮制工艺条件进行炮制,没食子酸、鞣花酸的质量分数和抑菌圈直径及综合评分结果见表 3。可见其均值分别为0.57、0.10、0.29,综合评分均值为0.96,说明优选的最佳炮制工艺稳定可行。
|
|
表 3 验证试验结果 Table 3 Results of verification |
3 讨论 3.1 正交试验影响因素的选择
通过前期实验,发现如果温度过高影响发酵过程中酶的活性,温度过低不利于药材的发酵。湿度过低,酵曲的成长不理想,而湿度过大,则药材易霉变;因此确定温度28 ℃、湿度80%为最佳发酵条件。本实验在上述研究基础上,在恒湿恒温条件下,采用单一菌种考察了酵曲种类(安琪曲[15]、黑曲霉[24]、根霉曲[16]),茶叶种类(绿茶[25]、红茶、普洱茶[23]),物料比[1](25:7.5:2.5、25:6.25:1.1、25:2.5:1.9),以主要成分没食子酸及少量的鞣花酸质量分数、抑菌圈直径为指标,采用综合评分法,进行了正交试验优选,确定具有最佳抗菌活性的工艺参数,为进一步探讨百药煎炮制机制奠定基础。
3.2 体外抗菌实验相关条件选择百药煎常用于咽炎咽痛、久咳痰多、慢性肠炎,口疮、牙疳、血痢、暑热口渴等证[4]。金黄色葡萄球菌是人类化脓感染中最常见的病原菌,易引起肺炎、肠炎等。因此本实验采用金黄色葡萄球菌。通过预试验,确定药液质量浓度为0.25 g/L,药液质量浓度不能过大,过大抑菌圈之间容易黏连。药液加入量为200 μL最合适,药液过多或过少均影响实验的结果。菌液浓度统一相当0.5的麦氏比浊度的浓度,菌液加入量为100 μL。
3.3 结果分析通过没食子酸、鞣花酸的质量分数及不同工艺条件下发酵的百药煎的抑菌圈的大小,可以看出不同工艺对百药煎的化学成分及抗菌活性有一定的影响。表 2方差分析结果表明因素A发酵菌种对其有显著影响。通过抗菌的预试验,比较了百药煎与生品抑菌圈的大小,百药煎比生五倍子抑菌圈更大,结果具有显著性差异。该实验表明百药煎的抗菌效果比生五倍子更强。从五倍子的炮制角度进行抗菌效果的研究,这对进一步发掘抗菌的中草药有一定的参考价值[26]。本实验主要从化学成分没食子酸、鞣花酸和药效抗菌活性指标出发,使评价指标更加全面、客观,为百药煎炮制规范化生产及推广应用提供参考。
| [1] | 叶定江, 张世臣. 中药炮制学[M]. 北京: 人民卫生出版社, 1999 . |
| [2] | 谢志刚. 清咽丸含化为主治疗慢性咽炎疗效观察[J]. 陕西中医 , 2007, 8 (8) :954–955. |
| [3] | 郑利华. 中药结肠安胶囊治疗慢性结肠炎205例[J]. 中国中西医结合杂志 , 1998, 18 (6) :329. |
| [4] | 郑兰娟, 罗艳萍, 汪玉娇, 等. 五倍子抗菌抗炎作用研究进展[J]. 中国病原生物学杂志 , 2011, 6 (11) :868–869. |
| [5] | 张雅丽, 李建科, 刘柳, 等. 五倍子没食子酸研究进展[J]. 食品工业科技 , 2013, 34 (10) :386–390. |
| [6] | 王冬梅, 林森森, 郑司浩, 等. 五倍子抑制表皮生长因子受体活性及活性部位的UPLC/Q-TOF-MS分析[J]. 中草药 , 2013, 44 (18) :2515–2519. |
| [7] | 浙江省食品药品监督管理局.浙江省中药炮制规范[S]. 2006. |
| [8] | 北京市卫生局.北京市中药材标准[S]. 1998. |
| [9] | 江西省卫生厅药政管理局.江西省中药炮制规范[S]. 1991. |
| [10] | 冯守文. 京帮炮制拾遗2则[J]. 光明中医 , 2010, 25 (5) :883–884. |
| [11] | 张南方, 张义生. 武汉文帮百药煎炮制方法初探[J]. 湖北中药杂志 , 2014, 36 (10) :69–70. |
| [12] | 彭璐, 龚千锋, 李小宁, 等. 百药煎炮制历史沿革及现代研究[J]. 江西中医药大学学报 , 2016, 28 (2) :113–116. |
| [13] | 国家中医药管理局. 中华本草[M]. 上海: 上海科学技术出版社, 1999 . |
| [14] | 胡昌江, 瞿燕.五倍子发酵工艺及药理实验研究[D].成都:成都中医药大学, 2002. |
| [15] | 贾丹丹.六神曲和百药煎炮制过程中微生物分离、鉴定与特性分析[D].上海:中国医药工业研究总院, 2016. |
| [16] | 郑利华. 五倍子发酵炮制简介[J]. 中国中药杂志 , 1998, 23 (1) :26–27. |
| [17] | 王海宁, 李松. 正交试验优选紫百止嗽胶囊中紫菀的提取工艺[J]. 中草药 , 2014, 45 (14) :2027–2029. |
| [18] | 许甜甜, 聂松柳, 沈炳香, 等. 正交试验优选加压酒制山茱萸炮制工艺[J]. 中草药 , 2014, 45 (16) :2339–2343. |
| [19] | 李仪奎. 中药药理实验方法学[M]. 上海: 上海科学技术出版社, 2006 . |
| [20] | 王雪, 焦连庆, 于敏, 等. 多指标综合加权评分法优选五味子与丹参混合醇提工艺研究[J]. 中草药 , 2015, 46 (7) :998–1001. |
| [21] | 何雁, 马志庆. 医药数理统计[M].第3版. 北京: 科学出版社, 2009 . |
| [22] | 孙雄杰, 蒋濛, 涂济源, 等. 焦苍术炮制工艺研究[J]. 中草药 , 2015, 46 (4) :526–529. |
| [23] | 邵宛芳, CliffordM N, PowellC. 红茶及普洱茶主要成份差异的初步研究[J]. 云南农业大学学报 , 1995, 10 (4) :285–291. |
| [24] | 李秧针, 邱树毅, 保玉心, 等. 黑曲霉B0201利用五倍子固体发酵产单宁酶的条件研究[J]. 微生物学报 , 2009, 36 (8) :1123–1129. |
| [25] | 史莲莲, 邓德英, 张振凌, 等. 绿茶对五倍子发酵品的影响[J]. 中成药 , 2015, 37 (4) :836–839. |
| [26] | 路甬祥. 中国传统工艺全集:中药炮制[M]. 郑州: 大象出版社, 2004 . |
 2016, Vol. 47
2016, Vol. 47

