金银花Lonicerae Flos具清热解毒、凉散风热、广谱抗菌及抗病毒等功效,临床上多用于治疗湿病发热、风热感冒、咽喉肿痛、肺炎、蜂窝状组织炎、痢疾等多种疾病,有“中药之中的青霉素”之称。《中国药典》历版都对金银花的基原和有效成分的量作了规定。《中国药典》2015年版规定,金银花本品为忍冬科植物忍冬Lonicera japonica Thunb.,还规定了绿原酸量和木犀草苷量为衡量金银花质量好坏的重要指标。其中HQT(hydroxycinnamoyl CoA quinate hydroxycinnamoyl transferase)基因是与绿原酸合成直接相关的基因。关于HQT基因在国际上已有烟草、番茄等植物的HQT基因调控绿原酸合成的研究报道。但在中药材方面,除了本课题组对金银花HQT基因调控绿原酸生物合成的相关研究外,尚未见其他报道。因此,本研究中金银花HQT基因调控其在真核生物细胞中的机制,可为建立金银花可控质量标准及金银花科学选育提供理论依据;为其他中药材功能基因的研究提供研究方法和思路。在提高中药材优良品种的选育、资源开发以及科学规范中药材质量控制等方面都具有一定的理论和实践意义。
1 材料 1.1 植物及农杆菌材料金银花嫩叶以及种子(九绿一号)均来自山东平邑九间棚农业科技园有限公司,根癌农杆菌LBA4404菌株由北京林业大学赠送。
1.2 双元表达载体过表达载体pJCV51以及沉默表达载体pFAST-G03,购于比利时根特大学Gateway Cloning实验室;感受态细胞DH5α,购于Invitrogen公司。
1.3 试剂RNeasy Plus Mini Kit(Qiagen-Sample & Assay Technologies),pENTR Directional TOPO Cloning Kits(Invitrogen),Gateway LR ClonaseⅡ Enzyme Mix(Invitrogen),One Shot® OmniMAXTM2 T1 Phage-Resistant Cells(Invitrogen),DNA纯化试剂盒(Invitrogen),TransStart FastPfu DNA Polymerase(北京全式金生物技术有限公司),PrimeScriptTM RT-PCR Kit(TaKaRa),绿原酸对照品(批号 20110309)购于中国食品药品检定研究院,质量分数大于98%。
2 方法 2.1 金银花HQT真核表达系统的构建 2.1.1 HQT基因获得采用Qiagen-Sample的RNeasy Plus Kit试剂盒提取总RNA,使用SuperScript® VILOTM cDNA Synthesis Kit反转录试剂盒,将检测合格的RNA反转录成cDNA,反应体系如下:总RNA 2.5 μg,10×SuperScript® Enzyme Mix 2 μL,5X VILO® Reaction Mix 4 μL,DEPC-treated water 加至20 μL,反应条件:25 ℃保温10 min;42 ℃保温60 min;85 ℃保温5 min;4 ℃冷却即得cDNA溶液。
本课题组前期已经获得HQT基因全长cDNA序列(GQ847546),故用Primer Primer 5.0软件对序列进行处理,设计上游引物HQT-F:5’-CTATGGGAAGTGAAGGAAGTGTGAA-3’,下游引物HQT-R:5’-TCAGAACTCGTACAAACACT-TCTCAAA-3’。采用TransStart FastPfu DNA Polymerase试剂盒进行PCR反应扩增出HQT基因全长cDNA编码序列。
PCR扩增体系:cDNA 3 μL,TransStart FastPfu DNA Polymerase(2.5 U/μL)1 μL,5×TransStart FastPfu Buffer 10 μL,dNTP(2.5 mmol/L each)8 μL,HQT-F(10 μm)2 μL,HQT-R(10 μmol/L)2 μL,无菌水加至50 μL,反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35 个循环;72 ℃延伸10 min,4 ℃放置。
将扩增得到的目的PCR产物直接送样,测序由北京博迈德生物工程有限公司完成。测序结果用MEGA 5.0软件进行分析,同时利用NCBI的Blast工具,在线比较和金银花HQT基因的相似度。
2.1.2 通路克隆系统(Gateway Cloning System)[1-2]构建金银花HQT基因真核表达载体利用pENTR Directional TOPO Cloning Kits进行TOPO反应获得入门载体,以及将入门载体和目的载体通过Gateway LR ClonaseⅡ Enzyme Mix 进行LR反应获得过表达载体以及沉默表达载体,其中目的载体pJCV51(过表达载体)、pFast-G03(沉默载体)购自比利时根特大学Gateway Cloning实验室。分别提取pJCV51-HQT以及pFast-G03-HQT重组质粒送至北京博迈德生物工程有限公司进行测序工作。
2.2 金银花HQT基因工程菌的构建首先制备根癌农杆菌LBA4404感受态细胞[3],将上述重组质粒转化农杆菌[4],采用博迈德质粒中量提取试剂盒提取工程菌质粒,再通过PCR扩增实验,鉴定阳性克隆。并将菌液送样进行测序,测序工作交由北京博迈德生物技术有限公司,同时留600 μL菌液加入甘油至终质量分数为15%,于-80 ℃冰箱内,长期保存。
2.3 金银花外植体的遗传转化利用金银花的嫩叶(金银花的种子萌发至子叶展开时,为后续实验备用)作为植物遗传转化的外植体。为了提高农杆菌转化外植体的效率,上述备制好的工程菌须在进行遗传转化前,需制备农杆菌侵染液,将外植体放入新鲜制备的农杆菌侵染液中,侵染5~10 min(侵染时间视叶盘老嫩程度而定,避免过长时间侵染导致外植体死亡)后,倾去菌液,用无菌吸水纸将菌液吸干,之后将侵染的叶盘转移到金银花嫩叶诱导愈伤组织培养基,外植体和农杆菌共培养3 d后,洗除农杆菌,进行抗性愈伤的筛选培养,由于2个不同的表达载体本身具备的抗性不同,故培养基所加抗生素不同[5]。过表达载体pJCV51-HQT:MS+0.1 mg/L 6-BA+1 mg/L NAA+25 g/L蔗糖+7 g/L琼脂+50 mg/L Kana+300 mg/L Car+25 g/L蔗糖+7 g/L琼脂;沉默表达载体pFAST-G03-HQT:MS+0.1 mg/L 6-BA+1 mg/L NAA+25 g/L蔗糖+7 g/L琼脂+50 mg/L Hyg+300 mg/L Car+25 g/L蔗糖+7 g/L琼脂。筛选培养一段时间,外植体的转化细胞将产生抗性愈伤组织,将其转入相应的选择培养基中进行扩繁培养,直至形成松软的愈伤组织块,用于分化培养或液体悬浮培养。
2.4 利用HPLC与半定量RT-PCR进行检测分析 2.4.1 HPLC测定转基因金银花愈伤组织中绿原酸精密称量绿原酸对照品2.3 mg于10 mL量瓶中,加入50%甲醇配成0.23 mg/mL的对照品溶液,使用0.45 μm微孔滤膜进行滤过,即得。将配好的对照品溶液分别进样0.5、2、4、8、10、12 μL,记录峰面积,绘制标准曲线。
称取样品0.5 g,置于三角瓶内,加50%甲醇50 mL,称质量,进行超声处理30 min,放凉后称定质量,50%甲醇补充差质量,使用0.45 μm微孔滤膜进行滤过,即得。分别吸取不同类型样品液各10 μL进样,进行绿原酸的测定。每个样品重复3次,结果取平均值。
2.4.2 半定量RT-PCR测定转基因金银花愈伤组织中HQT基因的相对表达量分别提取转基因(过表达、沉默表达)以及对照组(野生型)金银花愈伤组织的RNA并通过反转录得到cDNA;设计特定引物(Actin-S:5’-TTTGCYGGWGATGATGCTCC-3’;Actin-A:5’-TCCATRTCATCCCAGTTGCT-3’;HQT-RT-F:5’-ACCACCCTCAAGGCGAAAG-3’;HQT-RT-R:5’-CAAAATCCGCATCGTGAACT-3’)进行RT-PCR半定量分析。
PCR反应体系如下(同批异管扩增):cDNA 1 μL,RT-PCR 10 μL,Actin-S或 HQT-RT-F(10 μmol/L)1 μL,Actin-A或HQT-RT-R(10 μmol/L)1 μL,ddH2O加至20 μL。PCR反应条件为94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,β-actin进行30个循环,HQT进行32个循环;4 ℃放置。琼脂糖凝胶电泳实验对PCR扩增进行分析。
在凝胶成像系统下拍照并定量分析电泳条带的吸光度值。目的基因相对表达量为其电泳条带的吸光度值与内参基因的电泳条带的吸光度值的比值。每个样品重复3次半定量RT-PCR实验,并对数据进行方差统计分析。
3 结果 3.1 金银花HQT基因真核表达载体的鉴定 3.1.1 鉴定pJCV51-HQT利用特异引物M13-F和M13-R对入门载体(pJCV51-HQT)进行PCR鉴定,并测序。将两段测序结果拼接并与GeneBank中金银花HQT基因序列进行比对,结果表明在入门载体中导入的基因与GeneBank中所显示的金银花HQT基因序列完全一致,由此证明实验成功获得了HQT基因入门载体。
3.1.2 pFAST-G03重组克隆的检测选用单酶切方法来验证(图 1)。

|
1-pFAST-G03重组克隆 M-Marker 1-pFAST-G03 recombinant clone M-Marker 图 1 沉默载体BstBI酶切电泳图 Fig.1 Electrophoresis of enzyme digestion of silence vector BstBI |
3.2 工程菌重组质粒的PCR鉴定阳性克隆结果
挑取单克隆进行菌进行PCR鉴定,如图 2所示,结果表明工程菌中的基因片段与GeneBank中所显示的金银花HQT基因序列完全一致。

|
1-过表达重组质粒 2-沉默表达重组质粒 M-Marker 1-overexpression recombinant plasmids 2-silence expression recombinant plasmids M-Marker 图 2 重组质粒PCR鉴定阳性克隆电泳图 Fig.2 Electrophoresis of PCR-positive clones of recombinant plasmid |
3.3 遗传转化结果
利用金银花种子获得无菌苗,为遗传转化提供外植体。工程菌转化外植体,共培养3 d后,将外植体转移至筛选培养基中,2周后再转移至继代培养基中,最后得到金银花抗性愈伤组织。
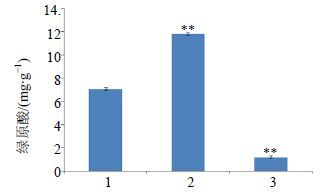
3.4 HPLC与半定量RT-PCR检测结果及其关系利用HPLC重复3次测定不同类型转基因金银花愈伤组织中绿原酸的量,如图 3所示,其中,过表达型的金银花愈伤组织中的绿原酸量最高,达到11.782 mg/g,野生型的次之,为7.041 mg/g,沉默表达型的最低,为1.180 mg/g。
|
与“野生型”相比: **P<0.01 1-野生型 2-过表达型 3-沉默表达型,下同 **P < 0.01 vs wild, 1, 2, 3 was wild, overpressed and silence type respectively, same as below 图 3 转基因金银花愈伤组织中绿原酸的量 Fig.3 Content of chlorogenic acid intransgenic honeysuckle callus |
利用半定量RT-PCR检测HQT基因的相对表达量,实验重复3次。如图 4及图 5所示,可看出HQT在过表达型转基因愈伤组织中的相对表达量最高,野生型居中,沉默表达型中HQT的相对表达量最低。

|
图 4 不同类型转基因金银花愈伤组织中HQT基因相对表达量 Fig.4 HQT gene of relative expression in different transgenic callus of Lonicerae Flos |

|
β-actin为内参 β-actin was reference gene 图 5 不同类型转基因愈伤组织中HQT半定量RT-PCR电泳图 Fig.5 Semi-quantitive RT-PCR electropherogram of HQT in various GM callus |
对HQT相对表达量和愈伤组织中的绿原酸量进行相关性分析,结果表明,金银花愈伤组织中HQT基因的表达量和次生代谢产物中绿原酸量呈正比关系,R2=0.997 5,线性方程为Y=15.208 X-7.256 4,即随着金银花愈伤组织中HQT基因表达量增高,其次生代谢产物绿原酸的量也升高;反之亦然。
4 讨论 4.1 通路克隆系统构建表达载体的影响作为一种新的DNA重组方法,在金银花HQT基因真核表达系统的构建的过程中,导入的目的基因的方向不会发生改变,外源基因的阅读框也总是保持不变的[6-7]。通路克隆系统中重组位点的高度专一性保证了DNA片段转化后,假阳性克隆很低,从而产生了高比率的表达克隆系统。通路克隆系统的最大特点就是可以进行与宿主系统完全无关的克隆或亚克隆,入门载体中的外源基因亚克隆到不同的目的载体中,会形成各种不同的表达载体,满足研究者的需求。
4.2 植物外植体转化效率的影响因素外植体的转化是本研究的关键步骤,而影响金银花外植体转化效率的因素是多方面的:无菌苗的生成、工程菌的浓度、抗生素与激素的使用量等。
充足的无菌苗子为后续转化实验提供了足够的外植体来源,金银花种子瘪小不饱满,自然发芽率极低,通过对种子的沙藏处理以及春化处理,明显改善了种子的萌发率,但是种子萌发不齐的特征,又为实验的顺利进展带来阻碍。在第3期实验中,选用了山东九间棚种植园里的金银花枝条,扦插在水里生根发芽,选其嫩叶作为实验的外植体。
合适的工程菌浓度保障外植体的转化效率,菌液浓度过高,多余的农杆菌不易去除,增加实验难度,影响外植体的生长[8]。菌液浓度过低,农杆菌活力不足,不利于其侵染外植体,难以附着于外植体的切口处,直接导致转化效率低下。
此外,外植体侵染时间、组培条件、愈伤组织继代周期以及实验操作规范性均对金银花外植体的转化效率造成不同程度的影响,影响后续转基因金银花外植体的筛选。
4.3 HQT基因调控绿原酸的生物合成关于HQT基因调控绿原酸生物合成的研究方面,本课题组已在原核生物表达及其调控进行了研究,通过构建金银花HQT基因原核表达载体pET30a-HQT,分离纯化了金银花重组HQT蛋白,并测定了金银花重组HQT蛋白的催化活性和特性,初步证明了金银花HQT对相应的底物具有较高的亲和力,预示着HQT基因在金银花绿原酸合成途径中的重要作用[9]。
本研究通过HQT基因转染真核植物金银花愈伤组织,用半定量RT-PCR以及HPLC的方法分别对HQT基因的相对表达量以及绿原酸的量进行检测。根据实验结果,过表达型的愈伤组织中的绿原酸量最高,为11.782 mg/g,野生型居中,沉默表达型的很低,只有1.180 mg/g;过表达型的HQT基因相对表达量也是最高,野生型居中,沉默表达型最低。结果表明,HQT基因的表达直接影响着绿原酸的生物合成,HQT的基因表达量与绿原酸的生物合成具有线性关系,HQT基因的表达对绿原酸合成具有正调控作用,填补了金银花HQT基因在真核生物细胞中表达调控的研究空白,也为金银花优良品种的选育等研究方面提供了理论支持。
| [1] | 汪宗桂, 郑文岭, 马文丽. 通路克隆系统:DNA重组技术的新进展[J]. 中国生物工程杂志 , 2003, 23 (7) :24–27. |
| [2] | Landy A. Dynamic, structural, and regulatory aspects of sit especific recombinant ion[J]. Ann Rev Biochem , 1989, 58 :913–949. DOI:10.1146/annurev.bi.58.070189.004405 |
| [3] | 熊江霞, 陈厚早, 朱华庆, 等. 感受态细胞的制备[J]. 安徽医科大学学报 , 2003, 38 (3) :244–246. |
| [4] | 余云舟, 杜娟, 王罡. 重组质粒导入根癌农杆菌冻融法的研究[J]. 吉林农业大学学报 , 2003, 25 (3) :257–262. |
| [5] | 上官新晨, 郭春兰, 蒋艳, 等. 培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究[J]. 江西农业大学学报 , 2006, 28 (5) :682–683. |
| [6] | Cheo D L, Titus S A, Byrd D R N, et al. Concerted assembly and cloning of multiple DNA segments using in vitro sitespecific recombination:functional analysis of multisegment expression clones[J]. Genome Res , 2004, 14 (10B) :2111–2120. DOI:10.1101/gr.2512204 |
| [7] | Sasaki Y, Sone T, Yoshida S, et al. Evidence for high specificity and efficiency of multiple recombination signals in mixed DNA cloning by the Multisite Gateway system[J]. J Biotechnol , 2004, 107 (3) :233–243. DOI:10.1016/j.jbiotec.2003.10.001 |
| [8] | 席培宇. 甘草HMGR、SQS1和β-AS基因CNVs体系的构建[D]. 北京:北京中医药大学, 2013. |
| [9] | Peng X X, Li W D, Wang W Q, et al. Cloning and characterization of a cDNA coding a hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase involved in chlorogenic acid biosynthesis in Lonicera japonica[J]. Planta Med , 2010, 76 (10) :1921–1926. |
 2016, Vol. 47
2016, Vol. 47


