2. 福建省立医院 耳鼻咽喉科, 福建 福州 350001 ;
3. 福建出入境检验检疫局技术中心, 福建 福州 350003
2. Department of Otolargngology, Fujian Provincial Hospital, Fuzhou 350001, China ;
3. Inspection and Quarantine Technique Centre of Fujian Entry-exit Inspection and Quarantine Bureau, Fuzhou 350003, China
雷公藤Tripterygium wilfordii Hook. f. 为卫矛科(Celastraceae)雷公藤属Tripterygium Hook. f. 植物,化学成分主要有二萜、三萜、倍半萜、生物碱和苷类等[1],毒性大小依次为二萜类、生物碱、三萜类及苷类。雷公藤内酯醇(雷公藤甲素,triptolide,TP)是含有3个环氧基的二萜内酯化合物,具有抗生育、抗肿瘤作用、免疫抑制作用、减轻移植排斥反应等多种生物活性[2]。但TP安全系数小,易对肝脏、肾脏、免疫系统、骨髓及血液系统、胃肠道、心脏、神经、遗传、生殖系统等多种器官产生毒性作用[3-4]。TP 1.11、2.22、4.44 mmol/L对兔完整皮肤及破损皮肤均引起明显的红斑及水肿反应,病理组织学检查表明,表皮真皮呈明显的炎症[5]。
纳米脂质体(NLS)是一种在常规脂质体的基础上结合纳米技术发展起来的新型载药系统。孙聚魁等[6]认为NLS是指粒径小于100 nm的脂质体结构,在稳定性、吸收和体内分布等方面具有纳米粒子的特殊效应,可以携载亲水性、疏水性及两亲性药物,直接输送至靶组织发挥药效作用。将TP制备成NLS,改变TP的溶解性,增大TP的吸收,后续研发成外用涂膜剂,使TP易于经皮渗透,并绕过肝脏的首关效应直达病灶,收获减毒增效的功效。
涂膜剂是成膜材料和药物均溶解于有机溶剂而制成的外用胶体溶液剂,使用时涂于患处,待有机溶剂挥发后形成一层薄膜。此剂型中成膜材料起到了滞留和保护药物缓慢发挥疗效的作用[7]。另外,此剂型使用后迅速形成薄膜保护创面或者是伤口,有效地减少传统敷料或绷带使用及拆除过程带来的痛苦[7]。本实验应用薄膜分散-高压均质法制备TP- NLS,均匀设计优选聚乙烯醇124(PVA124)、单硬脂酸甘油酯、甘油等基质材料,制备外用型TP- NLS涂膜剂。
1 仪器与材料GJJ型超高压均质泵,上海诺尼轻工机械有限公司;LC-20A型岛津半制备高效液相色谱仪,日本岛津公司;H01-3型恒温磁力搅拌仪,上海梅颖浦仪表制造有限公司;SK3310HP型超声波清洗器,上海科导超声仪器有限公司;HH-2型数显恒温水浴锅,金坛市江南仪器厂;AL204型电子分析天平,梅特勒-托利多仪器(上海)有限公司;ABZ1-0501-P型艾科浦超纯水系统,颐洋企业发展有限公司。
TP对照品,批号111597-200502,质量分数按100%计,购自中国食品药品检定研究院;TP,质量分数≥99.7%,批号20150325,由福建省医学科学研究院药物所提供;PVA124,上海天莲精细化工有限公司,批号1109111;甘油,国药集团化学试剂有限公司,批号F20091117b;单硬脂酸甘油酯,分析纯,国药集团化学试剂有限公司,批号F20111207;卡波姆,批号120830,上海青析化工科技有限公司;CMC-Na,批号080701,上海青析化工科技有限公司;无水乙醇,分析纯,西陇化工股份有限公司,批号1402802;甲醇,分析纯,西陇化工股份有限公司,批号1109111;乙腈,色谱纯,Merck KGaA,批号201307;甲醇,色谱纯,Merck KGaA,批号200909;超纯水(新配)。
2 方法与结果 2.1 TP-NLS涂膜剂的制备参考文献方法[8]制备600 mL的TP-NLS溶液,粒径为117 nm,Zeta电位32 mV,包封率84%,TP质量浓度100 µg/mL,4 ℃避光保存,备用。
称取处方量的PVA124,加入适量50%乙醇溶液,摇匀,静置过夜,热水浴上加热溶胀成凝胶状溶液[7],备用;另称取处方量的卡波姆与CMC-Na混合均匀,精密加入15 mL TP-NLS溶液(TP质量浓度为100 μg/mL)浸泡,搅拌,充分溶胀后,缓慢加入PVA124溶液中,搅拌均匀,制得A相。
将处方量的单硬脂酸甘油酯置于80~100 ℃水浴中熔融,缓慢加入处方量甘油搅拌均匀,制得B相;缓慢将A相加入B相中,在常温下,用磁力搅拌器(转速1 000 r/min)搅拌适当时间,无水乙醇定量为30 g,制得TP-NLS涂膜剂,涂膜剂的载药量为50 μg/g。
2.2 单因素考察影响TP-NLS涂膜剂制备的因素涂膜剂中成膜材料主要分为高分子聚合物和合成高分子聚合物2大类[7],其中合成的高分子成膜材料,具有成膜性良好,成膜后的强度和韧性能满足膜剂成型与应用要求,且吸湿性和水溶性都较好。目前国内常用的品种有:聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP)、羧甲基纤维素钠(CMC-Na)等。结合TP-NLS溶液在中性环境中性质稳定及前期的预试验基础,选择成膜材料PVA124、非离子表面活性剂单硬脂酸甘油酯、保湿剂甘油为TP-NLS涂膜剂的基质材料,进行单因素考察。其余基质参照文献报道固定卡波姆的用量为0.2%[9],CMC-Na的用量为3%[10]。
2.2.1 PVA124用量的影响参考文献报道[7]实例,分别称取3.0、3.5、4.0 g PVA124于烧杯中,加入适量超纯水,制备PVA124溶液10 mL,固定其余基质的用量,按“2.1”项操作制备3份30 g的TP-NLS涂膜剂,比较发现PVA124的用量对制剂的成膜性产生影响,用量为3.0 g时,制备的涂膜剂涂抹后成膜性较差;用量为3.5 g,成膜性好,但外观均匀度不够;用量为4.0 g时,涂膜剂成膜后较难剥离,外观均匀度好。综上,设定PVA124的用量在3.5 g左右选择均匀实验水平。
2.2.2 单硬脂酸甘油酯用量的影响选择单硬脂酸甘油酯为稳定剂、抗黏剂,以其用量为考察因素,固定其余基质的用量,设定单硬脂酸甘油酯为1.0、1.5、2.0 g进行单因素实验,按“2.1”项操作,配制3份30 g TP-NLS涂膜剂。根据文献方法[11]观察所得制剂的成膜性,成膜时间和均匀性,发现单硬脂酸甘油酯的用量为1.0、1.5 g制备的2份涂膜剂成膜性好,成膜时间短,用量为2.0 g时,制成的涂膜剂成膜后较脆,易碎。因此,单硬脂酸甘油酯的用量设定在1.5 g附近选择7个水平进行考察。
2.2.3 甘油用量的影响在TP-NLS涂膜剂中加入甘油,起增塑、保湿的作用。预试验固定其余基质的用量,变化甘油的用量为0、1.0、2.0 g,按“2.1”项操作,制备3份30 g的TP-NLS涂膜剂,发现甘油用量为0时,制剂成膜后,不易成片剥离;用量为2.0 g时,制剂涂抹后,成膜时间过长。因此,实验将甘油的用量设定在2.0 g以下。
2.2.4 搅拌时间的考察涂膜剂由多种基质充分溶解或溶胀后按适当的比例配制,通过磁力搅拌器搅拌,在搅拌频率固定的情况下,搅拌时间越长,涂膜剂越均匀,但溶剂挥发增多,影响涂膜剂的涂抹。因此,固定各基质用量不变,配制3份30 g TP-NLS涂膜剂,分别搅拌60、120、180 min,考察制剂的外观,发现搅拌60 min时,制备的涂膜剂颗粒较大,成膜不均匀;搅拌120 min时,涂膜剂外观较好;搅拌180 min,涂膜剂变稠,涂抹困难。因此,搅拌时间设计为120 min左右,并细化7个水平。
2.3 均匀试验设计优选TP-NLS涂膜剂的制备处方及工艺 2.3.1 均匀试验设计[12]在单因素考察的基础上,以单硬脂酸甘油酯用量(A)、甘油的用量(B)、PVA124的用量(C)、搅拌时间(D)为考察因素,每个因素在单因素试验的基础上调整,细化为7个水平,进行均匀设计,参考文献报道[11]以均匀性、成膜性、成膜时间为考察指标,采用U7(74)均匀试验优化制备工艺。试验设计的因素、水平及实验结果见表 1。
2.3.2 考察指标的评判TP副作用大,用量少,在制剂中的均匀度显得尤为重要。本实验以HPLC法测定TP量,计算RSD值,作为评价TP-NLS涂膜剂均匀性的考察指标。另取1 g涂膜剂均匀涂抹于(37.0±0.2)℃的玻璃板上,涂抹面积3 cm×3 cm,考察成膜性与成膜时间,建立评价指标。均匀性、成膜性及成膜时间3个指标最低分设定为60分。
|
|
表 1 U7(74)均匀试验设计及结果 Table 1 Design and results of U7(74) uniform test |
均匀性通过RSD值的大小进行评价,RSD值小于0.5%(包括0.5%),表明涂膜剂中TP量分布均匀,膜材均匀性好,评为90~100分;RSD值在0.5%~1.0%(包括1.0%),膜材均匀性较好,评为70~89分;RSD值在1.0%~1.5%(包括1.5%),表示膜材均匀性一般,评为70~79分;RSD值大于1.5%,则均匀性很差,评为60~69分。均匀性评价结果见表 2。
|
|
表 2 均匀性考察结果 Table 2 Investigation of uniformity |
取涂膜剂1 g均匀涂抹于(37.0±0.2)℃的玻璃板上,成膜后从玻璃板剥离,无细屑残留,确定为成膜性好,评90~100分;若成膜后剥离,有少量残留,成膜性一般,评80~89分;若涂膜剂在干燥后不容易剥离,剥离后残留较多,则成膜性较差,评70~79分;若涂膜剂在干燥后剥离困难,剥离物成细条状,则成膜性差,评为60~69分。
取1 g涂膜剂均匀涂抹于(37.0±0.2)℃的玻璃板,以涂膜剂完全干燥为准,记录成膜时间,成膜时间小于5 min(包括5 min),成膜时间短,评90~100分;成膜时间在5~10 min(包括10 min),评为80~89分;干燥时间在10~15 min(包括15 min),成膜时间较长,评70~79分;干燥时间大于15 min,成膜时间很长,评60~69分。
均匀性、成膜性、成膜时间3个考察指标对TP-NLS涂膜剂的性状均具有重要的意义,取相同的权重系数,综合评分,计算总分(表 1),按得分高低判定制备工艺优劣。
2.3.3 均匀性考察运用HPLC法测定TP-NLS涂膜剂中TP的载药量,计算RSD值,用以评价TP-NLS涂膜剂的均匀性。
(1)色谱条件[13]:色谱柱为Diamonsil C18分析柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(30∶70);体积流量1.0 mL/min;测定波长218 nm;柱温20 ℃。色谱图如图 1所示。
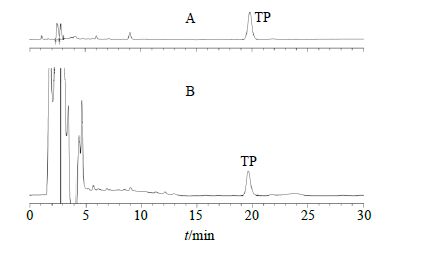
|
图 1 TP对照品 (A) 和TP-NLS涂膜剂 (B) 的HPLC图 Fig.1 HPLC of TP reference substance (A) and TP-NLS coating agent (B) |
(2)对照品溶液的配制及线性关系考察:精密称取TP对照品适量,加入流动相配成50 µg/mL的对照品溶液10 mL,精密量取TP对照品溶液0、0.5、1.0、1.5、2.0、3.0 mL于10 mL量瓶中,30%乙腈溶液定容,配制系列质量浓度为0、2.5、5.0、7.5、10、15 µg/mL的TP对照品溶液,微孔滤膜滤过,按上述HPLC色谱条件进样测定,以峰面积积分值为纵坐标(Y),TP的质量浓度为横坐标(X),得线性回归方程为Y=47 995 X+1 137,r=0.999 5,表明TP在0~15 µg/mL线性关系良好。
(3)样品溶液的配制:精密称取制备的TP-NLS涂膜剂约1 g,加入2.8 mL超纯水,混匀,加入1.0 mL甲醇,超声破乳40 min,溶液用甲醇定容为5 mL,0.45 μm微孔滤膜滤过,即得供试品溶液。每一实验号制备的涂膜剂平行操作5份,备用。
(4)定量测定:按上述色谱条件,测定峰面积,计算每份样品中TP量的RSD,以RSD值作为TP- NLS涂膜剂均匀性的评价指标,进行均匀性评分。结果见表 2。
2.3.4 均匀实验方案与结果采用U7(74)均匀设计表,以单硬脂酸甘油酯用量(A)、甘油的用量(B)、PVA124的用量(C)、搅拌时间(D)为考察因素,选择均匀设计表U7(74)安排实验,如表 1所示。
应用Excell 2003(完整版)对以上实验数据进行处理得到4元线性方程为y=352.45 x1+1 118.51 x2-0.240 1 x3-37.338 x4+1 288.00,y为因变量(综合评分),x1、x2、x3、x4为自变量(即A、B、C、D 4个因素)。
2.3.5 方差分析及因素主次确定由表 3可以看出F1>F0.01(1,2)>F2>F4>F3;F>F0.01(4,2),则Y与x1、x2、x3、x4间有十分显著的的线性关系,所建立的线性回归方程与实验数据拟合得很好。第1个因素对实验结果有非常显著的影响(P<0.01),另3个因素影响较小,4个因素对实验结果的影响主次关系为x1>x2>x4>x3,即单硬脂酸甘油酯的用量>PVA124的用量>搅拌时间>甘油的用量。
|
|
表 3 回归方差分析表 Table 3 Analysis of regression variance |
2.4 最优工艺的确定与验证试验
根据均匀设计的实验结果可知,单硬脂酸甘油酯的用量对涂膜剂的影响最大,其次是PVA124的用量和搅拌时间,而甘油的影响最小,但是甘油为增塑剂、保湿剂,使膜剂柔韧性增强,并具有一定的抗拉强度,所以保留甘油的使用,最佳制备工艺为A7B1C7D7,即制备30 g TP-NLS涂膜剂,单硬脂酸甘油酯的用量为1.6 g、PVA124用量为3.9 g、甘油用量为0.25 g,搅拌150 min,对其进行验证如下。
称取最佳处方的各个基质用量,即称取PVA124 3.9 g,加入50%乙醇溶液10 mL,摇匀,静置过夜,温水浴上加热溶胀成凝胶状,备用;另称取卡波姆0.6 g与CMC-Na 0.9 g混合均匀,加入15 mL TP- NLS溶液(TP质量浓度为100 μg/mL)浸泡,搅拌,充分溶胀后,缓慢加入PVA124凝胶中,搅拌均匀,制得A相,备用。
将1.6 g单硬脂酸甘油酯置于80~100 ℃水浴中熔融,缓慢加入0.25 g甘油,搅拌均匀,制得B相;将A相缓慢加入B相中,磁力搅拌器(转速为1 000 r/min)常温搅拌150 min,用无水乙醇定量为30 g,制得TP-NLS涂膜剂,涂膜剂中TP的载药量为50 μg/g。平行操作3份,对其均匀性、成膜性、成膜时间进行考察,综合评分平均值分别为278、283、289分,所得涂膜剂的性状优于均匀试验方案制备的涂膜剂。故确定制备30 g TP-NLS涂膜剂,单硬脂酸甘油酯的用量为1.6 g,甘油0.25 g,PVA124的用量为3.9 g,卡波姆为0.6 g,CMC-Na 0.9 g,搅拌150 min为制备TP-NLS涂膜剂的最佳工艺。
2.5 TP-NLS涂膜剂和TP涂膜剂的制备 2.5.1 TP-NLS涂膜剂的制备按“2.4”项下验证试验操作,制备载药量50 μg/g的TP-NLS涂膜剂30 g,避光冷藏,备用。
2.5.2 TP涂膜剂的制备精密称取TP单体15.0 mg于10 mL量瓶中,用无水乙醇超声溶解,定容,制备1.5 mg/mL的TP溶液。精密量取1 mL上述TP溶液于烧杯中,加入适量乙醇和超纯水,配制乙醇体积分数为50%的TP溶液10 mL,取PVA124 3.9 g加入,摇匀,静置过夜,温水浴加热溶胀成凝胶状,备用。另称取卡波姆0.6 g与CMC-Na 0.9 g混合均匀,加入15 mL超纯水浸泡,搅拌,充分溶胀后,缓慢加入已溶胀的PVA124凝胶中,搅拌均匀,制得A相,备用。
将1.6 g单硬脂酸甘油酯置于80~100 ℃水浴中熔融,缓慢加入0.25 g甘油,搅拌均匀,制得B相;将A相缓慢加入B相中,磁力搅拌器(转速为1 000 r/min)常温搅拌150 min,无水乙醇定量为30 g,制得TP涂膜剂,涂膜剂中TP的载药量为50 μg/g。避光冷藏,备用。
2.6 体外透皮实验采用文献方法[14]制备12张完整小鼠腹部皮肤,固定在立式改良Franz扩散池上,真皮层面向接收池,角质层面向供给池,分别精密称取1 g的TP- NLS涂膜剂和TP涂膜剂(TP载药量均为50 µg/g)均匀涂抹于角质层面上,固定供给池和接收池,加入接收液,排除气泡,进行体外透皮实验。在0.5、1.0、2.0、4.0、8.0、24.0 h分别从接收池中吸取2 mL接收液,并及时补充2 mL新鲜接收液。取出的溶液蒸干,残渣用甲醇溶解,完全转移至2 mL量瓶中,定容,HPLC测定峰面积,按下列公式计算单位面积24 h累积渗透量(Q,µg/cm2)。
| $Q=(V{{C}_{n}}+{{V}_{0}}\sum\limits_{i=1}^{n-1}{{{C}_{i}})/A}$ |
Cn为第n个取样点测得的药物质量浓度,Ci为第i个取样点测得的药物质量浓度;A为有效接触面积(cm2),V为接收池体积(mL),V0为取样体积(mL)
以Q为纵坐标,时间t为横坐标,绘制曲线,如图 2。将渗透曲线头部直线部分的Q-t数据进行线性回归,TP-NLS涂膜剂回归方程为Y=0.046 8 X+0.545 9,求得TP-NLS涂膜剂的稳态渗透速率(Js)为46.8 ng/(cm2·h),24 h Q(Q24 h)为11.53 µg/cm2,累积透过率为67.36%。TP涂膜剂回归方 程为Y=0.031 1 X+0.253 1,Js为31.1 ng/(cm2·h),Q24 h为7.01 µg/cm2,累积透过率为40.95%。结果表明,2种不同载体的涂膜剂体外经皮渗透吸收有较大的区别,TP-NLS涂膜剂的Js及Q24 h明显高于TP涂膜剂。
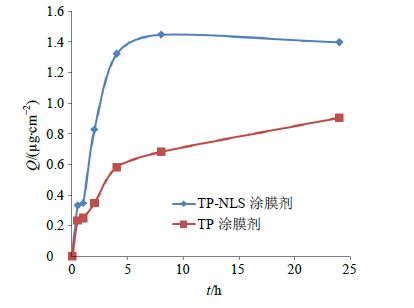
|
图 2 TP-NLS涂膜剂和TP涂膜剂透皮吸收曲线 Fig.2 Curve of percutaneous penetration of TP-NLS and TP coating agents |
3 讨论
均匀设计是由我国数学家方开泰和王元将数论跟多元统计相结合,在正交设计的基础上,重新创立出来的新的可以适用于多因素、多水平试验的一种设计方法[13]。该设计方法可以在实验次数较少的情况下,获得各因素和考察变量之间的定量关系,具有其他实验设计方法难以比拟的优点。TP-NLS涂膜剂的制备工艺拟考察4个因素7个水平,试验涉及到基质的用量,制备的时间等,试验范围大而复杂,应用均匀设计,有效地减少了试验次数,科学解决问题。
TP生物活性强,使用微量的药物就可收获相应的药效,但毒性剂量与有效剂量比较接近,因此在制剂中的均匀性显得尤为重要。本实验采用HPLC法测定TP-NLS涂膜剂中TP的量,计算RSD值作为均匀设计的考察指标之一,更加直观准确地反映TP-NLS涂膜剂的均匀性,按最佳工艺制备的TP- NLS涂膜剂严格控制TP在基质中的分布,提高了制剂的安全性。
涂膜剂与其他相同药物配方的凝胶剂、乳剂、膜剂、栓剂等相比,具有制备工艺简单,使用方便,易涂布、耐磨性能比较好,不易脱落,容易洗脱,不污染衣物,患者依从性好等特点[15]。本实验将TP包封成NLS后,制备成涂膜剂,应用于浅表皮肤,TP经过皮肤渗透作用于病灶,绕过肝脏首关效应。另外,涂膜剂膜的形成可使药物与皮肤紧密贴合,减少皮肤表面水分的蒸发,有效促进药物透过角质层缓慢释放,维持稳定持久的血药浓度,更好地发挥治疗作用。
药用辅料是药物制剂存在的物质基础,涂膜剂中成膜材料起到了滞留和保护药物缓慢发挥疗效的作用。单硬脂酸甘油酯存在于天然食品中,无毒,对皮肤和黏膜无刺激性,已应用于我国上市外用制剂,在各剂型中的用量变化较大,在肟康唑乳霜中用量为3.5%,口服黄体酮制剂中用量为90%[7]。实验选择其用量为考察因素,使所制备的TP-NLS涂膜剂增滑,结构细腻,并改善制剂的稳定性。
TP为3个环氧二萜内酯类化合物,水溶性差,易沉积于皮肤,对皮肤产生刺激,如文献报道[5] 1.11 mmol/L即引起兔完整皮肤及破损皮肤红斑及水肿反应。本实验用未经包封的TP直接制备成亲水性涂膜剂,其Q24 h为7.01 µg/cm2,累积透过率40.95%。制备成TP-NLS涂膜剂后,TP-NLS的构造使TP的水溶性增大,在亲水性涂膜剂中更有利于经皮渗透,24 h累积透过率为67.36%。
| [1] | 池婕, 林兵, 刘志宏, 等. 基于最小二乘回归分析法的雷公藤多苷片免疫抑制作用谱效关系研究[J]. 中草药 , 2015, 46 (18) :2755–2758. |
| [2] | 周毅骏, 钦丹萍, 杨新艳, 等. 雷公藤多苷片对溃疡性结肠炎大鼠miR-146a、miR-146b及TLR4/MyD88依赖信号通路的调控作用研究[J]. 中草药 , 2016, 47 (10) :1723–1730. |
| [3] | 骆永伟, 施畅, 廖明阳. 雷公藤甲素抗肿瘤作用机制研究进展[J]. 中国中药杂志 , 2009, 34 (16) :2024–2026. |
| [4] | 赵庆国, 王艳辉, 马致洁, 等. 基于肝细胞毒价检测的雷公藤质量评价方法研究[J]. 中草药 , 2015, 46 (3) :378–383. |
| [5] | 林建峰, 朱惠, 郑幼兰. 雷公藤内酯醇的局部刺激作用[J]. 中国临床药理学与治疗学 , 2000, 5 (2) :131–134. |
| [6] | 孙聚魁, 邓英杰, 曹金娜. 纳米脂质体研究进展[J]. 沈阳药科大学学报 , 2010, 27 (12) :993–1002. |
| [7] | 罗明生, 高天惠, 宋民宪. 中国药用辅料[M]. 北京: 化学工业出版社, 2006 . |
| [8] | 阙慧卿, 彭华毅, 钱丽萍, 等. 雷公藤内酯醇纳米脂质体的处方及制备工艺研究[J]. 中草药 , 2016, 47 (13) :2277–2282. |
| [9] | 庞露, 林耀坚, 陈志科, 等. 复方苦参涂膜剂成膜材料及辅助剂的工艺研究[J]. 中药材 , 2014, 37 (4) :694–697. |
| [10] | 爱民, 贾海波, 贾海鹰, 等. 嘎木朱尔涂膜剂的刺激性考察[J]. 中国民族医药杂志 , 1999, 5 (2) :41. |
| [11] | 谢玲, 钟晓红, 刘东波, 等. 紫珠止血涂膜剂成膜材料及附加剂的优选[J]. 中国实验方剂学杂志 , 2012, 18 (5) :27–29. |
| [12] | 方开泰. 均匀设计与均匀设计表[M]. 北京: 北京科学出版社, 1994 . |
| [13] | 钱丽萍, 阙慧卿, 林绥, 等. 正交试验优选雷公藤涂膜剂的基质组成[J]. 药物评价研究 , 2011, 34 (6) :442–444. |
| [14] | 阙慧卿, 林绥, 钱丽萍, 等. 雷公藤内酯醇生物贴的体外透皮吸收研究[J]. 现代药物与临床 , 2012, 27 (3) :236–238. |
| [15] | 姚威. 涂膜剂的研究进展[J]. 医药导报 , 2008, 27 (12) :1489–1491. |
 2016, Vol. 47
2016, Vol. 47


