青藤碱(sinomenine,SIN)是从防己科植物青风藤Sinomenium acutum (Thunb.) Rehd. et Wils. 或毛青藤Sinomenium scutum (Thunb.) Rehd. et Wils. var. cinereum Rehd. et Wils. 中提取的生物碱单体。药用多为其盐酸盐(sinomenine hydrochloride,SIN-HCl)。SIN-HCl具有抗炎、免疫抑制、镇痛、降压、抗心律失常等药理作用,临床常用于治疗风湿、类风湿关节炎(rheumatoid arthritis,RA)及心律失常等疾病[1]。目前SIN-HCl用于治疗风湿性关节炎及RA的制剂主要为片剂、注射剂及胶囊剂等。然而,由于该药生物利用度低,半衰期短,经体循环后到达病变部位药量少[2-3],故需频繁给药,而临床长期服用易引起皮疹、白细胞减少、血小板减少以及胃痛等胃肠道不良反应等[4]。此外,该药本身对光、热不稳定,易分解[5]。因此,以脂质体和传递体等囊泡系统为载体的透皮给药系统成为其理想的给药方式。
传递体(transfersomes,TFs)作为一种特殊的脂质体,在制备时采用胆酸盐、聚山梨酯类等表面活性剂作为边缘活化剂,使外壁双分子层具有良好的变形性,可以穿透比自身小数倍的孔道[6-8]。根据Cevc的传递体皮肤穿透理论,传递体可经皮肤中的水性通道(hydrophilic pathways)穿透皮肤[9-10]。已有研究表明挥发油可使脂质体的脂质双分子层膜柔化,同时可扩张皮肤水性通道,从而促进载体载带药物穿透皮肤[11-13]。因此,中药挥发油可以用作传递体的边缘活化剂。PEG修饰可使传递体具有较好的柔顺性与亲水性,理论上不影响载体穿透皮肤水性通道,同时,入血后能够降低网状内皮系统的识别和摄取,延长其血液循环时间,并针对RA炎症滑膜部位特殊结构的血管可产生“增强的渗透与滞留”(enhanced permeability and retention,EPR)效应[14],从而实现靶向递药。故本课题组设计了挥发油边缘活化的PEG修饰传递体以实现药物经皮传输与RA炎症滑膜部位的靶向递送。本课题组前期通过考察挥发油种类(薄荷脑、柠檬烯和柠檬醛)对传递体弹性和经皮渗透特性的影响,发现柠檬烯-柠檬醛(1∶1)混合物可明显改善传递体脂质双分子层膜的柔性及其经皮渗透特性。本实验将SIN- HCl制成挥发油[柠檬烯-柠檬醛(1∶1)混合物]边缘活化的PEG修饰传递体,对其理化性质进行表征,通过离体皮肤渗透实验考察传递体中挥发油和二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)2000对SIN-HCl经皮渗透的影响,并与脱氧胆酸钠(DOC)边缘活化的传递体、脂质体和SIN-HCl水溶液对比,研究结果能够为SIN-HCl新型传递体制剂的处方设计提供依据。
1 仪器与材料LC-2130高效液相色谱仪、LC-2030紫外检测器,上海天美科学仪器有限公司;Nano-ZS90粒径分析仪,英国Malvern公司;85-2数显恒温磁力搅拌器,上海江星仪器有限公司;聚碳酸酯径迹蚀刻膜,0.1、0.05 μm,英国Whatman公司;pHS-3C pH计,上海精密科学仪器有限公司;BX51光学显微镜,日本奥林巴斯公司;HOMOEX-25高压膜挤出器,上海赫默仕机电科技有限公司;BS124S电子天平,德国萨多利斯公司;5804R冷冻离心机,德国Eppendorf公司;Microcon离心超滤管,截留相对分子质量10 000,美国Millipore公司。
盐酸青藤碱(SIN-HCl),标示质量分数为98%,批号Bsy090415,西安博胜生物科技有限公司;胆固醇(CH,注射级,批号B01221)、蛋黄卵磷脂(Egg PC,EPC,PL-100M,注射级,磷脂酰胆碱质量分数>80%,批号EK10081)、DSPE-PEG 2000(注射级,批号B20204),上海艾韦特医药科技有限公司;维生素E(VE),批号082K1382,Sigma公司;脱氧胆酸钠(DOC),批号F20091228,国药集团化学试剂有限公司;柠檬烯(质量分数≥98.3%,批号140825)、柠檬醛(质量分数≥97.5%,批号141006),吉安市聚鹏天然香料油有限公司;甲醇,色谱纯,美国Honeywell公司;HPLC用水为双蒸水;其余试剂均为分析纯。
清洁级SD大鼠(200±20)g,雄性,由浙江中医药大学动物实验中心提供,合格证号SCXK(沪)2012-0002。所有动物实验均按照浙江中医药大学动物饲养和使用指南进行。
2 方法与结果 2.1 SIN-HCl传递体和脂质体的制备本课题组前期通过正交设计试验对SIN-HCl挥发油边缘活化的PEG修饰传递体(SHPT)的处方工艺进行了优化研究,并对试验结果分别进行直观分析优化与逐步回归优化得到2个优化处方(SHPT- A、SHPT-B)[15],本实验选取SHPT-A、SHPT-B与另外1个未经优化的处方(SHPT-C)进行皮肤渗透特性考察。此外,通过调整SHPT处方得到了相应的非PEG修饰传递体(SHT-A、SHT-B)、普通脂质体(SHLS)、PEG化脂质体(SHPL)和DOC边缘活化的传递体(SHDT),以便于比较分析。上述各处方见表 1,其制备工艺如下:分别精密称取各个处方量的膜材(VE、EPC、CH、DSPE-PEG 2000、挥发油),溶于2 mL无水乙醇中,得有机相;取处方量的SIN-HCl溶于23 mL磷酸盐缓冲液(PBS)[pH 7.0,相对离子浓度为0.1,相对离子浓度为1所对应的PBS缓冲液为0.067 mol/L的磷酸二氢钾溶液-0.067 mol/L磷酸氢二钠溶液(41.3∶58.7)的混合液],得水相,然后在磁力搅拌条件下将有机相用注射器(2 mL的注射针筒)匀速缓慢注入至25 ℃的水相中,注入完毕后,继续搅拌5 min,室温下静置2 h,置于高压膜挤出器中,依次挤压通过0.1 μm与0.05 μm聚碳酸酯径迹蚀刻膜(挤出压力分别为0.45、0.8 MPa),即得SIN-HCl传递体和脂质体样品。处方中所用挥发油为柠檬烯-柠檬醛(1∶1)混合物。
|
|
表 1 不同处方的传递体和脂质体 Table 1 Various formulations of transfersomes and liposomes |
2.2 SIN-HCl传递体和脂质体理化性质的表征 2.2.1 显微形态观察
分别取SHPT-A与SHLS,稀释适当倍数,吸取少量滴加于铜网正面,过多的样品液用滤纸吸去,用2%醋酸双氧铀溶液负染3 min,取出铜网,用滤纸吸取过多染液,将铜网正面朝上置于玻璃皿中,自然晾干,在透射电子显微镜(TEM)下观察并摄制照片,结果见图 1。结果表明,SIN-HCl传递体SHPT-A(图 1-A)和脂质体SHLS(图 1-B)均以近似圆形的单层囊泡为主,无聚集现象。
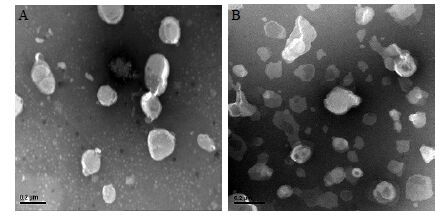
|
图 1 SIN-HCl传递体SHPT-A (A) 和脂质体SHLS (B) 的TEM图 Fig.1 TEM photographs of SHPT-A TFs (A) and SHLS liposomes (B) of SIN-HCl |
2.2.2 弹性测定
本实验采用恒定压力挤出法对SIN-HCl传递体和脂质体的弹性进行测定[16-17]。具体步骤如下:取“2.1”项下未经挤出的传递体和脂质体混悬液,置于高压膜挤出器中,在0.45 MPa氮气压下挤压通过0.1 μm聚碳酸酯径迹蚀刻膜,记录5 min的挤出体积,并采用粒径分析仪测定过膜后传递体或脂质体的粒径,按以下公式计算弹性指数(elasticity index,EI),以示囊泡弹性大小。
EI=F×(rv/rp)2
rv代表传递体或脂质体挤出后的粒径(挤出粒径);rp代表聚碳酸酯径迹蚀刻膜的孔径;F代表 5 min传递体或脂质体混悬液的挤出体积
每个样品平行测定3次,测定结果见表 2。实验数据采用SPSS 17.0软件进行处理,多组间均数两两比较采用单因素方差分析,两组间均数比较采用t检验,统计学结果见表 2。
|
|
表 2 传递体和脂质体的弹性测定结果 (x±s,n = 3) Table 2 Elasticity measurement of transfersomes and liposomes (x±s,n = 3) |
F和rv是影响EI大小的2个主要因素。结果表明,在F方面,SIN-HCl传递体和脂质体大小顺序为SHDT>SHPT-B>SHPT-A>SHT-B≈SHT-A>SHPL>SHLS>SHPT-C。在rv方面,SIN-HCl传递体和脂质体大小顺序为SHT-B>SHPT-C>SHPT-B≈SHLS>SHPL>SHT-A>SHPT-A>SHDT。综合考虑2因素的作用,SIN-HCl传递体和脂质体总的弹性大小顺序为SHPT-B>SHDT≈SHPT-A>SHT-B>SHT-A≈SHPL>SHLS>SHPT-C。
2.2.3 平均粒径与Zeta电位测定取“2.1”项下的SIN-HCl传递体与脂质体样品(SHPL除外),用纯水稀释适当倍数,以粒径分析仪测定其平均粒径、多分散指数(PDI)及Zeta电位,结果见表 3。结果表明,SIN-HCl传递体和脂质体的平均粒径在93~118 nm,且分布较窄;与SHDT相比,SHLS和挥发油边缘活化的传递体具有较大的粒径和较小的Zeta电位绝对值。
2.2.4 包封率测定本实验采用HPLC结合离心超滤法测定包封率[18]。
(1)SIN定量测定的色谱条件与方法学验证:色谱柱为Xtimate C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水-乙二胺(55∶45∶0.225);体积流量为1 mL/min;柱温为30 ℃;检测波长为265 nm;以定量环定量进样10 μL。以峰面积(A,mV·s)为纵坐标,SIN质量浓度(C,μg/mL)为横坐标,进行线性回归,得回归方程A=10 929 C-2 254.5,r=0.999 9,表明SIN在10.16~81.28 μg/mL质量浓度与峰面积呈良好的线性关系。测定方法的精密度、准确度、样品溶液稳定性与重复性经验证符合要求[18]。
(2)包封率测定过程:取“2.1”项下SIN-HCl传递体或脂质体样品(SHPL除外),摇匀,取少量进行光学显微镜观察,确认其中不含药物结晶后精密量取200 μL,置于超滤离心管内,进行冷冻离心(相对离心力13 000×g,温度4 ℃),收集全部外水相,转移至10 mL量瓶中,以流动相定容,摇匀;另精密量取200 μL传递体或脂质体样品置于10 mL量瓶中,先用少量甲醇破乳,摇匀,然后用流动相定容至刻度。根据“2.2.4(1)”项下方法测定并计算外水相和取样量中药物的量。按下式计算SIN- HCl传递体和脂质体的包封率。
包封率=(WS-WEA)/WS
WS为未经离心样品中SIN-HCl的质量(μg),WEA为外水相中SIN-HCl的质量(μg)
结果见表 3。结果表明,SIN-HCl传递体和脂质体的包封率在11%~40%;与SHDT相比,SHLS和挥发油边缘活化的传递体的包封率较低。
|
|
表 3 传递体和脂质体的质量评价结果 (x±s,n = 3) Table 3 Quality assessment of transfersomes and liposomes (x±s,n = 3) |
2.3 离体皮肤渗透特性考察 2.3.1 离体皮肤的制备
取SD大鼠,颈椎脱臼处死后固定于鼠板上,用剃毛器与弯头剪去除大鼠胸骨至腹部的毛发,剪下大鼠腹部皮肤,小心去除皮下脂肪组织,确保皮肤角质层的完整性,用生理盐水漂洗干净,展平并吸去多余水分后用锡箔纸包裹,置于−70 ℃冰箱中冷藏,备用。
2.3.2 离体皮肤渗透实验采用Franz扩散池考察SIN-HCl传递体及脂质体的离体皮肤渗透性。实验前首先将皮肤在室温下解冻,剪取合适大小(有效皮肤面积为0.785 cm2),固定于供给池和接收池之间,使角质层面向供给池,放入接收液[0.9%生理盐水-乙醇(4∶1)混合液],排尽接收池中的气泡使接收液液面与皮肤内层完全接触,接收池水浴温度控制在(32.0±0.5)℃,池内磁力搅拌转速为400 r/min,平衡30 min后,更换新的接收液,分别取SHPT-A、SHPT-B与SHPT-C,上样180 μL(含药量约为450 μg),记下此时间为0 h,于0.5、1、2、4、6、8、10、12、24、36 h时间点取样200 μL,并及时补加等体积的新鲜接收液。按“2.2.4”项下SIN定量测定的色谱条件分析样品液,测得SIN的峰面积,代入标准曲线,即得相应SIN的质量浓度。实验中以SHT-A、SHT-B、SHDT、SHLS和SIN-HCl水溶液[取适量SIN-HCl溶于PBS缓冲液(pH7.0,相对离子浓度为0.1),即得药物浓度为2.5 mg/mL的SIN-HCl水溶液]为参比制剂。
2.3.3 药物累积透过量(Qn)的计算及Qn-t曲线的绘制不同时间点的Qn按下式计算。
Qn=(5Cn+
0.785为透皮扩散面积(cm2),5为接收池体积(mL),0.2为取样体积(mL),Cn为第n个取样点测得的药物质量浓度(μg/mL),Ci为第n个取样点之前某时间点的测定质量浓度(μg/mL)
以各取样点的Qn为纵坐标,时间t为横坐标,绘制不同处方的Qn-t曲线,结果见图 2。不同处方36 h的Qn(Q36)见表 4。
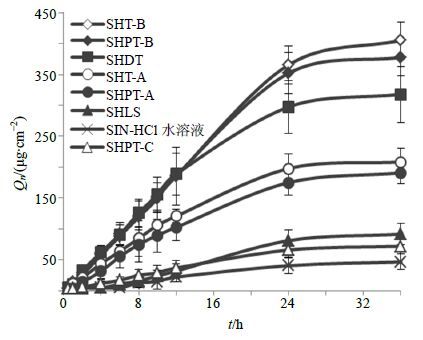
|
图 2 不同处方的Qn-t曲线 (n = 4) Fig.2 Curve of Qn-t from different formulations (n = 4) |
|
|
表 4 不同处方中药物的离体皮肤渗透参数 (x±s,n = 4) Table 4 Penetration parameters of drug from different formulations (x±s,n = 4) |
2.3.4 药物累积透过率(Qe)的计算及Qe-t曲线的绘制
不同时间点的Qe按下式计算。
Qe=Qi/W
Qi为第i个取样点的药物累积透过量,W为上样体积中的含药量
以各取样点的Qe为纵坐标,时间t为横坐标,绘制不同处方的Qe-t曲线,结果见图 3。不同处方36 h的Qe(Qe36)见表 4。
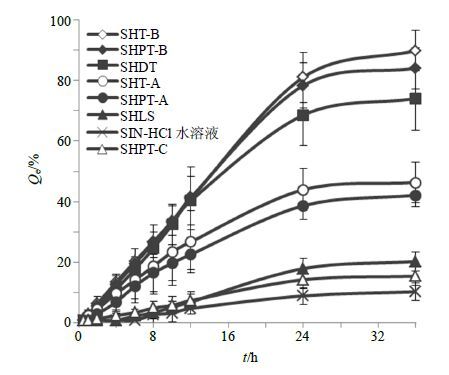
|
图 3 不同处方的药物累积透过率 (n = 4) Fig.3 In vitro cumulative permeated drug rate from different formulations (n = 4) |
由图 2、3可以看出,SIN-HCl各处方的Qn-t曲线和Qe-t曲线在0.5~24 h内均呈现良好的线性关系,在24~36 h时段内,各处方的Qn和Qe基本达到平稳状态。
2.3.5 稳态经皮渗透速率(J)及时滞(Tlag)的计算对Qn-t曲线中稳态渗透段(直线部分)进行线性回归,所得直线的斜率即为J[μg/(cm2∙h)],直线与横坐标交点对应的时间即为Tlag(h),结果见表 4。实验数据采用SPSS 17.0软件进行处理,多组间均数两两比较采用单因素方差分析,两组间均数比较采用t检验,统计学结果见表 4。结果表明,各载体Q36、Qe36和J的大小顺序一致,均为SHT-B>SHDT>SHLS>SIN-HCl水溶液,Tlag的大小顺序则与之相反。其中,SHT-B的J达到最大,Tlag最短,其Qe36约为SHDT、SHLS和SIN-HCl水溶液的1.2、4.2、8.4倍,差异具有统计学意义(P<0.01)。SIN-HCl水溶液的Q36、Qe36和J仅约为SHLS的一半,Tlag最长,可见其皮肤渗透特性最差;经对比PEG修饰前后SIN-HCl传递体的Qe36和J可知,SHT-B约为SHPT-B的1.1倍,SHT-A约为SHPT-A的1.2倍,PEG修饰前后SIN-HCl传递体的Tlag相近,表明PEG修饰前后传递体的皮肤渗透特性差异较小;在SHPT处方中,其Q36、Qe36和J的大小顺序均为SHPT-B>SHPT-A>SHPT-C,Tlag的大小顺序与之相反。当挥发油用量为磷脂量的9.3%(SHPT-B)时传递体的J达到最大,Tlag最短,其Qe36分别为SHPT-A和SHPT-C的2.0、5.6倍,差异具有统计学意义(P<0.01)。
3 讨论本实验以SIN-HCl为模型药物,采用乙醇注入法制备了不同处方的SIN-HCl传递体和脂质体,所制得的传递体和脂质体的形态圆整,粒径适宜,分布较窄。
3.1 SIN-HCl传递体和脂质体的弹性普通脂质体具有刚性,缺乏足够的弹性而无法发生相应的变形。边缘活化剂的加入能适当弱化双分子层膜,降低磷脂的“刚性效应”,产生可控制的、局部的双分子层去稳定化,从而提高脂质双分子层的弹性[19]。由“2.2.2”项下的弹性结果可知,就SHPT而言,其弹性大小为SHPT-B>SHPT-A>SHPT-C,结合表 1处方数据,3个SHPT处方中除挥发油用量有较大差异外其余成分的用量基本一致,可见挥发油用量对SHPT的弹性有极显著影响(P<0.01),当挥发油用量为磷脂量的9.3%(SHPT- B)时传递体弹性最大,该挥发油用量为最佳;此外,该结果可以佐证挥发油对脂质双分子层的边缘活化作用。就是否PEG修饰而言,SHPL>SHLS、SHPT-B>SHT-B、SHPT-A>SHT-A,均有极显著性差异(P<0.01),表明PEG修饰可以显著提高脂质体及挥发油边缘活化传递体的弹性。就不同的载体而言,SHPT-B>SHDT>SHT-B>SHLS,可以看出挥发油的加入可以使脂质体的弹性显著增加,这可能与挥发油的边缘活化作用有关[13],而挥发油边缘活化的传递体经PEG修饰后其弹性进一步显著增加,且当其处方量合适时可强于脱氧胆酸钠边缘活化的传递体,这可能是因为PEG链可以增加囊泡的柔顺性[14]。
由EI的公式可知,rp固定不变,EI的大小取决于F和rv 2个因素。“2.2.2”项下SIN-HCl传递体和脂质体的弹性结果显示,一方面,就F而言,在PEG修饰的传递体和脂质体中,SHPT-B>SHT-B、SHPT-A>SHT-A、SHPL>SHLS,PEG的加入使传递体和脂质体的F显著增大,而rv减小,可见F为EI增加的主要贡献者,这可能是由于PEG可在囊泡的表面形成水化膜,增加其柔顺性,使其更易通过固定孔径的小孔;在SHPT的3个处方中,SHPT-B>SHPT-A>SHPT-C,可以看出挥发油用量对F有不同程度的影响,当挥发油用量为磷脂量的9.3%(SHPT-B),传递体的F最大,对EI增加的贡献亦达到最大;比较SHPT-B与SHT-B、SHPL的F大小,可以推测在增加F上挥发油与PEG的加入可产生协同效应。另一方面,就rv而言,在PEG修饰前后的传递体和脂质体中,SHT-B>SHPT-B、SHT-A>SHPT-A、SHLS>SHPL,可见PEG修饰后的传递体和脂质体的rv减小,使rv对EI增加的贡献明显降低,这是因为PEG修饰后的囊泡之间不易聚集,囊泡表面曲率增加,使得粒径变小,分散体系也变得更稳定。在不同载体中,SHT-B>SHPT-B≈SHLS>SHDT,挥发油的加入使脂质体的rv明显增大,经挥发油边缘活化传递体的rv明显大于DOC边缘活化的传递体,这就使rv成为其EI的主要贡献者,同时表明在挥发油边缘活化作用下的传递体可能具有更强的变形能力。这可能与边缘活化剂的亲水亲油平衡值(HLB)有关。一般,边缘活化剂的HLB值越低,囊泡的粒径会越大[20]。由于挥发油具有较强的疏水性,其HLB值明显小于脱氧胆酸钠,与磷脂的疏水基团相互作用,可以增加双分子层的堆积密度,从而增加表面自由能,使囊泡的粒径增大。
3.2 SIN-HCl传递体与其脂质体的离体皮肤渗透特性 3.2.1 不同载体的渗透特性通过比较各载体的离体皮肤渗透特性,可以得出SHPT-B具有良好的皮肤渗透特性。结合表 1的处方数据和表 2的弹性测定数据,推测SHPT-B良好的渗透特性可能与以下因素有关:第一,在弹性上,与SHDT相比,两者的F相近,而SHPT-B具有更大的rv,具有较强的变形能力,故SHPT-B的渗透特性优于SHDT;与SHLS相比,SHPT-B具有近5倍大小的F,尽管两者的rv相近,但是SHLS是由其刚性所致,而SHPT-B是由其变形性所致,变形性有利于囊泡穿透皮肤,故SHPT-B的渗透特性远优于SHLS。第二,在边缘活化剂上,与SHDT相比,SHPT-B是以挥发油为边缘活化剂,萜烯类成分(柠檬烯-柠檬醛混合物)能够通过提高与皮肤的水合力,使角质层紧密物质开口,增加皮肤水性通道的孔径,降低皮肤屏障的阻力,使得传递体易携带药物穿透皮肤,促进药物的透皮吸收[21-22]。SHLS的J较传递体明显降低,Tlag亦相应延长,其Qe36仅约为SHPT-B的1/4,可以看出SHLS的皮肤渗透特性明显差于SIN-HCl传递体。这可能是由于脂质体主要通过贮库效应与膜间转运机制促进药物经皮渗透[23]。
3.2.2 DSPE-PEG2000对传递体渗透特性的影响 由“2.3.5”项下离体皮肤渗透结果可知PEG修饰前后传递体的皮肤渗透特性存在较小差异。这可能与以下2方面有关:一方面,由表 2中SHPT-B与SHPT-A的弹性测定数据可知,与SHPT-B、SHPT-A相比,SHT-B和SHT-A的F较小,而rv较大,推测其可能具有比SHPT-B或SHPT-A稍强的变形能力,易穿过比自身小数倍的皮肤孔道实现药物的经皮传输,故呈现较SHPT-B或SHPT-A稍好的渗透特性。另一方面,脂质囊泡被PEG包裹,PEG链的空间位阻[24-25]减弱了传递体穿过水性通道的能力,从而影响了PEG修饰传递体的渗透特性。
3.2.3 挥发油用量对传递体渗透特性的影响SHPT的离体皮肤渗透实验结果显示,合适用量挥发油边缘活化的PEG修饰传递体具有良好的经皮渗透特性。结合表 2中SHPT的弹性测定数据可知,F为其EI增加的主要贡献者,与SHPT-A和SHPT-C相比,SHPT-B的F对EI增加的贡献达到最大,且其较大的rv保证其具有足够的变形能力,这就使SHPT-B易携带药物经水性通道穿透皮肤,呈现良好的渗透特性。而当挥发油用量为磷脂量的6.7%(SHPT-A)时传递体的Q36、Qe36、和J均降低,Tlag出现延长,因而呈现相对较差的渗透特性。在挥发油用量为磷脂量的12.7%(SHPT-C)时传递体的Q36、Qe36、J则均小于SHLS,Tlag呈现最长,渗透特性最差。结合表 2的弹性测定数据和表 3的质量评价数据,推测这可能与其F过小及rv过大所致的成品粒径过大而被限制在皮肤表面有关。
3.2.4 “封闭效应”对各处方渗透特性的影响本研究制备的SIN-HCl传递体和脂质体的包封率虽不高但却有足够大的Qn和Qe。这可能与其“封闭效应”有关,即未被包封于传递体或脂质体中的“游离”药物可与脂质囊泡结合或随脂质囊泡进入皮肤组织[26]。
3.3 边缘活化剂的选择与常用的化学类边缘活化剂相比,挥发油一般安全性良好,对皮肤的刺激性和毒性较低;在制备中与脂质材料的相容性更好。本实验采用合适用量的挥发油(柠檬烯-柠檬醛混合物)代替表面活性剂作为边缘活化剂加入到PEG修饰传递体中,得到了具有良好弹性和经皮渗透特性的SIN-HCl PEG修饰传递体。研究结果对于皮肤下局部组织递药的传递体的设计以及挥发油作为传递体的边缘活化剂应用均具有一定的借鉴意义。
| [1] | 朱士龙, 陈迪钊, 李勇, 等. 青藤碱最新研究进展[J]. 吉首大学学报:自然科学版 , 2011, 32 (5) :95–100. |
| [2] | 韩文霞, 李伟泽, 汪兴军, 等. 盐酸青藤碱纳米柔性脂质体的制备及其性质研究[J]. 中草药 , 2011, 42 (4) :671–675. |
| [3] | 李周, 王利胜, 巴文强, 等. 青藤碱、雷公藤甲素皮肤和血液在体微透析方法的建立[J]. 中草药 , 2015, 46 (14) :2076–2081. |
| [4] | 王利胜, 张升, 刘丽萍, 等. 青藤碱微乳凝胶的制备及体外透皮特性研究[J]. 中药新药与临床药理 , 2011, 22 (1) :21–24. |
| [5] | 朱士龙, 陈迪钊, 李勇, 等. 青藤碱-β-环糊精包合物的制备及表征[J]. 中草药 , 2012, 43 (7) :1328–1332. |
| [6] | 方蓉, 郑杭生, 陈思思. 离体皮肤渗透法测定三七总皂苷传递体经皮吸收特性[J]. 中草药 , 2015, 46 (4) :513–519. |
| [7] | 陈思思, 郑杭生, 王娟, 等. 三七总皂苷传递体的制备及其治疗大鼠急性软组织损伤作用研究[J]. 中草药 , 2015, 46 (14) :2070–2075. |
| [8] | 李莎莎, 宋艳丽, 危红华, 等. 传明酸传递体的制备及其性质考察[J]. 中草药 , 2013, 44 (22) :3141–3146. |
| [9] | Cevc G. Lipid vesicles and other colloids as drug carriers on the skin[J]. Adv Drug Deliv Rev , 2004, 56 (5) :675–711. DOI:10.1016/j.addr.2003.10.028 |
| [10] | 张亚军, 杨建宏, 韩娇娇, 等. 在体皮肤微透析技术评价苦参碱传递体的透皮释药性能[J]. 中草药 , 2013, 44 (23) :3341–3345. |
| [11] | Maghraby G E, Williams A C, Barry B W. Interactions of surfactants (edge activators) and skin penetration enhancers with liposomes[J]. Int J Pharm , 2004, 276 (1/2) :143–161. |
| [12] | Dragicevic-Curic N, Scheglmann D, Albrecht V, et al. Temoporfin-loaded invasomes:Development, characterization and in vitro skin penetration studies[J]. J Control Release , 2008, 127 (1) :59–69. DOI:10.1016/j.jconrel.2007.12.013 |
| [13] | Rangsimawong W, Opanasopit P, Rojanarata T, et al. Terpene-containing PEGylated liposomes as transdermal carriers of a hydrophilic compound[J]. Biol Pharm Bull , 2014, 37 (12) :1936–1943. DOI:10.1248/bpb.b14-00535 |
| [14] | 张迪, 徐缓, 胡美娜, 等. 脂质体面临的聚乙二醇"窘境"及其解决方法[J]. 药学学报 , 2015, 50 (3) :252–260. |
| [15] | 方蓉. 盐酸青藤碱PEG修饰传递体的制备及其药动学研究[D]. 杭州:浙江中医药大学, 2015. |
| [16] | Chaudhary H, Kohli K, Kumar V K. Nano-transfersomes as a novel carrier for transdermal delivery[J]. Int J Pharm , 2013, 454 (1) :367–380. DOI:10.1016/j.ijpharm.2013.07.031 |
| [17] | Hiruta Y, Hattori Y, Kawano K, et al. Novel ultra-deformable vesicles entrapped with bleomycin and enhanced to penetrate rat skin[J]. J Control Release , 2006, 113 (2) :146–154. DOI:10.1016/j.jconrel.2006.04.016 |
| [18] | 郑杭生, 佐拉·沙肯迪克, 王湘林, 等. 离心沉淀-离心超滤法测定盐酸青藤碱脂质体的包封率[J]. 中草药 , 2011, 42 (8) :1523–1527. |
| [19] | Sharma A, Jain S, Modi M, et al. Recent advances in NDDS (novel drug delivery systems) for delivery of Anti-HIV drugs[J]. Res J Pharm Biol Chem Sci , 2010, 3 (1) :78–88. |
| [20] | Lei W, Yu C, Lin H, et al. Development of tacrolimus-loaded transfersomes for deeper skin penetration enhancement and therapeutic effect improvement in vivo[J]. Asian J Pharm Sci , 2013, 8 (6) :336–345. DOI:10.1016/j.ajps.2013.09.005 |
| [21] | 张春凤, 杨中林, 罗佳波. D-柠檬烯和L-柠檬烯对盐酸川芎嗪透皮吸收的影响[J]. 药学学报 , 2006, 41 (8) :772–777. |
| [22] | 冯鑫. 挥发油促透作用适用性研究进展[J]. 中成药 , 2013, 35 (1) :157–161. |
| [23] | 王岩, 王婴, 凌家俊, 等. 青藤碱脂质体贴剂的经皮渗透行为研究[J]. 中国新药杂志 , 2008, 17 (24) :2108–2111. |
| [24] | Vertut-Doï A, Ishiwata H, Miyajima K. Binding and uptake of liposomes containing a poly (ethylene glycol) derivative of cholesterol (stealth liposomes) by the macrophage cell line J774:influence of PEG content and its molecular weight[J]. Biochim Biophys Acta , 1996, 1278 (1) :19–28. DOI:10.1016/0005-2736(95)00185-9 |
| [25] | Harvie P, Wong F M, Bllay M B. Use of poly(ethylene glycol)-lipid conjugates to regulate the surface attributes and transfection activity of lipid-DNA particles[J]. J Pharm Sci , 2000, 89 (5) :652–663. DOI:10.1002/(SICI)1520-6017(200005)89:5<652::AID-JPS11>3.0.CO;2-H |
| [26] | 郑俊民. 经皮给药新剂型[M]. 北京: 人民卫生出版社, 2006 . |
 2016, Vol. 47
2016, Vol. 47


