慢性肝病,如肝炎、肝硬化、酒精性肝病等常引起全身多系统损害,也可引起骨代谢异常,导致肝性骨病的发生[1]。国外研究发现,骨质疏松是慢性肝病患者最为常见的并发症之一[2],据不同文献报道,慢性肝病合并骨质疏松症的发生率为12%~55%,骨折发生率为5%~20%[3]。本实验以CCl4造成小鼠肝纤维化,同时测定与骨丢失相关的指标,初步探讨肝纤维化引起的小鼠骨质的变化。
肝纤维化组织学改变为胶原等细胞外基质蛋白增加并在肝内沉积过量,它是各种慢性肝病的共同病理学基础。目前虽有大量关于抗肝纤维化的报道,但临床所使用的化学药大多有副作用、药效慢且价格昂贵[4],而中药由于其多药效、多靶点的优势,已吸引大量学者研究[5]。根据中医理论,肝纤维化属于“痞块” “积聚”范畴[6],《张氏医通 积聚》云:“积之成也,正气不足,而后邪气踞之。”认为肝纤维化的病机为气虚血瘀,肝络。红芪性温、味甘,具有补气升阳的功效,炙用可以补中益气,治疗一系列气虚血衰之症[7, 8]。
骨质疏松在中国传统医学属于骨痿、骨痹、腰痛等病范畴[9]。中医理论认为肾精不足是骨质疏松的首要病机,《内经》:“骨者,髓之府” “腰者,肾之府” “肾主骨” “肾主骨髓”[10]。肝气郁结是其次病机,肝脏气血衰少,筋络不畅,则行动迟缓,不能久行久立,从而发生骨痿;脾胃虚弱是第三病机[11]。《素问•逆调论篇》:“肾不生,则髓不能满;肾气热则腰脊不举,水不胜,骨枯而髓虚,足不任身;腰者,肾之府,转摇不能,肾将惫矣”。可见,骨质疏松症的病因病机主要是肾亏、脾虚、血瘀3个因素[12]。而红芪具有补气升阳、生津养血、行滞通痹等功效[13]。故而本研究探索红芪对肝纤维化作用的同时,按照中医学理论,初步探索其对骨质疏松的作用,同时研究二者之间的联系。
1 材料 1.1 药材与试剂红芪药材,购买甘肃省陇南市武都米仓山,经兰州大学生药学研究所马志刚教授鉴定为多序岩黄芪Hedysarum polybotrys Hand. -Mazz. 的干燥根;秋水仙碱片(西双版纳药业有限责任公司,批号140505,每粒0.5 mg);CCl4(山东禹王实业有限公司化工分公司);橄榄油(陇南庄园植物油开发有限公司);羟脯氨酸(Hyp)、抗酒石酸酸性磷酸酶(TRACP)、碱性磷酸酶(ALP)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总蛋白(TP)、白蛋白(ALB)、血清钙(Ca)、血清磷(P)试剂盒,均购自南京建成生物制药公司。
1.2 动物昆明种小鼠,雌雄各半,体质量18~25 g,兰州大学动物实验中心提供,合格证号SCXK(甘)2013-0002。小鼠在正常环境下饲养,温度(21±2)℃,相对湿度(50±5)%,12 h昼夜周期,自由进食进水一周后开始实验。动物实验操作程序均符合国家科委颁布的《实验动物管理条例》。
1.3 仪器R-200旋转蒸发仪(BUCHI Labortechnik AG瑞士步琦有限公司);WX-4000微波消解仪(上海屹尧仪器科技发展有限公司);550酶联免疫检测仪(美国Bio-Rad公司);SK-1涡旋混匀器(江苏省金坛市友联仪器研究所);CR22GII、HITACHI离心机(日本株式会社日立制作社);YQ-220D数控超声波清洗器(上海易净超声波仪器有限公司);BP211D、BS224S、Sartorius AG电子天平(德国赛多利斯)。
2 方法 2.1 样品制备[14]称取150 g粉碎的红芪药材粉末,加入6倍量95%乙醇回流提取,每次1 h,提取3次后,将药渣置于阴凉处干燥后,加入6倍量的醋酸乙酯回流提取3次,每次1 h,药渣晾干后,加入10倍量的水,温浸1.5 h,取上清液加入乙醇使终浓度为70%,离心得到沉淀,挥去所含有机溶剂,冷冻干燥后即得到红芪粗多糖。经苯酚硫酸法测定其中多糖质量分数为82%。
2.2 小鼠肝纤维化模型的制备[15]及分组给药将90只小鼠随机分为6组:对照组、模型组、阳性药组以及红芪多糖高、中、低剂量组,每组15只。除对照组外,其余组sc 1 mL/kg 40% CCl4橄榄油溶液(体积比为4∶10),每5天注射1次,连续7次,制备小鼠肝纤维化模型,对照组仅sc橄榄油溶液。从造模开始,阳性药组给予0.6 mg/kg秋水仙碱片,红芪多糖高、中、低剂量组给予生药剂量为20、10、5 g/kg的红芪多糖,ig给药,给药体积为1 mL/kg,每天给药1次。
2.3 样本取材35 d实验结束时,模型组死亡4只小鼠,阳性药组及红芪多糖各剂量组均死亡2只。小鼠摘眼球取血,静置1 h后,4 000 r/min离心15 min,取上清液,进行指标测定;解剖取肝脏及脾脏,计算各脏器指数;同时取小鼠右股骨,剔除肌肉,称重后,测定骨中羟脯氨酸(Hyp)水平。
2.4 指标测定 2.4.1 血清指标检测按相应试剂盒说明书,检测血清中ALT、AST、TP、ALB水平。计算白球比例[A/G=ALB/(TP-ALB)]。
2.4.2 肝脏及胸腺指数检测取肝脏及脾脏,称质量,计算脏器指数[肝脏(胸腺)指数=脏器质量/小鼠体质量×10]。
2.4.3 肝组织病理切片观察按标准实验操作步骤,将肝小叶经10%甲醛溶液固定,石蜡包埋,4~6 μm切片,经苏木精-伊红及Masson 3色染色后在电镜下观察肝脏炎症及肝纤维化程度。依据2000年西安全国肝病会议通过的标准[16],将肝炎病变依炎症活动度分为4级:“−”汇管区周围及肝小叶内无炎症;“+”肝细胞变性范围不超过肝小叶半径的1/2,汇管区有炎症,小叶内少数肝细胞变性或呈点状坏死;“++”肝细胞变性范围超过肝小叶半径1/2,汇管区大量炎症细胞浸润,较多肝细胞变性,呈碎片状坏死;“+++”肝细胞变性范围超过肝小叶半径的2/3,汇管区周围重度碎屑坏死,肝细胞以碎片状和桥接状坏死为主。肝纤维化按情况严重程度分为以下4级:“−”无肝纤维化现象;“+”汇管区胶原纤维增多,但无纤维间隔形成;“++”汇管区周围形成彼此不连接的不完全性纤维间隔;“+++”小叶结构紊乱,纤维间隔明显,分割肝实质。
2.4.4 骨丢失指标测定血清指标有TRACP、ALP、Ca、P,按照试剂盒说明,采用酶标仪测定。取称质量后的小鼠右股骨,于50 ℃烘箱内放置72 h,待完全干燥后,研磨至粉末状,按试剂盒说明测定骨中Hyp水平。
2.5 统计方法实验数据均以x±s表示,采用SPSS 19.0软件分析,定量资料采用单因素方差分析,组间比较运用LSD检验;半定量资料采用Ridit分析方法[17]。
3 结果 3.1 对血清指标及脏器指数的影响与对照组比较,模型组5个血清指标均有显著性差异(P<0.01、0.001),说明模型制备成功;给药组、阳性药组与模型组比较,各指标亦呈显著性差异(P<0.05、0.01、0.001)。可见,红芪多糖与秋水仙碱均对CCl4所致肝纤维化有改善作用。结果见表 1。
| 表 1 红芪多糖对CCl4所致肝纤维化小鼠血清指标的影响 Table 1 Effect of HRP on serum indexes of hepatic fibrosis mice induced by CCl4 |
模型组肝重指数和胸腺指数明显上升,对照、红芪多糖及阳性药组与之比较均有显著差异(P<0.05、0.01),说明CCl4造模导致小鼠肝脏、胸腺肿胀坏死,发生一定程度的纤维沉积及肝脏脂质化反应,而红芪多糖与秋水仙碱能较好地改善病变,结果见表 2。
| 表 2 红芪多糖对肝纤维化小鼠脏器指数的影响 Table 2 Effect of HRP on organ indexes of hepatic fibrosis mice induced by CCl4 |
红芪多糖3个剂量均有良好的改善肝纤维化的效果,中剂量组疗效最显著,因此对该剂量组小鼠肝组织进行病理观察结果统计。
3.2 组织学病理研究模型组肝小叶内多数肝细胞浑浊肿胀,胞浆疏散,呈灶性坏死,汇管区多数发生炎症细胞浸润;而红芪多糖及阳性药组从切片中观察,肝细胞索排列整齐,以中央静脉为中心向四周呈放射状,肝细胞大多完整,无点状坏死及炎症细胞浸润的现象,见图 1。模型组汇管区纤维间隔已形成,肝小叶结构紊乱,红芪多糖及阳性药组则无明显纤维间隔形成,见图 2。说明CCl4造成小鼠肝纤维化,造模方式可靠,秋水仙碱与红芪多糖均对肝炎症状有良好治疗效果。
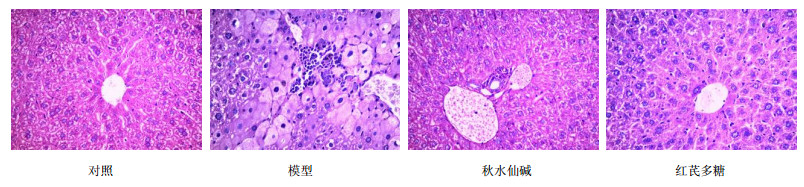 | 图 1 经苏木精-伊红染色后的各组肝脏切片 Fig.1 Histological examination of liver tissue by hematoxylin and eosin staining of mice in each group |
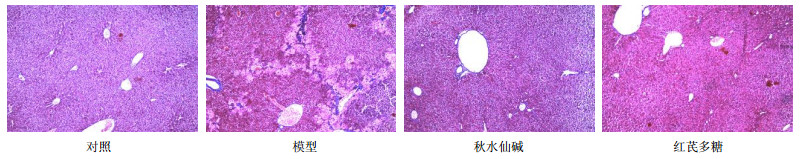 | 图 2 经Masson染色后的各组肝脏切片 Fig.2 Histological examination of liver tissue by Masson’s trichrome staining of mice in each group |
肝细胞变性坏死程度的Ridit值,经One Way ANOVA检验得,F=55.589,P<0.05,说明表 3中不同组别所测该指标的差异显著;同时通过LSD及SNK检验两两比较,可知对照、红芪多糖及阳性药组与模型组比较,均差异显著(P<0.05),说明造模成功,秋水仙碱与红芪多糖能显著改善肝细胞变性坏死状况;同理,肝纤维化程度的Ridit值经One Way ANOVA检验得,F=69.570,P<0.05,说明表 3中不同组别所测该指标的差异显著;两两比较可知:对照、红芪多糖及阳性药组与模型组比较,结果均为P<0.05。说明肝纤维化模型成功,秋水仙碱与红芪多糖能显著改善肝纤维化状况。结果见表 3。
| 表 3 肝纤维化小鼠组织病理分级变化程度 Table 3 Pathologic grading of hepatic fibrosis mice induced by CCl4 |
模型组与对照组比较,5个指标均差异显著(P<0.05、0.01)。其中TRACP为骨吸收指标,ALP为骨形成指标,模型组中TRACP指标显著上升(P<0.05),说明骨吸收反应明显,而ALP指标亦呈上升趋势(P<0.05),说明骨吸收加剧,产生代偿性ALP增多,说明发生了高转换型骨丢失;同时结合血清钙和磷指标的显著性升高(P<0.05),进一步说明骨对矿物元素钙磷的吸收减少,钙磷释放入血,故血清中水平显著升高;Hyp在胶原蛋白中占13.4%,而胶原蛋白大多分布在皮肤、腱及软骨等处,能反映结缔组织的胶原代谢情况,模型组骨中Hyp水平显著下降(P<0.05)。综合5个指标,说明模型组一定程度形成了骨丢失。阳性药及红芪多糖各组与模型组比较,显著改善了上述5个指标的状况(P<0.05)。结果见表 4。
| 表 4 红芪多糖对肝纤维化所致小鼠骨丢失的影响 Table 4 Effect of HRP on bone loss in hepatic fibrosis in mice induced by CCl4 |
CCl4致小鼠肝纤维化作为一种经典造模方式,具有耗时短、病变典型及价格低廉等优点[18]。CCl4作为一种外源性的毒物,主要是通过免疫反应造成肝细胞坏死和实质性炎症,产生大量细胞因子,促进细胞外基质的大量分泌合成,而未能及时降解,致使细胞外基质在肝内过度增生和异常沉积导致肝纤维化[19]。模型组中肝细胞大量坏死,炎症细胞浸润,肝小叶结构排列紊乱;胶原纤维大量沉积,纤维间隔明显,同时伴随肝小叶结构紊乱。各血清指标结果显示模型组与对照组存在显著差异。证明造模方式是成功可行的。
4.2 肝纤维化与骨丢失之间的关系各种原因的慢性肝病如病毒性、胆汁淤积性、酒精性肝病以及肝移植术后患者均可发生骨性营养不良,严重者可导致骨折,国外研究发现[20],骨质疏松是慢性肝病患者中最为常见的并发症之一。其发病机制尚未完全明了[21],且由于多种慢性肝病均可导致骨质疏松,故针对不同的原发性病因文献中有不同报道。有报道称,原发性胆汁性肝硬化病人骨质疏松的患病率平均在35%左右[22]。它是以慢性胆汁淤积为主要特征的自身免疫性疾病,呈进行性加重,患者大多发展为肝硬化及肝衰竭[23]。其中,三分之一的进行性胆汁淤积的病人存在骨质疏松,另三分之一的病人存在骨量减少,而大约20%的此类病人会发生非外伤性骨折[24];酒精性肝硬化在西方国家占肝硬化首位,其骨质疏松的发生率为30%[25]。患者发生骨折的概率一般为正常人的2~3倍,酒龄越长则概率越大。长期酗酒不仅导致骨脆性增加,骨折危险性增高,而且延迟骨折愈合,严重者亦可出现多发性腰椎骨折等[23];50%左右的病毒性肝硬化患者也会发生骨质疏松[26],在未出现肝硬化的慢性乙型及丙型病毒性肝炎病人中,32%的病人被诊断为骨质疏松[27]。对于病毒性肝炎患者骨质疏松症的发生率是否与其肝病的严重程度平行,目前尚存在争议。
本研究利用CCl4造成小鼠肝纤维化,肝纤维化则在一定程度上导致了小鼠骨丢失,各血清指标变化显著,说明二者之间存在紧密联系,骨丢失确为肝纤维化的并发症。
肝病相关性骨质疏松症的发病率逐年上升,虽有小样本试验研究各类慢性肝病引发骨质疏松的病因病机,但临床仍缺乏大规模的严格设计的流行病学资料研究。且遗传、环境、免疫等多种因素均参与调节骨代谢过程,增加了研究肝病性骨质疏松的复杂性,所以目前这一领域有待更加深入地研究[23]。
4.3 阳性药及测定指标的选择秋水仙碱是国际上公认的治疗肝纤维化的药物,其作用机制是破坏促进肝前胶原分泌的微管的聚集,刺激胶原酶的产生而促进胶原的分解,抑制生长细胞因子的释放[28]。
ALT和AST是存在于肝细胞浆内的可溶性酶,若肝细胞损伤坏死,胞浆内两种转氨酶则释放入血,血清中水平升高,对于肝硬化、肝纤维化及肝癌的检测非常准确[29];TP用来检测肝功能的代谢能力,反映肝脏的储备能力,由ALB和球蛋白(GLB)组成。其中ALB由肝实质细胞合成,是血浆中水平最多的蛋白质,若肝功能障碍,则其合成蛋白质减少;GLB则反映肝脏合成功能,发生慢性肝炎、肝硬化时,球蛋白会明显增高,表示肝细胞受损,肝功能下降;肝脏指数反映了肝脏肿胀程度及表面胶原纤维沉积状况。
骨代谢生化标志物可以敏感地反映骨骼代谢的动态变化,简便快捷,且能跟踪监测及预防诊断[30]。骨密度虽为国际上诊断“骨质疏松”的金标准,具有无创伤性、客观性及敏感性的特点,但不能反映短期内骨转换速率而有局限性[31]。故本研究根据实验周期特点,选择测定生化指标来反映可能存在的骨丢失状况。骨质疏松的发生主要是由于骨转换状态的失衡,包括骨形成(成骨细胞)和骨吸收(破骨细胞)两方面的指标。血清ALP主要来自骨和肝,其中骨型约占总量的二分之一[32],骨ALP是一种胞内酶,通过水解成骨细胞膜上的磷脂,释放无机磷,使其浓度升高,促进基质矿化,增加骨矿水平,该指标主要用来反映成骨细胞活性[33]。本实验因条件所限,测定了血清中总ALP水平,肝纤维化及骨丢失均导致该水平上升,一般认为是骨吸收亢进而出现的代偿性骨形成增强[34];TRACP来源于骨、前列腺、红细胞及血小板等,在骨组织中由破骨细胞分泌并释放入血[35],是反映骨吸收的特征性酶,其作为反映骨吸收的指标从1982年就开始使用[32];血钙及血磷作为骨中矿物质,大量存在于骨组织中,若骨吸收加剧,则钙磷释放入血,反映骨吸收与骨形成的不平衡;Hyp在胶原蛋白中占13.4%,而胶原蛋白大多分布在皮肤、腱及软骨等处,能反映结缔组织尤其是骨中胶原代谢情况。
本研究以sc CCl4的方式导致小鼠肝纤维化,从血清指标和肝脏切片可看出CCl4所致小鼠肝纤维化明显;同时测定短期骨生化指标,及时反映了骨代谢状况及整体骨丢失的情况,发现肝纤维化导致了一定程度的骨丢失,说明二者之间存在一定联系。给予红芪多糖后,发现对肝纤维化及骨丢失均有良好改善作用,初步说明研究开发该药材的意义所在。后续在此基础上本实验室会进一步从分子机制水平探究二者之间的关系,使结果更为完善和深入。
| [1] | 张思伟, 游玉梅, 王毅明. 慢性肝病骨代谢变化的临床研究[J]. 中国医学影像学杂志, 2010, 18(2): 127-129. |
| [2] | Collier J. Bone disorders in chronic liver disease[J]. Hepatology, 2007, 46(2): 1271-1278. |
| [3] | Gonsalkorala E S, Tallis C, Stuart K A, et al. Hepatic osteodystrophy in chronic liver disease[J]. J Gastroen Hepatol, 2013, 28(S2): 60. |
| [4] | 饶建波, 喻松仁, 刘春燕. 中药抗肝损伤作用实验研究近况[J]. 甘肃中医, 2010, 23(3): 76-78. |
| [5] | 曹 雯, 廖 明, 周 燕. 基于同位素标记相对和绝对定量技术的联合用药抗肝纤维化作用的蛋白质组学研究[J]. 中草药, 2015, 46(1): 73-79. |
| [6] | 吴继良. 六味五灵片抗肝纤维化临床疗效观察[J]. 中国肝脏病杂志: 电子版, 2011, 3(3): 8-10. |
| [7] | 杨 林, 谭玉玲. 中药红芪研究现状[J]. 中外医疗, 2010, 29(5): 120-121. |
| [8] | 赵昱波, 陈 俊, 许 浚, 等. 红芪的化学成分及抗肿瘤作用研究进展[J]. 中草药, 2015, 46(22): 3434-3440. |
| [9] | 张 华, 宁显明, 朱洪民. 刘庆思教授论治骨质疏松症经验[J]. 河南中医, 2001, 21(2): 30. |
| [10] | 韩崇涛, 齐秀春. 补肾中药改善骨质疏松症的实验研究进展[J]. 中医学报, 2009, 24(6): 114-116. |
| [11] | 邢 燕, 毕宏焱, 尹丽梅, 等. 中医药治疗骨质疏松症的进展[J]. 中国骨质疏松杂志, 2011, 17(12): 1115-1118. |
| [12] | 赵咏芳, 张 戈, 史万忠, 等. 骨质疏松症中医证型的初步临床报告[J]. 中医正骨, 1998, 10(5): 9-10. |
| [13] | 中国药典 [S]. 一部. 2010. |
| [14] | 马 丹, 封士兰, 赵良功, 等. 红芪多糖的提取分离纯化及组成分析[J]. 中国现代应用药学, 2008, 25(3): 177-179. |
| [15] | 邹丽宜, 吴 铁, 崔 燎, 等. 甘草酸对小鼠肝纤维化性骨丢失的防治作用及机制探讨[J]. 中国临床康复, 2005, 9(7): 217-219. |
| [16] | 邹丽宜, 吴 铁, 刘钰翰. 红苓肝宝抗小鼠肝纤维化作用研究[J]. 时珍国医国药, 2001,12(1): 7-10. |
| [17] | 武 松, 叶冬青. 多组单向有序资料的ridit分析在spss中的实现[J]. 中国卫生统计, 2006, 23(6): 554-555. |
| [18] | 许建明, 徐叔云, 张运芳, 等. 四氯化碳诱导小鼠肝纤维化模型的建立[J]. 中国药理学通报, 2000, 16(3): 339-341. |
| [19] | 张 硕, 洪 波, 王庆林, 等. 4种黄酮类化合物对四氯化碳致小鼠肝纤维化的防治作用[J]. 华西药学杂志, 2012, 27(2): 141-143. |
| [20] | Mounach A, Ouzzif Z, Wariaghli G, et al. Primary biliary cirrhosis and osteoporosis: a case-control study[J]. J Bone Min Metabol, 2008, 26(4): 379-384. |
| [21] | 段雪飞, 范小玲. 慢性肝病与骨质疏松症[J]. 世界华人消化杂志, 2010, 18(27): 2841-2845. |
| [22] | 王 翔, 薛雁山. 肝硬化性骨质疏松症及其ct评价研究[J]. 国际医学放射学杂志, 2009, 32(5): 457-462. |
| [23] | 吕国良. 肝病相关性骨质疏松症[J]. 新医学, 2007, 38(1): 13-14. |
| [24] | Gasser R W. Cholestasis and metabolic bone disease-a clinical review[J]. Wien Med Wochenschr, 2008, 158(19/20): 553-557. |
| [25] | Cijevschi C, Mihai C, Zbranca E, et al. Osteoporosis in liver cirrhosis.[J]. Roman J Gastroenterol, 2005, 14(4): 337-341. |
| [26] | Gonzalez-Calvin J L, Gallego-Rojo F, Fernandez-Perez R, et al. Osteoporosis, mineral metabolism, and serum soluble tumor necrosis factor receptor p55 in viral cirrhosis[J]. J Clin Endocrinol Metab, 2004, 89(9): 4325-4330. |
| [27] | Guichelaar M M, Malinchoc M, Sibonga J, et al. Bone metabolism in advanced cholestatic liver disease: Analysis by bone histomorphometry[J]. Hepatology, 2002, 36(4 pt 1): 895-903. |
| [28] | 刘 浩, 时昭红, 胡 伟, 等. 银杏叶提取物与秋水仙碱对大鼠肝纤维化预防作用的比较[J]. 胃肠病学和肝病学杂志, 2010, 19(3):234-237. |
| [29] | 张前军, 于海林, 李传宽, 等. 饿蚂蝗对CCl4致急性肝损伤小鼠保护作用研究[J]. 中成药, 2011, 33(11): 1993-1995. |
| [30] | 杨 光, 张 燕. 骨质疏松骨代谢标志物研究进展[J]. 广州医药, 2006, 37(1): 8-10. |
| [31] | 肖 恩, 孟 萍. 骨质疏松骨代谢生化指标的研究进展[J]. 中国骨质疏松杂志, 2008, 14(3): 212-216, 147. |
| [32] | 李盛华, 刘忠何. 骨质疏松症的生化指标研究进展[J]. 甘肃中医, 2004, 17(11): 46-48. |
| [33] | 余小虎. 肝硬化性骨质疏松研究进展[J]. 国外医学: 消化系疾病分册, 2003, 23(2): 111-113. |
| [34] | 冯 坤, 刘月桂, 张灵菊, 等. 高转换型骨质疏松模型的生化特点[J]. 中国骨质疏松杂志, 1997, 3(2): 25-27.何海浪, 王素伟, 王建钧. 骨代谢生化指标与骨质疏松关系的研究[J]. 中国卫生产业, 2011, 8(24): 114-115. |
| [35] | 何海浪, 王素伟, 王建钧. 骨代谢生化指标与骨质疏松关系的研究[J]. 中国卫生产业, 2011, 8(24): 114-115. |
 2016, Vol. 47
2016, Vol. 47


