2. 昆明医科大学海源学院, 云南 昆明 651700;
3. 吉林大学基础医学院, 吉林 长春 130021
2. Haiyuan College, Kunming Medical University, Kunming 651700, China;
3. College of Basic Medical Sciences, Jilin University, Changchun 130021, China
心肌缺血再灌注损伤(myocardial ischemiar repefusion injury, MIRI)是心脏缺血性疾病、心脏手术和器官移植中常见的一种病理性损伤,是影响心功能恢复的重要因素[1]。人参作为名贵的药用植物,不论用于临床治疗各种疾病维护人类健康,还是用于养生保健提高人体素质,都具有强大的疗效,显示了其综合利用价值[2, 3, 4, 5]。人参总皂苷按单体皂苷皂苷元所含羟基量不同分为人参二醇皂苷(panaxadiolsaponin,PDS)和人参三醇皂苷(panaxtrol saponin,PTS)两大类[6]。PTS作为人参中最重要的一类生理活性物质,已应用于心血管系统诸多方面的治疗,效果显著[7],本实验采用结扎冠状动脉左前降支的方法复制MIRI模型,观察PTS对MIRI大鼠心肌的影响,探讨其作用机制。
1 材料 1.1 动物Wistar大鼠100只,体质量220~250g,雌雄各半,由吉林大学实验动物中心提供。合格证号SCXK-(吉)2007-0003。
1.2 药物与试剂PTS,从人参茎叶中提取纯化所得,是以20(S)-原人参三醇为苷元的人参皂苷,主要包含单体成分人参皂苷Re、Rf、Rg1、Rg2、Rh1等,其质量分数>85%,由吉林大学化学院天然药物化学教研室提供;生脉注射液(SM),华西医科大学制药厂,批号050416;戊巴比妥钠,北京化学试剂公司;肌酸激酶同工酶(CK-MB)试剂盒,南京建成生物工程研究所;心肌肌钙蛋白I(cTnI)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)ELISA试剂盒,上海西塘生物科技有限公司;PCR试剂盒,美国罗氏试剂公司。
1.3 仪器JEM-1200EX型透射电子显微镜,日本日立电子公司;数据采集系统Powerlab,澳大利亚埃德公司;HX-300动物呼吸机,成都泰盟科技有限公司;EOS88O型半自动生化分析仪(意大利);RT-6000型酶标分析仪,深圳雷杜生命科学股份有限公司;SSW型电热恒温水槽,上海博迅实业有限公司;DT5-3型离心机,北京时代北利离心机有限公司。
2 方法 2.1 大鼠MIRI模型的制备大鼠ip3%戊巴比妥钠(30mg/kg)麻醉,背位固定手术台上,记录正常心电图。胸部去毛消毒后,荷包穿线待用,无创性气管插管,自左侧3~4肋间钝性分离肌层,打开胸腔,剪开心包,轻压右侧胸廓挤出心脏。迅速穿线结扎冠状动脉左前降支(LAD)后将心脏送回胸腔,假手术组只穿线不结扎。挤出胸腔内空气和血液快速关闭胸腔,观察心电图变化,以ST段抬高或下降0.1 mV为结扎成功标志,缺血30 min后开胸,松解缝合线实现血流再灌,记录再灌后30 min心电图变化。荷包缝合,再灌注24 h后取材测定各项指标。
2.2 动物分组及给药将120只Wistar大鼠随机分成6组,每组20只。假手术组和模型组(生理盐水2 mL/kg);阳性药组(SM 450 mg/kg);PTS低、中、高剂量组(22.5、45、90 mg/kg),分别于造模前ip给药,连续7 d。
2.3 指标观察 2.3.1 心电图ST段的测量大鼠固定后,于四肢皮下插入针型电极连接数据采集系统Powerlab,连续心电监测,并依次记录结扎前,缺血5、30 min和再灌注5、30、60 min时II导联心电图(定标1 mV/DIV)。
2.3.2 血清CK-MB、cTnI、IL-6、TNF-α水平的测定再灌注24 h后进行腹主动脉取血,3 000 r/min离心10 min,取血清分别按CK-MB、cTnI及IL-6、TNF-αELISA试剂盒说明书操作,检测血清中CK-MB、cTnI和IL-6、TNF-α水平。
2.3.3 心肌梗死面积测定实验结束后将大鼠心脏迅速剪下,冲洗干净后沿冠状沟切除右心室,留取左心室称质量。沿心尖到心基部方向平行在结扎线以下将心室切成5片,放入1% TTC染液中,37℃孵育15 min。非梗死心肌为深红色,梗死心肌呈白色,通过BI-2000医学图像分析系统计算梗死区面积和左心面积,求算心肌梗死面积比例(心肌梗死面积比例=梗死区面积/左心面积)。
2.3.4 HE染色及病理形态学观察取大鼠缺血中央区域部分心肌放入10%中性福尔马林固定液中,常规制片,HE染色,光镜下观察心肌细胞结构及病理改变。
2.3.5 心肌细胞超微结构的观察实验结束后,取下心脏,取一小块梗死区心肌组织,放入4%戊二醛中固定,常规透射电镜样品制备,JEM-1200EX型透射电子显微镜下观察心肌细胞超微结构的改变。
2.3.6 实时定量PCR检测心肌组织Nrf2和血红素氧合酶(HO-1)mRNA表达采用Trizol法提取心肌总RNA,建立cDNA合成体系:5×AMV Buffer 2.0 μL、dNTP Mixture 2.0 μL、AMV 1.0 μL、Oligo dT 1.0 μL、RNase Inhibitor 1.0 μL、总RNA 13 μL(2 μg),42℃逆转录反应1 h,75℃、10 min灭活AMV。PCR反应使用Roche公司的SYBR Green PCR试剂盒,引物如下:Nrf2上游引物5’-CGGCATTTCACTGAACAAGT-3’,下游引物5’-TGGGTCTCCGTAAATGGAAGA-3’;HO-1上游引物5’-GCGAAACAAGCAGAACCCA-3’,下游引物5’-GCTCAGGATGAGTACCTCCCA-3’。以β-actin为内参,上游引物:5’-ACA TCCGTAAAGAC CTCTATGCCAAC-3’,下游引物:5’-GTGCTAGGA GCCAGGGCAGTAATCT-3’。
2.4 统计学方法采用SPSS 17.0 统计软件,数据以 x±s表示,采用t检验进行组间比较。
3 结果 3.1 对心电图ST段的影响与假手术组比较,模型组大鼠心电图ST段明显抬高(P<0.01);与模型组比较,PTS 45、90 mg/kg组及阳性药组均能抑制ST段抬高(P<0.05、0.01),PTS 22.5 mg/kg组无明显影响,结果见表 1。
| 表 1 PTS作用后MIRI大鼠心电图ST段变化 Table 1 Changes of ST-T of ECG in MIRI rats after treated with PTS |
与假手术组比较,模型组大鼠血清中CK-MB、cTnI及IL-6、TNF-α水平明显增加,差异显著(P<0.05、0.001);与模型组比较,PTS 45 mg/kg组大鼠血清CK-MB、cTnI及TNF-α水平显著降低(P<0.05);阳性药与PTS 90 mg/kg组CK-MB、cTnI、IL-6、TNF-α水平均显著降低(P<0.05、0.01)。与模型组比较,PTS 45、90 mg/kg组均能显著降低MIRI大鼠心肌梗死面积比例(P<0.05、0.01);PTS 22.5 mg/kg组对以上指标均无显著影响,结果见表 2。
| 表 2 PTS对MIRI大鼠血清CK-MB、cTnI、IL-6、TNF-α水平及梗死面积比例的影响 Table 2 Effects of PTS on contents of CK-MB,cTnI,IL-6,TNF-α, and myocardial infarction size of MIRI rats |
模型组心肌间质水肿明显,心肌细胞大片坏死,核消失,胞浆红染,坏死细胞周围大量中性粒细胞浸润,肌丝断裂,肌纤维被破坏。与模型组比较,阳性药组心肌间质水肿明显减轻,肌原纤维排列较整齐,有局部少量血管扩张充血,PTS 90 mg/kg组心肌间质水肿明显减轻,肌原纤维排列整齐,偶见炎细胞浸润及小病灶坏死。PTS 45 mg/kg组可见心肌间质轻度水肿,肌原纤维排列局部整齐,心肌细胞小片坏死。结果见图 1。
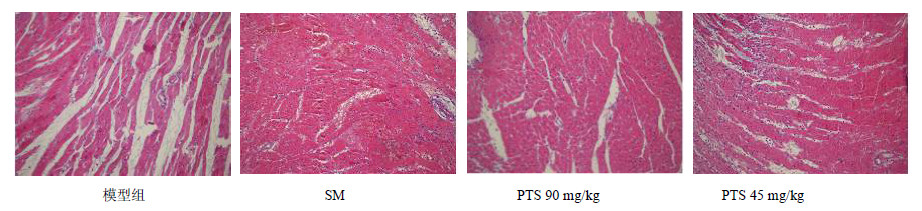 | 图 1 PTS对MIRI大鼠心肌组织病理变化的影响 Fig.1 Effect of PTS on pathological changes of myocardial tissue in MIRI rats |
模型组心肌细胞超微结构呈现明显的梗死现象:胞质内肌节呈高度收缩状,肌丝排列紊乱,出现断裂、溶失,线粒体有溶解,基质空化。阳性药组:肌膜完整,肌丝排列整齐,肌节明暗带清析可见,线粒体纵行排列于肌丝束之间,结构基本完整。PTS 90 mg/kg组与模型组比较,结构改变呈明显好转趋势:肌膜基本完整,肌丝排列较整齐,肌节各带清晰,线粒体基本完整,核清析可见呈椭圆形,核内异染色质少,靠核膜排列,常染色质多。PTS 45 mg/kg组:肌节结构可辩,线粒体增加。结果表明PTS 90 mg/kg组在改善心肌细胞超微结构的损伤程度上较PTS 45 mg/kg组明显。结果见图 2。
 | 图 2 PTS对MIRI大鼠心肌超微结构的影响 Fig.2 Effect of PTS on myocardial ultrastructure of MIRI rats |
模型组Nrf2和HO-1 mRNA水平较假手术组明显下降(P<0.05),PTS 45 mg/kg组mRNA水平明显升高,分别为模型组的3.62和5.43倍(P<0.05),PTS 90 mg/kg组,分别为模型组的4.47和8.5倍(P<0.01),2组均差异显著。结果见图 3。
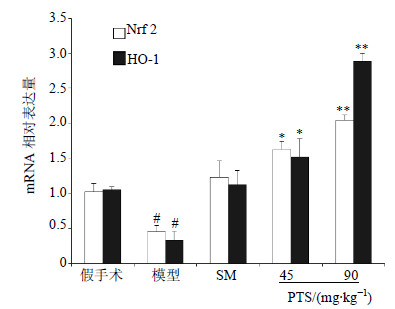 | 图 3 PTS对心肌细胞Nrf2和HO-1基因表达的影响 Fig.3 Effect of PTS on expression of Nrf2 and HO-1 gene in myocardial cells of MIRI rats |
MIRI是指心肌经受较长时间缺血后得到血液灌注,损伤加重,甚至将可逆性损伤转为不可逆性损伤[8]。陈龙等[9]的研究表明,适宜浓度人参皂苷通过降低离体大鼠心肌缺血再灌注后丙二醛(MDA)水平,对抗心肌细胞膜脂质过氧化,减轻心肌细胞膜损伤,恢复心功能,从而增强对心肌的保护作用。赵春燕等[10]培养新生Wistar大鼠的心室肌细胞,向培养基中加入PTS皂苷单体人参皂苷Rg1、Rg2、Re、Rh1、Rf,结果显示,除人参皂苷Rf外,其余PTS型皂苷均使心肌细胞呈现自发性搏动的群落数及心肌细胞动作电位各参数减少,动作电位的发放频率加快。提示PTS型人参皂苷Rg1、Rg2、Re、Rh1具有钙通道阻滞作用。人参皂苷Rg2也参与抗心肌细胞凋亡的过程,对MIRI细胞凋亡有保护作用[11]。
一直以来,在临床上对心绞痛、心肌炎以及心肌梗死等心肌损伤性疾病的诊断都是依赖于患者血清心肌酶谱,尤其是将CK-MB的浓度高低作为主要的判定指标[12]。随着医学水平的不断提高,科学技术的进步,将化学发光技术引入到心肌损伤性的检测中来也已经被广为关注,cTnI检测在心肌损伤诊断中已经起到核心作用,成为心肌损伤诊断中最为特异的血清标志物之一,在临床诊断中被广泛应用。本研究结果表明,PTS能显著降低MIRI模型大鼠血清CK-MB、cTnI水平。
MIRI是一个多机制参与、多因素相互影响而导致的复杂的病理生理过程。近年来,大量研究表明,炎症反应也参与了MIRI的形成[13]。心肌缺血时即激发炎症反应,再灌注加强了炎症反应[14]。炎症介质在心肌细胞缺氧损伤的过程中发挥着重要的作用[15]。MIRI激活了中性粒细胞、单核细胞等炎性细胞释放白细胞介素-1(IL-1)、IL-6、白细胞介素-8(IL-8)和TNF-α,大量产生的IL-6、TNF-α等前炎症因子通过相应的受体,促进前炎症因子的生成,形成恶性循环,加重心肌损伤[16]。IL-6是慢性炎症的关键介质,被称为白介素家族的核心成员,参与了炎症反应的调节[17]。TNF-α也是一种重要的炎症因子,研究发现MIRI过程中心肌细胞和巨噬细胞迅速释放出的大量TNF-α,增加表达的TNF-α可以通过多种途径影响心肌功能并造成心肌损伤[18]。这些递质升高又刺激中性粒细胞表面黏附分子的表达,诱导了中性粒细胞的黏附、内皮迁移以及向缺血再灌注区域的浸润,加速细胞之间的黏附和血管内凝血,引起心肌细胞坏死、凋亡等,加重MIRI的损伤[19, 20]。细胞因子参与了MIRI过程,炎症细胞因子的增高是反映急性心肌梗死微循环再灌注不良的标志[21]。抑制MIRI大鼠血清中炎症因子堆积,可以达到保护心肌的作用[22]。本实验结果表明,PTS能降低MIRI大鼠血清中炎症因子IL-6和TNF-α水平,通过降低心肌组织的炎性反应减轻心肌损伤。
HO-1是细胞内一种重要的抗氧化酶,属应激蛋白,在机体应激状态下呈现适应性表达,发挥抗损伤作用。近年来的研究发现,HO-1还具有抗炎作用,持续表达HO-1的血管内皮细胞能够降低血清饥饿对细胞造成的炎性损伤和细胞凋亡[23, 24]。Nrf2是结合抗氧化剂反应元件(ARE)的基本转录因子,Nrf2从细胞浆转位到细胞核和其他同源转录因子结合,共同激活ARE。为了探讨PTS对MIRI的保护机制,采用实时定量PCR方法,分析PTS在MIRI过程中转录因子Nrf2及其调控靶基因HO-1的mRNA 水平的变化。结果表明,模型组的Nrf2和HO-1的转录水平均低于假手术组。应激状态下Nrf2/HO-1表达应该增强,本研究的结果却相反,推测可能与缺血再灌注后的观察时间有关。PTS能够增强Nrf2/HO-1转录,且具有剂量依赖性,表明PTS的心肌保护作用可能是通过激活Nrf2/HO-1信号转导途径参与心肌组织抗氧化和抗炎作用。
综上所述,本实验从炎症细胞因子、心肌酶学及形态学多角度对MIRI进行观察,PTS能抑制MIRI大鼠血清中炎症因子堆积,降低血清中心肌酶的活性,减轻心肌细胞的损伤,对MIRI心肌具有保护作用,其机制可能与激活Nrf2/HO-1信号转导途径有关。
| [1] | Hausenloy D J, Baxter G, Bell R, et al. Translating novel strategies for cardioprotection: the Hatter Workshop Recommendations [J]. Basic Res Cardiol, 2010, 105(6): 677-686. |
| [2] | 唐伟卓, 赵余庆. 原人参三醇及其衍生物的药学及其生物活性的研究进展 [J]. 人参研究, 2010, 22(3): 20-26. |
| [3] | 王 琼, 王 逸, 韩春勇, 等. 人参皂苷Rg1、Rb1及其代谢产物益智作用的研究进展 [J]. 中草药, 2014, 45(13): 1960-1965. |
| [4] | 张昌静, 庄成乐, 陈伟哲, 等. 人参皂苷Rb1对术后疲劳综合征老年大鼠海马神经营养因子的影响 [J]. 中草药, 2014, 45(6): 813-818. |
| [5] | 陈琳琳, 贾韦国, 苏 华, 等. 人参用于治疗勃起功能障碍的最新机制及临床研究 [J]. 现代药物与临床, 2010, 25(2): 116-120. |
| [6] | 牛泱平, 陈小红, 宋必卫, 等. 人参二醇、三醇皂苷对小鼠骨髓造血干/祖细胞体外增殖的影响 [J]. 中国药理学通报, 2004, 20(11): 1316-1317. |
| [7] | 许明荣, 王 密, 杨 柯, 等. 人参二醇组皂甙、三醇组皂甙对游泳训练大鼠细胞免疫的影响 [J]. 武汉体育学院学报, 2001, 35(4): 48-52. |
| [8] | Elsasser A, Vogt A M, Nef H, et al. Human hibernating-myocardium is jeopardized by apoptoticand autophagic cell death [J]. Jam coll Cardiol, 2004, 43(12): 2191-2199. |
| [9] | 陈 龙, 张宝仁, 郭卫星. 人参皂甙增强心脏停搏对离体大鼠心肌的保护作用 [J]. 第二军医大学学报, 1992, 13(6): 527-537. |
| [10] | 赵春燕, 陈 龙, 齐 晖. 人参三醇组皂甙单体对培养心肌细胞自发性搏动与动作电位的影响 [J]. 长春中医学院学报, 1997, 13(62): 52-53. |
| [11] | 田建明, 郑淑秋, 郭伟芳, 等. 人参皂苷Rg2对大鼠心肌缺血再灌注损伤诱发心肌细胞凋亡的保护作用 [J]. 中国药理学通报, 2004, 20(4): 480. |
| [12] | 郭庆军, 王桂敏, 张秀秀, 等. 淫羊藿苷预处理对心肌缺血再灌注损伤炎症反应的影响 [J]. 中国病理生理杂志, 2013, 29(11): 2034-2038. |
| [13] | Van Waes C. Nuclear factor-kappa B in development, prevention, and therapy of cancer [J]. Clin Cancer Res, 2007, 13(4): 1076-1082. |
| [14] | Frangogiannis N G, Smith C W, Entman M L. The infarmmatory response in myocardial infarction [J]. Cardiovasc Res, 2002, 53(1): 31-47. |
| [15] | Wigmore S J, Fearon K C, Maingay J P, et al. Interleukine-8 can mediate acute phase protein production by isolated human hepatocytes [J]. Am J Physiol, 1997, 273 (4 Pt 1): 720-726. |
| [16] | 杨 锐, 王芬珍, 吴黎明. NF-κB与心机缺血再灌注损伤 [J]. 心血管康复医学杂志, 2006, 15(2): 193-195. |
| [17] | 王 涛, 浦 奎, 孔德领, 等. 辛伐他汀对大鼠心肌缺梗死后TNF-α、IL-6表达及心室重构的干预研究 [J]. 天津医药, 2009, 37(7): 585-588. |
| [18] | Communal C, Sumandea M, Solaro J R, et al. Functional consequences of apoptosis in cardiac myocytes [J]. Proc Natl Acad Sci USA, 2002, 99(9): 6252-6256. |
| [19] | 张 磊, 马 虹, 黄守坚, 等. 补体耗竭对MIRI的保护作用及其机制 [J]. 中华心血管病杂志, 2001, 29(6): 365-368. |
| [20] | 李志强, 常红娟, 孙士润, 等. 心肌钙蛋白I与急性脑梗死患者心肌损害及预后关系的研究 [J]. 世界中西医结合杂志, 2013, 8(7): 683-686. |
| [21] | 李拥军, 丁文惠, 高 炜, 等. 炎性相关细胞因子和心肌梗死微循环再灌注状态的关系 [J]. 中华内科杂志, 2004, 43(2): 102-105. |
| [22] | 谢利平, 杨 帆, 刘 振, 等. 左旋四氢巴马汀对心肌缺血再灌注损伤的作用及机制研究[J]. 中国病理生理杂志, 2010, 26(10): 1996. |
| [23] | Mylroie H, Dumont O, Bauer A, et al, PKCε-CREB-Nrf2 signalling induces HO-1 in the vascular endothelium and enhances resistance to inflammation and apoptosis [J]. J Cardiovasc Pharmacol Ther, 2015, 20(4): 428-438. |
| [24] | Hamdulay S S, Wang B, Birdsey G M, et al, Celecoxib activates PI-3K/Akt and mitochondrial redox signaling to enhance heme oxygenase-1-mediated anti-inflammatory activity in vascular endothelium [J]. Free Radic Biol Med, 2010, 48(8): 1013-1023. |
 2016, Vol. 47
2016, Vol. 47


