2. 甘肃中医药大学, 甘肃 兰州 730000
2. Gansu University of Chinese Medicine, Lanzhou 730000, China
甘草为豆科(Fabaceae)甘草属Glycyrrhiza L.植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflata Bat. 或光果甘草Glycyrrhiza glabra L. 的干燥根及根茎[1],别名甜草根、红甘草、国老等,有调节机体免疫功能[2]、抗菌、抗炎、抗病毒、抗氧化之功效。其主要化学成分有甘草酸、甘草甜素、甘草次酸(glycyrrhetinic acid,GA)、甘草皂苷、甘草苷元、异甘草苷、异甘草苷元及甘草利酮、刺芒柄黄花素、甘草素等。其中,GA对致癌性的病毒如肝炎病毒及艾滋病病毒均有抑制作用[3],临床上常用来治疗慢性肝炎及肝癌。GA在水中溶解度小,平衡溶解度仅为6.32 mg/mL,油水分配系数P=48 978(lgP 4.69),口服基本不吸收,普通注射剂的生物利用度低,严重影响其临床疗效的充分发挥[4, 5]。
囊泡主要有脂质囊泡与类脂囊泡(niosomes,NI),类脂囊泡由非离子型表面活性剂自组装形成,具有闭合的双分子膜结构,又称为非离子表面活性剂囊泡(non-ionic surfactant-based elastic vesicle),是第2代柔性囊泡。与脂质囊泡一样具有组织相容性和细胞透过性,但不像脂质囊泡易受氧化或水解,也不易泄漏药物。药物被聚合物囊泡包封后,可以起到增效、减毒、缓释、增加药物稳定性和靶向性等作用[6]。类脂囊泡还具有稳定性高、成本低、表面活性剂类型多且易得[7]等优点。通过类脂囊泡制备技术,GA在包封的状态下,可以增加药物的溶解性,改变其体内分布以提高靶向性。本实验以单因素实验联合星点设计响应面法对GA类脂囊泡(GA-NI)的制备方法及处方进行了初步筛选。
1 仪器与材料Zetasizer Nano 3600激光动态散射仪,英国Malvern公司;TECNAI2 G2 F30透射电子显微镜,荷兰Phlips-FEI公司;RE-3000旋转蒸发器,上海亚荣生化仪器厂;UV-1800紫外分光光度仪,Shimadzu公司;HJ-6多头磁力搅拌器,巩义市予华仪器有限责任公司;SB-3200D超声波清洗机,宁波新芝生物科技股份有限公司;CP225D电子天平,德国赛多利斯公司。
GA样品(批号BW20121209Q),质量分数98%,西安富捷药业有限责任公司;GA对照品,质量分数为98.5%,批号110723-201413,中国食品药品检定研究院;司盘60(批号201304291)、司盘80(批号201305151)、聚山梨酯80(批号201302151),成都艾科达化学试剂有限公司;胆固醇,国药集团化学试剂有限公司,批号20120329;透析袋,截留相对分子质量8 000~14 000,北京博奥拓达科技有限公司;水为超纯水;其余试剂均为分析纯。
2 方法与结果 2.1 GA-NI的制备以非离子表面活性剂和胆固醇为囊材,采用薄膜分散-超声法制备GA-NI,即先称取适量的GA,非离子表面活性剂与胆固醇分别溶于氯仿-乙醇(4∶1)混合液中,加入圆底烧瓶中,减压蒸发至瓶内壁上形成均匀透明一层薄膜,加入一定量的超纯水,使薄膜溶胀水合后超声40 min,即得乳白色的GA-NI混悬液。
2.2 分析方法的建立 2.2.1 对照品溶液的制备精密称取GA对照品2.0 mg,置于100 mL量瓶中,用甲醇溶解并定容至刻度。
2.2.2 供试品溶液的制备按“2.1”项下方法制备质量浓度为1 mg/mL的GA-NI混悬液,精密吸取1 mL的GA-NI混悬液,置于10 mL量瓶中,加入15%乙醇定容至刻度,即得供试品溶液。
2.2.3 波长的确定取“2.2.1”项下对照品溶液与“2.1”项下制备工艺制备的不含药物的空白囊泡溶液,经破乳处理,采用紫外分光光度法,在200~400 nm波长扫描。结果显示,对照品最大吸收波长为250 nm,空白囊泡的辅料及溶剂在250 nm处无吸收,表明该波长处对药物的检测无干扰,故可以选择250 nm为GA-NI的测定吸收波长。
2.2.4 线性关系的考察精密称取GA对照品16.0 mg,用甲醇定容至1 000 mL,配成16 μg/mL的母液,用甲醇稀释成质量浓度分别为0.4、0.8、2.0、4.0、8.0、16.0 μg/mL的系列对照品溶液。在波长250 nm下,测吸光度(A)值,并以A值对质量浓度(C)进行线性回归,得回归方程:A=0.019 2 C+0.066 1,r=0.996,表明GA在0.4~16 μg/mL与A值呈良好的线性关系。
2.2.5 精密度试验分别取“2.2.4”项下低、中、高(0.4、8.0、16.0 μg/mL)3个质量浓度的GA对照品溶液3 mL,平行取样6份,在波长250 nm处测定,每天测6次,连续测定6 d,计算日内与日间精密度。结果显示,低、中、高3个质量浓度的日内、日间精密度的RSD分别为0.31%、0.54%、0.81%和0.92%、1.34%、1.58%,表明紫外分光光度法测定GA,其精密度符合方法学要求。
2.2.6 稳定性试验取“2.2.2”项下质量浓度为1 mg/mL的供试品溶液1份,在250 nm波长处,分别于0、4、8、12、18、24 h进行测定,其RSD为1.41%,结果表明,供试品溶液在常温条件下24 h内稳定。
2.2.7 重复性试验取“2.2.2”项下同一批次供试品溶液6份,按“2.2.4”项下方法测定,记录A值,GA-NI的RSD为1.36%,说明该方法重复性良好。
2.2.8 回收率试验分别吸取20 mL的空白囊泡溶液6份,置于20 mL量瓶中,分别加入GA对照品20 mg,超声即得样品溶液,计算其回收率,结果平均回收率为97.43%,RSD为1.12%。
2.3 包封率的测定采用反透析法测定包封率,精密量取3 mL的GA-NI溶液,置于100 mL量瓶中,用95%乙醇定容至100 mL,转移至锥形瓶中。再量取95%乙醇6 mL,置于已处理的透析袋中,两端扎紧,室温下磁力搅拌。在8 h时吸取透析袋内的透析液,测定其质量浓度,计算游离药物的质量(m1),按公式计算包封率(包封率=1-m1/m,其中m为药物的总量)。
2.4 预实验 2.4.1 反透析时间的确定精密量取3 mL的GA-NI溶液,置于100 mL量瓶中,用95%乙醇定容至100 mL,转移至锥形瓶中。再量取95%乙醇6 mL,置于已处理的透析袋中,两端扎紧,室温下磁力搅拌。在透析过程中,分别于1、2、4、6、8、10 h吸取透析袋内的透析液3 mL,测定其游离的药物质量浓度,同时在透析袋内补充3 mL 95%乙醇,结果包封率分别为7.61%、19.83%、35.57%、55.60%、80.90%、80.90%。采用反透析法在8 h时达到平衡,且在10 h内不发生渗漏现象。故本实验采用反透析法[8]测GA-Ni的包封率,选择8 h作为透析时间。
2.4.2 表面活性剂的确定固定GA质量浓度0.6 mg/mL,司盘60质量浓度0.1 mg/mL,司盘80质量浓度0.1 mg/mL,聚山梨酯80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,表面活性剂-胆固醇1∶1,GA-胆固醇1∶1,水-胆固醇2∶1,考察不同表面活性剂(司盘60,司盘80,聚山梨酯80,司盘60-聚山梨酯80 1∶2、2∶3、1∶1、3∶2、2∶1,司盘80-聚山梨酯80 1∶2、2∶3、1∶1、3∶2、2∶1)对GA-NI包封率的影响。结果包封率分别为49.17%、75.62%、66.80%、36.80%、21.81%、40.33%、22.69%、15.64%、4.17%、57.97%、30.63%、40.33%、12.10%。由此可知,司盘60作为表活制备的GA-NI包封率低,司盘80与聚山梨酯80制备的GA-NI的包封率接近,但司盘80制备的GA-Ni混悬液均匀且无白色沉淀。司盘60与聚山梨酯80的不同比例以及司盘80与聚山梨酯80的不同比例制备得到的GA-NI的包封率均比较低且形成的混悬液不均匀。故选择司盘80作为表面活性剂。
2.5 单因素考察 2.5.1 GA质量浓度固定司盘80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,胆固醇溶液-水1∶2,GA溶液-水1∶2,水合温度55 ℃,水合时间40 min,超声时间40 min,考察GA质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL对GA-NI包封率的影响。结果平均包封率分别为32.04%、75.67%、63.45%、39.89%、37.28%(n=3),结果表明GA质量浓度在0.2~1.0 mg/mL均能形成类脂囊泡,随着GA质量浓度的增大,包封率先增大后减小。静置24 h后,GA-NI的乳浊液无变化,稳定性好。本实验选择GA质量浓度为0.6 mg/mL。
2.5.2 司盘80溶液与胆固醇溶液的体积比固定GA质量浓度0.6 mg/mL,司盘80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,胆固醇溶液-水1∶2,GA溶液-水1∶2,考察司盘80溶液与胆固醇溶液的体积比分别为1∶3、1∶2、1∶1、2∶1、3∶1对GA-NI包封率的影响。结果GA平均包封率分别为50.36%、59.88%、69.41%、72.34%、62.08%(n=3)。结果表明司盘80溶液与胆固醇溶液的体积比在1∶3~3∶1均能形成类脂囊泡,随着二者体积比增大,包封率先增大后减小。静置24 h后,GA-NI的乳浊液无变化,稳定性好。司盘80溶液与胆固醇溶液的体积比以3∶2为中心点作为星点设计试验因素水平。
2.5.3 胆固醇溶液与水溶液的体积比固定GA质量浓度0.6 mg/mL,司盘80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,胆固醇溶液-水1∶2,GA溶液-水1∶2,水合温度55 ℃,水合时间40 min,超声时间40 min,考察胆固醇与水的体积比分别为1∶1、1∶2、1∶3、1∶4、1∶5对GA-NI包封率的影响。结果平均包封率分别为34.16%、64.28%、80.40%、65.74%、40.10%(n=3)。结果表明胆固醇溶液与水的体积比在1∶2~1∶5均能形成类脂囊泡,随着二者体积比增大,包封率先增大后减小;胆固醇溶液与水的体积比为1∶1时,在旋转蒸发过程中,圆底烧瓶瓶壁上的薄膜分散不均匀,水合后出现片状漂浮物,静置24 h后产生沉淀。本实验选择胆固醇溶液与水的体积比为1∶3。
2.5.4 水合温度固定GA质量浓度0.6 mg/mL,司盘80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,胆固醇溶液-水1∶2,GA溶液-水1∶2,水合时间40 min,超声时间40 min,考察水合温度分别为25、40、55、70 ℃对GA-NI包封率的影响。结果平均包封率分别为34.97%、48.89%、64.28%、73.07%(n=3)。结果表明水合温度在25~70 ℃均能形成类脂囊泡,随着水合温度升高,包封率呈增大趋势,静置24 h无变化。本实验选择水合温度以62.5 ℃为中心点作为星点设计因素水平。
2.5.5 水合时间固定GA质量浓度0.6 mg/mL,司盘80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,胆固醇溶液-水1∶2,GA溶液-水1∶2,水合温度55 ℃,超声时间40 min,考察水合时间分别为10、40、70、100、130 min对GA-NI包封率的影响。结果平均包封率分别为58.20%、84.06%、79.66%、60.87%、62.34%(n=3)。结果表明水合时间10 min形成的乳浊液不均匀、稳定。40~70 min均能形成类脂囊泡,随着水合时间增大,包封率呈减小趋势,静置24 h无变化。本实验选择水合时间以55 min为中心点作为星点设计因素水平。
2.5.6 超声时间固定GA质量浓度0.6 mg/mL,司盘80质量浓度0.1 mg/mL,胆固醇质量浓度0.1 mg/mL,胆固醇溶液-水1∶2,GA溶液-水1∶2,水合温度55 ℃,水合时间40 min,考察超声时间分别为20、40、60、80、100 min对GA-NI包封率的影响。结果平均包封率分别为58.20%、78.41%、91.39%、63.86%、79.80%(n=3)。结果表明超声时间40~60 min均能形成类脂囊泡,随着超声时间增大,包封率呈先增大后减小再增大趋势,静置24 h无变化。因100 min耗费时间且包封率不是最优,故本实验选择超声时间以50 min为中心点作为星点设计因素水平。
2.6 处方工艺优化综合单因素考察的结果,选取司盘80溶液与胆固醇溶液体积比(A)、水合温度(B)、水合时间(C)、超声时间(D)作为考察因素,根据单因素实验结果选取水平,以包封率为评价指标,采用星点设计-效应面法[9]优化实验,实验设计及结果见表 1。
| 表 1 实验设计及结果 Table 1 Design and results of experiment |
对实验结果进行方差分析,模型显著性检验P<0.01,其中,1次项自变量A、C、D,2次项AD、BC、BD、A2、B2、C2、D2显著(P<0.05),表明该模型具有统计学意义。失拟项P=0.252 2>0.05,说明无失拟因素存在,该模型可以用来代替真实的实验点结果进行分析;校正系数R2=0.989 9,变异系数为4.95%,表明该模型变异小,模型拟合优度好。
2.7.2 响应面回归分析结果以A、B、C、D为自变量,以包封率为因变量进行多元二次响应面回归分析,回归模型数据的分布见图 1。
 | 图 1 薄膜分散超声法回归模型数据点的分布图 Fig.1 Distribution of data points of regression model of thin film dispersion ultrasonic method |
由图 1可知,实验实测值和预测值分布线性明显,参数的正态分布基本在一条直线上,没有出现异常的数据点,说明可用来对此制备工艺研究进行分析和预测。回归方程为包封率=82.89+6.86 A-1.74 B-3.20 C+4.95 D+3.35 AB-0.48 AC-4.89 AD+2.93 BC+15.23 BD-1.98 CD-14.22 A2-8.89 B2-5.97 C2-2.48 D2,通过等高线和三维响应曲面分析A、B、C、D对包封率的影响情况,如图 2所示。
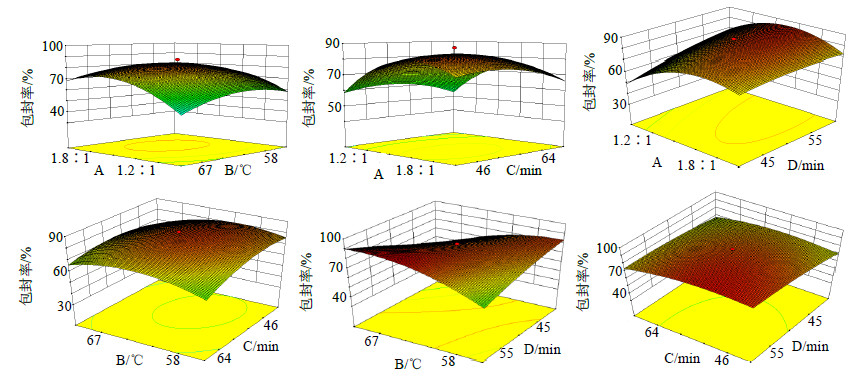 | 图 2 薄膜分散超声法中因素对包封率影响的响应面 Fig.2 Response surface of factors affecting EE of thin film dispersion ultrasonic method |
从图 2可以直观地看出2种因素相互作用,均能出现最优值,表明采用薄膜分散超声法在制备GA-NI时,4种因素对其包封率均影响较大。以包封率达到最高为选择条件,得到的最佳拟合方案只有1种:司盘80溶液-胆固醇溶液2∶1,水合温度69.35 ℃,水合时间51.19 min,超声时间60 min,包封率80.66%。
通过实验分析及结果,最终选择薄膜分散法制备GA-NI的最佳制备工艺为司盘80溶液-胆固醇溶液2∶1,水合温度为69.35 ℃,水合时间为51.19 min、超声时间为60 min,其预测包封率为80.66%。结合实际生产考虑,对各因素条件取整,确定最佳提取工艺为司盘80溶液-胆固醇溶液2∶1,水合温度为70 ℃、水合时间为51 min、超声时间为60 min。
2.8 形态观察取少量GA-NI混悬液,用15%乙醇稀释10倍,滴至有碳膜的铜网上,稍干后用滤纸吸干边缘混悬液于透射电子显微镜下观察GA-NI的形态。透射电镜照片见图 3。可见GA-NI呈圆形或类圆形、分布较均匀。
 | 图 3 囊泡的透射电镜图 (A) 和单个囊泡透射电镜图 (B) Fig.3 Transmission electron microscopy of vesicles (A) and a single vesicle (B) |
取适量GA-NI溶液,用激光粒度分析仪测定囊泡平均粒径为粒径200 nm,Zeta电位为(−25.1±3.4)mV,其粒径及Zeta电位图如图 4所示。
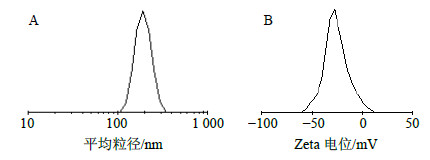 | 图 4 优化工艺制备的GA-NI粒径图 (A) 和Zeta电位图 (B) Fig.4 Diagram of size (A) and Zeta potential (B) in GA-NI prepared by optimization process |
将制备得到的GA-NI置于4 ℃与室温(温度范围为18~25 ℃)下保存,在0、24 h及15、30 d取样,观察GA-NI的外观形态。结果表明,低温4 ℃条件下,在24 h无变化,15 d出现分层的现象;室温条件下,0~30 d其外观无变化,仍为乳白色的均匀混悬液。因此,GA-NI可保存于室温条件下,以便用于后期实验制备类脂囊泡包裹的壳聚糖纳米粒。
3 结论非离子表面活性剂囊泡的制备方法有注入法、薄膜法、超声振荡法、逆向蒸发法、高压乳化法、反向蒸发法[10]等,其中薄膜分散超声法具有包封率最高,且制得的囊泡粒径小且均匀[11]的优点,因此,本实验采用薄膜分散超声法制备。其制备原理是将表面活性剂及脂溶性药物分别溶于有机溶剂中,然后再减压旋转下除去溶剂,使表面活性剂在器壁形成薄膜,水合一定时间后,超声减小粒径从而得到类脂囊泡。
类脂囊泡的包封率是评价药物传递系统的重要参数之一,类脂囊泡包封率的测定方法有葡聚糖凝胶柱色谱法、超速离心法、透析法等。凝胶柱分离样品时对样品的稀释性大、用时长,凝胶色谱不易使粒径较小的类脂囊泡与游离药物分离,且难溶于水的药物在介质中多以晶体形式存在,不适用于该方法[12]。超速离心法则是利用游离药物与类脂囊泡的重力差异进行分离,适用于亚微米级粒子,可用于样品浓缩。但该方法成本高,常需离心1 h以上,且各批样品间重现性差,药物的包封率低,原因可能是由于离心过程中速度过大一部分类脂囊泡或药物渗漏丢失[13]。而透析法需要较大量的透析液和较长的时间,并且不断需要更换透析液,还需要考虑透析膜对药物的吸附性[12]。而采用反透析法,透析袋内放入透析介质,囊泡周围的游离药物稀释倍数较小避免了动态平衡的破坏且透析袋价廉、节省成本[14]。本实验采用反透析法测定GA-NI的包封率,结果满意。且实验发现,表面活性剂与胆固醇的比例、水合温度、水合时间、超声时间对包封率也均有一定影响,这与相关研究结论基本一致[15]。本实验制得的类脂囊泡通过电镜观察,其形状规则近似球形,粒径200 nm,较理想。Zeta电位为(−25.1±3.4)mV,表明类脂囊泡表面带负电荷,这在一定程度上阻止了类脂囊泡的聚集[16],保证了混悬液的稳定性,显示优化工艺可行。
总之,本实验制备的GA-NS形态圆整、包封率稳定,为进一步制备类脂囊泡包裹的壳聚糖纳米粒及其他内容提供方法学和相关实验依据。
| [1] | 中国药典 [S]. 一部. 2015. |
| [2] | 周荣汉. 中药资源学 [M]. 北京: 中国医药科技出版社, 1993. |
| [3] | 包金凤, 吴勇杰. 甘草次酸药理作用的研究进展 [J]. 兰州医学院学报, 1994, 20(1): 50-52. |
| [4] | 郭波红, 程 怡, 林绿萍, 等. 甘草次酸平衡溶解度和表观油水分配系数的测定 [J]. 广东药学院学报, 2011, 27(3): 221-223. |
| [5] | 程 怡, 郭波红, 林绿萍. 甘草次酸脂质体的包封率测定和体外释放度考察 [J]. 广州中医药大学学报, 2010, 27(4): 384-388. |
| [6] | 张琳华, 何颖娜, 马桂蕾, 等. 叶酸靶向紫杉醇聚合物纳米囊泡的制备及其抗肿瘤活性研究 [J]. 中国药学杂志, 2010, 45(22): 1742-1748. |
| [7] | 魏颖慧, 陈苹苹, 李范珠, 等. 囊泡及微粒经皮给药系统的研究进展 [J]. 中国医药工业杂志, 2010, 41(3): 224-228. |
| [8] | 钟 萌, 杨 林, 黄开顺. 阿奇霉素囊泡的制备及处方考察 [J]. 中国抗生素杂志, 2013, 38(8): 614-617. |
| [9] | 靳士晓, 韩 晋, 靳世英, 等. 星点设计-效应面法优化甘草酸磷脂/胆盐混合胶束处方 [J]. 中国实验方剂学杂志, 2013, 19(9): 48-51. |
| [10] | 张群利, 崔琳琳, 陈春晟. 表面活性剂囊泡的应用研究进展 [J]. 安徽农业科学, 2014, 42(27): 9267-9268. |
| [11] | 陈洪轩, 徐志杰, 肖衍宇. 蛇床子素非离子囊泡的制备和质量评价 [J]. 中国医药工业杂志, 2011, 42(1): 33-36. |
| [12] | 李红茹, 李淑芬. 脂质体中药物包封率的测定方法 [J]. 药物分析杂志, 2007, 27(11): 1844-1848. |
| [13] | 叶兆伟, 承 伟. 脂质体包封率测定方法及影响因素 [J]. 中国生物制品学杂志, 2007, 20(10): 789-792. |
| [14] | 钟 萌, 尹华峰, 滕永真, 等. 反透析法测定阿奇霉素囊泡的包封率 [J]. 光谱实验室, 2012, 29(5): 2941-2943. |
| [15] | Wang Y Y, Liu T Q, Xu W W. Preparation of hollow polypyrrole nanospheres in niosome system [J]. Chem Res Chin Univ, 2013, 29(3): 607-610. |
| [16] | 吴艳丽, 赫宝华. 青光眼用葛根素柔性脂质体温敏凝胶的研究 [D]. 西安: 西北大学, 2015. |
 2016, Vol. 47
2016, Vol. 47


