2. 国家中医药管理局亚健康干预技术实验室, 湖南 长沙 410128 ;
3. 湖南植物功能成分利用协同创新中心, 湖南 长沙 410128 ;
4. 湖南农业大学园艺园林学院, 湖南 长沙 410128
2. State Key Laboratory of Sub-health Intervention Technology, State Administration of Traditional Chinese Medicine, Changsha 410128, China ;
3. Hunan Co-Innovation Center for Utilization of Botanical Functional Ingredients, Changsha 410128, China ;
4. College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128, China
炎症是指机体对感染、外来物质或其他原因所致损伤的应激反应,是一种十分常见而又重要的基本病理过程,体表的外伤感染和人体各个器官都会出现炎症。炎症反应是具有血管系统的活体组织对损伤因子产生的防御性反应,可以促进机体的恢复和自愈,但是当炎症反应时间过长,强度过大时,产生的各种有害物质如蛋白溶解酶、氧代谢产物等可直接损伤组织,造成机体损伤。所以清除致炎物的同时及时消除炎症反应才能有效保护机体[1]。
炎症可分为感染性炎症和非感染性炎症,产生感染性炎症的因子包括细菌、病毒、立克次体、支原体、真菌、螺旋体和寄生虫等生物病原体。在我国,治疗感染性炎症以抗生素为主,注重于杀菌而忽略了抗炎,同时导致了抗生素滥用。随着研究的深入,药食兼用植物(既能作药物又可当食物食用的植物)因其具有资源丰富,安全性高等特点开始进入人们的视线,已有报道表明某些药食兼用植物的活性成分具有较好的抑菌、抗炎功效[2-3]。金黄色葡萄球菌与大肠杆菌为常见致病菌[4-5],本文综合比较了常见药食兼用植物对其抑菌效果以及抗炎功效和作用机制,以期从中发现良好的抑菌、抗炎原料药和新的食品功能因子,为预防和治疗炎症提供新的选择。
1 常见药食兼用植物的抑菌活性成分自然界中有很多药食兼用植物具有抑菌功效,但抑菌强度和活性成分各不相同,其抑菌活性成分多为多酚类、多糖类、皂苷类、挥发油4类,药用植物中常见的抑菌活性成分生物碱、醌类等则相对较少,推测是由于其药性强而将其排除在食品之外。
1.1 多酚类多酚类物质在植物中广泛存在,包括黄酮类、酚酸类、鞣质类、花色苷类等,是大多数药食兼用植物的抑菌活性成分。表 1列出了常见药食兼用植物多酚类成分的抑菌研究情况。多酚类物质抑菌效果明显、范围广,对革兰阳性和阴性(G+和G−)菌均有抑制作用。
|
|
表 1 药食兼用植物多酚类物质抑菌活性及来源 Table 1 Antibacterial property of polyphenols and source of medicinal and edible plants |
1.2 植物多糖类
植物多糖类主要指聚合度超过10的多聚糖,多糖具有多种生物活性,是许多药用植物的功效来源。研究表明,药食兼用植物多糖的抑菌效果相对酚酸类较弱,某些多糖类对金黄色葡萄球菌(G+)抑制作用强一些,但总体差别不大。一般多糖类抑菌范围不广,通常是对某些特定的细菌或真菌有抑制作用(表 2)。
|
|
表 2 药食兼用植物多糖类抑菌活性及来源 Table 2 Antibacterial property of polysaccharides and source of medicinal and edible plants |
1.3 皂苷
皂苷是由皂苷元与糖构成的一类糖苷,广泛存在于自然界中,主要包括甾族皂苷和三萜皂苷,为植物的次生代谢产物,也是许多中药的活性成分,近年来受到人们的关注,但是在药食兼用植物中关于其抑菌性的报道相对较少。研究显示药食兼用植物皂苷类物质抑菌活性差别较大,对G+菌的抑菌能力略强于G−菌,其中,苦瓜皂苷的抑菌活性显著弱于其他来源的皂苷(表 3)。
|
|
表 3 药食兼用植物皂苷类抑菌活性及来源 Table 3 Antibacterial property of saponins and source of medicinal and edible plants |
1.4 挥发油类
植物的挥发性成分也称植物精油,是植物体内的次生代谢产物之一。挥发油是药食兼用植物中另一类活性成分,同时也是香精香料的重要组成部分。表 4列出了常见药食兼用植物挥发油类的抑菌研究情况。
|
|
表 4 药食兼用植物挥发油类抑菌活性及来源 Table 4 Antibacterial property of volatile oil and source of medicinal and edible plants |
2 常见药食兼用植物抑菌机制研究
根据细胞壁的组成成分,细菌分为G+菌和G−菌(图 1)。两类细菌的细胞壁结构显著不同,对活性成分的敏感性有较大差异。G+的细胞壁厚且密、主要成分为肽聚糖和磷酸壁,肽聚糖是许多抑菌物质作用靶点,如青霉素;G−菌的细胞壁疏松,肽聚糖薄,外层的脂多糖具有抗原性,是G−内毒素的主要成分。
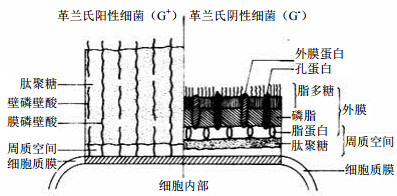
|
图 1 细菌细胞壁结构对比 Fig.1 Comparison on bacterial cell wall structures |
有研究表明药食兼用植物抑菌性与其强极性相关[27],以金黄色葡萄球菌和大肠杆菌为对照菌,基本上,抑菌活性多酚类>挥发油类>多糖类,佐证了该理论。皂苷类抑菌活性差异较大,药食兼用植物中关于其研究成果较少。药食兼用植物的抑菌成分对于G+和G−菌都有抑菌作用,大多数对细菌种类间的抑制作用有差异,说明抑菌成分作用于细菌细胞壁时具有选择性,同时也表明其抑菌方式多样。
进一步研究表明,多酚的抑菌机制主要是干扰细胞壁、细胞膜的形成,直接破坏细菌细胞壁、膜的结构,导致细胞通透性增加,进而使细胞内容物外泄[28-29];抑制细菌N-乙酰转移酶从而抑制细胞壁黏肽的生成[30];抑制细菌体内DNA、RNA的合成[31-32],因此多酚类对细菌具有一致的强抑菌活性。
多糖类抑菌方式尚不明确,主要可能的抑菌机制为(1)位点结合:多糖可与细菌细胞膜上的类脂、蛋白质复合物反应,改变细胞膜的通透性,或与细菌细胞壁形成一个负电荷环境,使细胞壁损伤[33]。(2)物理干扰:高相对分子质量的多糖溶于水使菌聚沉或吸附于菌体表面,导致其新陈代谢混乱[34-35],高相对分子质量多糖也可能通过分子链的卷曲缠结包埋细菌有效基因[36];若多糖降解,相对分子质量降低后可能穿过细胞壁进入细菌内部,干扰细菌正常生理活动[37]。可能由于G+菌的外表含有大量磷酸壁使得细菌带电负性,多糖改变了细胞壁的电位,因而影响较大。
皂苷的抑菌机制目前尚不明确,可能是(1)皂苷类作用于细菌诱导产生使其生物膜降解的酶,从而破坏生物膜的完整性[38-39];(2)抑制蛋白质的合成[38-39];(3)抑制细菌呼吸代谢[39]。植物精油抑菌机制有待研究,可能通过作用于细菌和真菌的生物膜,破坏膜结构,刺激细胞自溶[40]。植物所含的挥发油成分多样,其抑菌过程也可能存在协同或拮抗作用。
3 常见药食兼用植物抗炎活性成分及作用机制当细菌、真菌、病毒等入侵机体后引起机体免疫反应的炎症称为感染性炎症。通过抑菌可以起到消除炎症根源的效果,同时也应及时消除炎症产生的致炎因子才能全面恢复机体的健康。因此良好的抗感染炎症药物必须同时具有抑菌和抗炎作用才能防止炎症对身体的损伤,预防和治疗炎症。
近年来,随着药食兼用植物的深入研究,其天然的抗炎作用也越来越被重视。药食兼用植物抗炎活性成分以皂苷类和多酚类为主,在类别上较抑菌成分单一。表 5列出了常见药食兼用植物抗炎活性成分及作用机制。
|
|
表 5 药食兼用植物的抗炎活性成分及其作用机制 Table 5 Anti-inflammatory effect of medicinal and edible plants and its mechanism |
药食兼用植物抗炎机制主要是其活性成分进入人体后,通过调节炎性细胞因子和炎性介质或者直接作用于免疫系统起到预防和治疗炎症的作用。小分子活性物质抗炎的部分通路见图 2。
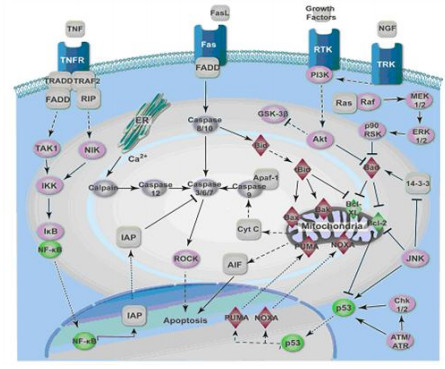
|
图 2 天然小分子抗炎途径 Fig.2 Anti-inflammatory pathway of natural small molecules |
4 临床应用
药食兼用的植物成分复杂,多不以单一成分起作用。目前,临床上应用较多的药食兼用植物在抗炎方面的特异性不强,常用于系统性抗炎。广泛应用于临床治疗感染性炎症的药食兼用植物见表 6。
|
|
表 6 药食兼用植物抗炎临床应用 Table 6 Anti-inflammatory effect of medicinal and edible plants in clinic |
5 结语与展望
近年来,随着中药抗感染性炎症的研究成为国内外研究热点,对于药食兼用植物的研究也越来越多。表 3显示,药食兼用植物对于呼吸系统、泌尿系统及胃肠道炎症有良好的治疗作用。但相对于体外研究其临床应用及治疗效果并不理想,除了炎症本身的复杂性外,绝大部分原因是由于药食兼用植物的研究还是比较浅显,尤其是分子和基因水平的相关研究。
由药食兼用植物抗炎机制可知,其抗炎主要与抑制炎性介质、调节炎性细胞因子、抑制NF-κB信号通路、抑制COX-2的表达相关,与非甾体类抗炎药有相似的靶点,但在安全性上远高于后者。合理利用甘草酸所具有的肾上腺皮质激素样作用也将显著减少甾体类抗炎药的使用量。
β-内酰胺类是最大的一类抗生素,作用于青霉素结合蛋白,抑制细菌细胞壁成分黏肽的合成,使细菌无法形成细胞壁[65],多酚类物质也有相似的作用方式。相对来说,多酚类物质虽然抑菌效果较弱,但抑菌方式、作用位点更多,并对G+和G−菌都敏感,有效地减少了细菌的耐药性。表 2表明,许多药食兼用植物多酚类还具有抗炎的效果且多酚类副作用少、广谱抑菌作用明显,可用于研制抗菌、抗炎药或抗菌、抗炎药的增效剂。
氯霉素、林可霉素类、大环内酯类、氨基酸糖苷类和四环素类抗生素作用于细菌的核糖体蛋白,抑制蛋白质的合成[65]。多黏菌素类改变膜分子的定向排列,使细胞膜的通透性增加[55]。药食兼用植物皂苷类、多糖类也有相似的作用效果,尽管作用机制尤其是分子水平的作用途径还不十分清楚,但可推测:多糖类是通过包埋有效基因,抑制蛋白质的合成,与细菌细胞膜上的物质反应改变其通透性;皂苷类可能是诱导细胞膜产生使其降解的酶,破坏细胞膜,其抑制蛋白质合成的作用途径还有待研究,同样的许多皂苷类也具有抗炎作用,值得开发利用。
我国长期把抗生素当作感染性炎症的抗炎药使用,其作用靶点单一,导致细菌或真菌易产生耐药性。若在临床应用上采用天然活性成分代替药物或与之联合使用可以显著减少抗生素药物的滥用。药食兼用植物可通过多途径、多环节发挥抗炎作用,某些植物间还具有协同作用,加强其相关研究也可以开发新的食品功能因子,有助于提升人体体质。用食品代替药品符合现代医学理念,也符合人们的养生观。
| [1] | 侯晓丽, 孙铭学, 高焕焕, 等. 抗炎天然产物活性成分研究进展[J]. 药学实践杂志 , 2015, 33 (1) :20–26. |
| [2] | 崔永明, 余龙江, 敖明章, 等. 甘草酸的提取及其抑菌活性研究[J]. 天然产物研究与开发 , 2006, 18 (3) :428–431. |
| [3] | Bello Y M, Odama L E, De N B. Studies on the antibacterial activity of the extract of Stachytarpheta angustifolia[J]. J Nanjing Med Univ , 2003, 17 (3) :424–424. |
| [4] | 胡永金, 韩小溪, 薛桥丽, 等. 普洱茶不同提取物体外抑菌活性研究[J]. 现代食品科技 , 2013, 29 (8) :1770–1773. |
| [5] | Vancraeynest D, Haesebrouck F, Hermans K. Multiplex PCR assay for the detection of high virulence rabbit Staphylococcus aureus strains[J]. Vet Microbiol , 2007, 121 (3/4) :368–372. |
| [6] | 张星海, 王岳飞. 茶多酚与绿原酸生物活性的比较研究[J]. 茶叶科学 , 2007, 27 (1) :39–44. |
| [7] | 袁胜浩, 卞金辉, 谢珍, 等. 大半边莲中酚酸类成分与抑菌活性研究[J]. 中成药 , 2013, 35 (1) :170–172. |
| [8] | 许维国, 刘洋, 刘多见, 等. 没食子酸抑菌活性分析[J]. 中国公共卫生 , 2012, 28 (10) :1329–1331. |
| [9] | 萧力争, 银霞, 刘素纯, 等. 二氢杨梅素抗菌活性研究[J]. 食品科技 , 2008, 33 (4) :140–143. |
| [10] | 林卓慧. 木犀草素抗菌活性研究[J]. 检验医学与临床 , 2009, 6 (12) :1022–1023. |
| [11] | 赵强, 董晓宁, 王国庆, 等. 芦丁金属配合物的制备及抑菌活性研究[J]. 中国酿造 , 2012, 31 (5) :50–52. |
| [12] | 王峰.绞股蓝多糖结构分析、抑菌性能及其应用研究[D].南宁:广西大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10593-1013372212.htm |
| [13] | 姚以才, 耿中华, 王乃馨, 等. 芦根多糖的超声辅助提取及其抗菌活性[J]. 食品科学 , 2011, 32 (14) :147–151. |
| [14] | 方芳, 张恒, 贾建波, 等. 7种美容中药水煎液的抑菌作用[J]. 江苏农业科学 , 2013, 41 (2) :265–268. |
| [15] | 薛淑静, 杨德, 李露, 等. 莲子红皮多糖抗氧化与抑菌活性研究[J]. 湖北农业科学 , 2015, 54 (24) :6342–6350. |
| [16] | 苏伟, 赵利, 刘建涛, 等. 黄精多糖抑菌及抗氧化性能研究[J]. 食品科学 , 2007, 28 (8) :55–57. |
| [17] | 李瑜, 周玉, 江冠民, 等. 枸杞多糖与黄芪多糖抑菌活性的研究[J]. 现代生物医学进展 , 2012, 12 (26) :5061–5063. |
| [18] | 杨晓杰, 董亚楠, 李娜, 等. 桔梗多糖的抑菌性和抗氧化性研究[J]. 食品研究与开发 , 2015, 36 (21) :12–14. |
| [19] | 孙延芳, 梁宗锁, 刘政, 等. 酸枣果三萜皂苷抑菌和抗氧化活性的研究[J]. 食品工业科技 , 2012, 36 (6) :139–142. |
| [20] | 耿丽晶, 周围, 张丽艳, 等. 苦瓜总皂甙最小抑菌浓度和最佳抑菌条件的研究[J]. 食品工业科技 , 2012, 33 (11) :79–82. |
| [21] | 郭媛.八角茴香精油的抗菌机理研究及其在冷却肉保鲜中的应用[D].上海:上海应用技术学院, 2012. http://cdmd.cnki.com.cn/article/cdmd-10259-1012040979.htm |
| [22] | 张赟彬, 郭媛, 江娟, 等. 八角茴香精油及其主要单体成分抑菌机理的研究[J]. 中国调味品 , 2011, 36 (2) :28–33. |
| [23] | 李巧巧, 雷激, 唐洁, 等. 商品柑橘精油的抑菌性及其应用研究[J]. 食品与机械 , 2011, 27 (6) :160–162. |
| [24] | 肖会敏, 何悦, 王四旺, 等. 连翘挥发油体外抑菌实验研究[J]. 内蒙古中医药 , 2011, 30 (15) :99–100. |
| [25] | 裕芳, 张妙玲, 黄自飞. 肉桂油的提取及其抑菌活性研究[J]. 天然产物研究与开发 , 2006, 18 (3) :432–434. |
| [26] | 吴海芬, 叶玉娣. 鱼腥草素抗菌活性的实验研究[J]. 中国中医药科技 , 2012, 19 (5) :418–419. |
| [27] | 刘敏, 周茜, 郝红伟, 等. 复方中草药提取物抑菌活性成分研究[J]. 食品与机械 , 2015, 31 (4) :159–161. |
| [28] | 周志娥, 罗秋水, 熊建华, 等. 绿原酸-异绿原酸A对大肠杆菌的抑菌机制[J]. 食品科技 , 2014, 39 (3) :228–231. |
| [29] | 黎继烈, 张慧, 王卫, 等. 金橘黄酮抑菌作用研究[J]. 食品与机械 , 2008, 24 (5) :38–41. |
| [30] | Jeong Y C, Jae H M, Keun H P. Isolation and identification of 3-methoxy-4-hydroxybenzoicacid and 3-methoxy-4-hydroxycinnamicacid from hot water extracts of Hovenia dulcis Thumb and confirmation of their antioxidative and antimicrobial activity[J]. Korean Food Sci Technol , 2000, 3 (2) :1403–1408. |
| [31] | Ulanowska K, Tkaczyk A, Konopa G, et al. Differential antibacterial activity of genistein arising from global inhibition of DNA, RNA and protein synthesis in some bacterial strains[J]. Arch Microbiol , 2006, 184 (5) :271–278. DOI:10.1007/s00203-005-0063-7 |
| [32] | Cassady J M, Baird W M, Chang C J. Natural products as a source of potential cancer chemotherapeutic and chemopreventive agents[J]. Nat Prod , 1990, 53 (1) :23–41. DOI:10.1021/np50067a003 |
| [33] | Young D H, Köhle H, Kauss H. Effect of chitosan on membrane permeability of suspension-cultured glycine max and phaseolus vulgaris cells[J]. Plant Physiol , 1982, 70 (5) :1449–1454. DOI:10.1104/pp.70.5.1449 |
| [34] | 高秀妹.四种植物多糖抑菌抗病毒作用及其对波氏杆菌免疫增强作用的比较研究[D].泰安:山东农业大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10434-1012487081.htm |
| [35] | Helander I M, Nurmiaho-Lassila E L, Ahvenainen R, et al. Chitosan disrupts the barrier properties of the outer membrane of gram-negative bacteria[J]. Int J Food Microbiol , 2001, 71 (2/3) :235–244. |
| [36] | Muzzarelli R A A, Jeuniaux C, Gooday G W. Chitin in Nature and Technology[M]. New York: Plenum Press, 1986 . |
| [37] | Sebti I, Martial-Gros A, Carnet-Pantiez A, et al. Chitosan polymer as bioactive coating and film against Aspergillus niger contamination[J]. J Food Sci , 2005, 70 (2) :M100–M104. DOI:10.1111/j.1365-2621.2005.tb07098.x |
| [38] | 郑春荣.三七总皂苷滴眼剂对兔眼毒性作用的研宄[D].昆明:昆明医科大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10678-1014344308.htm |
| [39] | 刘云宁, 李小凤, 班旭霞, 等. 中药抗菌成分及其抗菌机制的研究进展[J]. 环球中医药 , 2015, 8 (8) :1012–1017. |
| [40] | 王雪梅, 谌徽, 李雪姣, 等. 天然活性单萜-柠檬烯的抑菌性能研究[J]. 吉林农业大学学报 , 2010, 32 (1) :24–28. |
| [41] | Ohtsuki K, Abe Y, Shimoyama Y, et al. Separation of phospholipase A2 in Habu snake venom by glycyrrhizin (GL)-affinity column chromatography and identification of a GL-sensitive enzyme[J]. Biol Pharm Bull , 1998, 21 (6) :574–578. DOI:10.1248/bpb.21.574 |
| [42] | Kratschmar D V, Vuorinen A, Da Cunha T, et al. Characterization of activity and binding mode of glycyrrhetinic acid derivatives inhibiting 11β-hydroxysteroid dehydrogenase type 2[J]. Steroid Biochem Mol Biol , 2011, 125 (1) :129–142. |
| [43] | Kim J Y, Hwang Y P, Kim D H, et al. Inhibitory effect of the saponins derived from roots of Platycodon grandiflorum on carrageenan-induced inflammation[J]. Biosci Biotechnol Biochem , 2006, 70 (4) :858–864. DOI:10.1271/bbb.70.858 |
| [44] | Kim Y P, Lee E B, Kim S Y, et al. Inhibition of prostaglandin E2 production by platycodin D isolated from the root of Platycodon grandiflorum[J]. Planta Med , 2001, 67 (4) :362–364. DOI:10.1055/s-2001-14317 |
| [45] | Chung J W, Noh E J, Zhao H L, et al. Anti-inflammatory activity of prosapogenin methyl ester of platycodin D via nuclear factor-kappaB pathway inhibition[J]. Biol Pharm Bull , 2008, 31 (11) :2114–2120. DOI:10.1248/bpb.31.2114 |
| [46] | 张冬松, 高慧媛, 吴立军. 橙皮苷的药理活性研究进展[J]. 中国现代中药 , 2006, 8 (7) :25–27. |
| [47] | Sakata K, Hirose Y, Qiao Z, et al. Inhibition of inducible isoforms of cyclooxygenase and nitric oxide synthase by flavonoid hesperidin in mouse macrophage cell line[J]. Cancer Lett , 2003, 199 (2) :139–145. DOI:10.1016/S0304-3835(03)00386-0 |
| [48] | 何建明.覆盆子的化学成分及其抗炎活性研究[D].上海:第二军医大学, 2013. http://d.wanfangdata.com.cn/Thesis/Y2339782 |
| [49] | 侯小龙, 王文清, 施春阳, 等. 二氢杨梅素药理作用研究进展[J]. 中草药 , 2015, 46 (4) :603–608. |
| [50] | Qi S, Xin Y, Guo Y, et al. Ampelopsin reduces endotoxic inflammation via repressing ROS-mediated activation of PI3K/Akt/NF-κB signaling pathways[J]. Int Immunopharmacol , 2012, 12 (1) :278–287. DOI:10.1016/j.intimp.2011.12.001 |
| [51] | Ban H S, Lim S S, Suzuki K, et al. Inhibitory effects of furanocoumarins isolated from the roots of Angelica dahurica on prostaglandin E2 production[J]. Planta Med , 2003, 60 (5) :408–412. |
| [52] | Nair M P, Mahajan S, Reynolds J L, et al. The flavonoid quercetin inhibits proinflammatory cytokine (tumor necrosis factor alpha) gene expression in normal peripheral blood mononuclear cells via modulation of the NF-kappa beta system[J]. Clin Vaccine Immunol , 2006, 13 (3) :319–328. DOI:10.1128/CVI.13.3.319-328.2006 |
| [53] | 郎玉英, 张琦. 紫苏总黄酮的抗炎作用研究[J]. 中草药 , 2010, 41 (5) :791–794. |
| [54] | 唐宁, 李子艳, 周咏梅, 等. 木樨草素抗炎作用机制的初步探讨[J]. 中国临床药理学与治疗学 , 2007, 12 (2) :195–199. |
| [55] | Feng J, Lipton J M. Eugenol:Antipyretic activity in rabbits[J]. Neuropharmacol , 1987, 26 (12) :1775–1778. DOI:10.1016/0028-3908(87)90131-6 |
| [56] | Fotos P G, Woolverton C J, Van D K, et al. Effects of eugenol on polymorphonuclear cell migration and chemiluminescence[J]. J Dent Res , 1987, 66 (3) :774–777. DOI:10.1177/00220345870660031401 |
| [57] | 陈婧, 方建国, 吴方建, 等. 鱼腥草抗炎药理作用机制的研究进展[J]. 中草药 , 2014, 45 (2) :284–289. |
| [58] | 王美芹. 金银花的临床新用途和综合利用发展前景[J]. 中国现代药物应用 , 2010, 4 (10) :102–103. |
| [59] | 胡红娟, 陈勇军. 蒲公英临床应用简介[J]. 中国乡村医药 , 2011, 18 (2) :50–50. |
| [60] | 钟君. 鱼腥草临床应用的研究概况[J]. 中国医药指南 , 2012 (24) :235–237. |
| [61] | 张剑峰, 张丹参. 甘草酸药理作用的研究进展[J]. 河北北方学院学报 , 2005, 22 (4) :81–82. |
| [62] | 石兰萍, 田琳琳, 袁劲松, 等. 野菊花的研究概况[J]. 中西医结合心脑血管病杂志 , 2005, 3 (5) :434–436. |
| [63] | 李洪, 王麟, 陈莹, 等. 中药芦根化学成分、药理作用及临床应用研究[J]. 科技信息 , 2014 (5) :31–32. |
| [64] | 朱金段, 袁德俊, 林新颖. 丁香的药理研究现状及临床应用[J]. 中国药物经济学 , 2013 (1) :32–35. |
| [65] | 宋金春, 蔡华, 谢腾芳, 等. 抗微生物药物学[M]. 北京: 科学出版社, 2010 . |
 2016, Vol. 47
2016, Vol. 47


