白术Atractylodis Macrocephalae Rhizoma(AMR)为菊科(Compositae)植物白术Atractylodes macrocephala Koidz.的干燥根茎,其植物形态为多年生草本,白术性温,气清香,味甘、苦,具有健脾益气、燥湿利水、止汗安胎、中和之功效[1]。白术广泛分布于我国大部分地区,因地理位置和生态环境的不同,茎内的化学成分发生了变异。白术主产于浙江、安徽、湖北、江西等省,多为栽培[2]。白术的炮制方法较多,有麸炒、土炒、炒焦、炒炭、米泔水漂、蒸制等。据报道,白术中含有多种类型化学成分,如挥发性成分[3]、内酯类成分[4-8]、多糖类、苷类[9-11]、氨基酸[12]等。由于白术中成分众多,本实验通过对白术的指纹图谱进行研究,以此作为评判白术质量的科学依据之一。
1 仪器与试药 1.1 仪器Waters 2695液相色谱系统(在线脱气机、四元泵、自动进样器,美国Waters公司),连接Waters 2998紫外检测器(美国Waters公司);LC-20AD型快速液相(DGU-20A3型脱气装置,SIL-20A XR型自动进样器,CTO-20AC型柱温箱,日本岛津公司),连接Triple Q-TOF 5600型质谱仪(配备电喷雾离子源系统,美国AB Sciex公司);AY220电子分析天平(日本岛津公司);TGL 16G型离心机(上海安亭科学仪器厂);MUL-9000 Series超纯水系统(美国Millipore公司);FW100型万能粉碎机(天津市泰斯特仪器有限公司);KQ-500B型超声波清洗器(昆山市超声波仪器有限公司)。
1.2 试剂与试药乙腈(批号I698630334,德国Merck公司);甲醇(批号20140624143,山东禹王实业有限公司化工分公司)为色谱纯;95%乙醇(分析纯,批号14011510093,南京化学试剂有限公司);水为超纯水(自制);其余试剂为分析纯。生白术共10批,均购于江阴天江药业有限公司,见表 1。白术内酯I(批号20131109)、白术内酯Ⅲ(批号20131120)均购于中国食品药品检定研究院。
|
|
表 1 样品信息 Table 1 Information of samples |
2 方法与结果 2.1 色谱条件
色谱柱:Inertsil® ODS-SP(150 mm×4.6 mm,5 μm),柱温40 ℃,体积流量1.0 mL/min,流动相为乙腈(A)-水(B),洗脱梯度为0~10 min,30%~45% A;10~25 min,45% A;25~50 min,45%~70% A;50~55 min,70% A;55~62 min,70%~30% A;62~75 min,30% A。采用Waters 2998紫外检测器,检测波长235 nm,分析时间75 min,进样量10 μL。
2.2 质谱条件TOF MS-IDA-MS/MS模式,电喷雾离子源(ESI),采用动态背景扣除(DBS)的方法,在正离子检测模式下采集。雾化器电压(GS1)0.38 MPa(55 psi)、辅助加热器电压(GS2)0.38 MPa(55 psi)、气帘气(Curtain Gas)0.25 MPa(36 psi)、辅助加热器温度(TEM)550 ℃,喷雾电压(IS)-5 500 eV,去簇电压(DP)-100 eV、碰撞电压(CE)-40 eV、碰撞电压差15 eV;质量数扫描范围m/z 50~1 500。
2.3 对照品溶液的配制精密称取白术内酯I、白术内酯Ⅲ对照品各2 mg,置于10 mL量瓶中,加入甲醇定容至10 mL,各取白术内酯I、白术内酯Ⅲ对照品溶液1 mL,置于10 mL量瓶中,加入甲醇定容至10 mL,配制成浓度为20.70 μg/mL的白术内酯I及20.10 μg/mL的白术内酯Ⅲ混合对照品溶液。
2.4 供试品溶液的配制精密称取白术粗粉0.2 g,置10 mL量瓶中,加入70%甲醇,并定容至10 mL,密塞,称定质量,超声处理(功率250 W,频率50 kHz)60 min,取出,放冷,用70%甲醇补足减失质量,摇匀。取适量,离心(12 000 r/min)5 min,取上清液,过0.45 μm微孔滤膜,即得供试品溶液。
2.5 检测波长的选择取适量白术供试液(批号1408034)于比色皿中,得200~400 nm内的PDA扫描图谱。结果发现,白术内酯I、白术内酯Ⅲ在220 nm波长处吸收最强,但色谱信息较少,在235 nm波长处色谱信息最丰富,特征最为明显,图谱中各特征峰信号较强,分离效果较理想。故选择235 nm作为检测波长。
2.6 参照物的确定对药材中已知对照品白术内酯I、白术内酯Ⅲ与白术的指纹图谱对照,发现已知峰在指纹图谱中较大,所以选中其中2号峰白术内酯Ⅲ作为参照峰,其保留时间适中14.202 min,占总峰面积4%左右。
2.7 方法学考察 2.7.1 精密度试验精密称取白术粗粉(批号1408034)0.2 g,按“2.4”项下方法制备成供试品溶液,然后按“2.1”项下方法连续进样6次,每次10 μL,考察特征峰相对保留时间和相对峰面积的一致性。以白术内酯Ⅲ为参照峰,计算其中6个共有峰的相对保留时间及相对峰面积的RSD均小于2%。
2.7.2 稳定性试验精密称取白术粗粉(批号1408034)0.2 g,按“2.4”项下方法制备成供试品液,然后按“2.1”项下方法每隔3 h进样1次,共测定15 h,分别进样10 μL,考察特征峰相对保留时间和相对峰面积的一致性。计算其中6个共有峰的相对保留时间及相对峰面积的RSD均小于2%。
2.7.3 重复性试验精密称取白术粗粉(批号1408034)0.2 g,平行6份,按“2.4”项下方法制备成供试品溶液,按“2.1”进样10 μL分析,考察特征峰相对保留时间和相对峰面积的一致性。计算其中6个共有峰的相对保留时间及相对峰面积的RSD均小于2%。
2.8 白术指纹图谱的建立测定10批不同产地的白术样品的HPLC-PDA图谱,采用国家药典委员会推荐的“中药色谱指纹图谱相似度评价系统(2004A版)”进行结果分析,选择其中共有峰。再以峰2白术内酯Ⅲ为参照峰(即S峰),选择其中相对保留时间和相对峰面积RSD较为稳定(要求不大于5%)的共有峰,作为特征峰,见图 1。依据上述方法,确定白术的指纹图谱中6个特征峰,其中指认出峰2为白术内酯Ⅲ,以峰2为S峰,各特征峰与S峰的相对保留时间应在规定值的±5%之内。规定值为0.16(峰1)、1.00(峰2)、1.56(峰3)、2.06(峰4)、3.28(峰5)、3.54(峰6)。
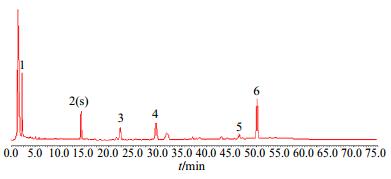
|
图 1 白术HPLC-PDA的指纹图谱 Fig.1 HPLC-PDA fingerprint of AMR |
精密称取10批不同产地的白术样品粗粉各0.2 g,按“2.4”项下方法制备成供试品溶液,然后按“2.1”项进样10 μL分析,得到白术的指纹图谱,结果见图 2和表 2、3。结果表明,10批不同产地的白术样品中特征峰的相对保留时间稳定,RSD均小于2.0%。
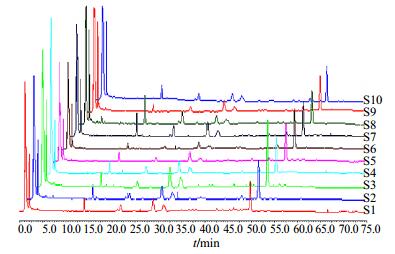
|
图 2 10批白术HPLC-PDA指纹图谱叠加图 Fig.2 Overlay of ten batches of AMR in HPLC-PDA fingerprint |
|
|
表 2 10批白术HPLC-PDA指纹图谱共有峰相对保留时间 Table 2 Relative retention time of common peaks of ten batches of AMR |
|
|
表 3 10批白术HPLC-PDA指纹图谱共有峰相对峰面积 Table 3 Relative peak area of common peaks of ten batches of AMR in HPLC-PDA fingerprint |
2.9 指纹图谱相似度评价
采用国家药典委员会推荐的“中药色谱指纹图谱相似度评价系统(2004A版)”对10批不同产地的白术的指纹图谱进行相似度分析,将10批白术分别与系统中生成的对照谱图(R)进行相似度比较(时间窗宽度0.5),1~10批的相似度分别为0.988、0.994、0.990、0.998、0.991、0.967、0.978、0.950、0.984、0.986,指纹图谱见图 3。结果表明,10批白术与对照图谱的相似度评价结果均大于0.95,说明这10批白术共有物质出峰时间大致相同,质量稳定。
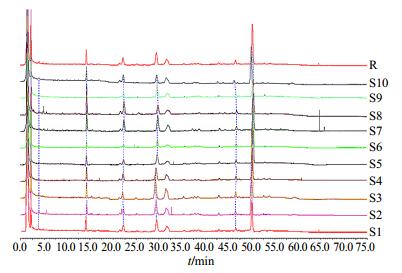
|
图 3 10批白术HPLC-PDA指纹图谱相似度评价自动匹配图 Fig.3 Automatic matching figure of similarity evaluation of ten batches of AMR in HPLC-PDA fingerprint |
2.10 UFLC-Q-TOF/MS定性鉴别
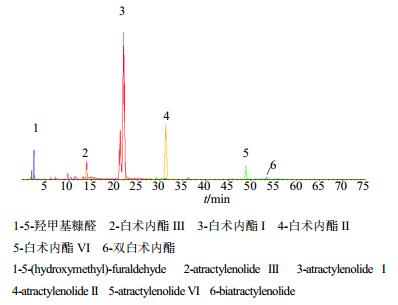
采用UFLC-Q-TOF/MS方法对白术进行定性分析,利用Analyst TF 1.6软件采集数据,采用Peak View软件中XIC Manager功能进行目标化合物的筛查和确证(叠加图见图 4)、软件中的Formula finder功能测得化合物相对分子质量,结合特征碎片,再根据UFLC-Q-TOF/MS总离子流图中供试品与对照品保留时间的对照,从而确认白术指纹图谱中的各峰。其正离子模式下UFLC-Q-TOF/MS的总离子流图见图 5、动态扣背景图见图 6,鉴别结果见表 4和表 5。总离子流图中6个化合物的一级、二级质谱图见图 7。
|
图 4 白术的XIC Manager筛查叠加图 Fig.4 XIC Manager screening overlay of AMR |

|
图 5 白术的正离子模式的总离子流图 Fig.5 TIC with positive ion mode of AMR |
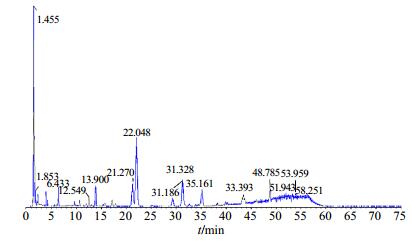
|
图 6 白术的正离子模式总离子的动态图 Fig.6 Dynamic map of positive ion mode of total ion of AMR |

|
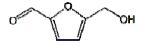
1-一级质谱图 2-二级质谱图A-5-羟甲基糠醛B-白术内酯Ⅲ C-白术内酯I D-白术内酯II E-白术内酯VI F-双白术内酯 1-first order mass spectra 2-second order mass spectra A-5-(hydroxymethyl)-2-furaldehyde B-atractylenolide Ⅲ C-atractylenolide I D-atractylenolide II E-atractylenolide VI F-biatractylenolide 图 7 白术指纹图谱中化合物1~6的质谱图 Fig.7 Mass spectra of compounds 1-6 in fingerprint of AMR |
|
|
表 4 白术指纹图谱化学成分的MS/MS分析结果(正离子模式) Table 4 MS/MS analysis of chemical components in fingerprint of AMR (positive ion mode) |
|
|
表 5 白术指纹图谱化学成分的UFLC-Q-TOF/MS分析鉴别结果(正离子模式) Table 5 UFLC-Q-TOF/MS analysis of chemical components in fingerprint of AMR (positive ion mode) |
以峰2为例,在保留时间为13.900 min时在ESI+模式下的一级质谱图中(图 7-B-1),观测到m/z 249.148 9 [M+H]+和m/z 231.138 1 [M+H-H2O]+的碎片离子峰,推测m/z 249.148 9 [M+H]+为其准分子离子峰。利用Formula finder软件计算其可能的元素组成为C15H20O3,理论相对分子质量为249.148 5,实测值为249.148 9,误差为0.5×10-6。二级质谱图(图 7-B-2)中出现249.149 1 [M+H]+、231.138 8 [M+H-H2O]+、213.126 8 [M+H-H2O-H2O]+、203.142 2 [M+H-H2O-CO]+、185.132 3 [M+H-H2O-CO-H2O]+、161.132 6 [M+H-H2O-CO-CH2CO]+、157.100 7 [M+H-H2O-CO-H2O-C2H4]+、144.100 6 [M+H-H2O-CO-C3H7O]+、129.069 8 [M+H-H2O-CO-C3H7O-CH3]+、119.085 8 [M+H-H2O-CO-CH2CO-C3H6]+、105.069 9 [M+H-H2O-CO-CH2CO-C4H8]+、91.055 3 [M+H-H2O-CO-CH2CO-C3H6-C2H4]+、79.055 9 [M+H-H2O-CO-CH2CO-C4H8-C2H2]+的碎片离子,推测该化合物为白术内酯Ⅲ。
3 讨论 3.1 提取条件的考察对提取条件如提取方式(回流、超声)、提取溶剂(甲醇、95%乙醇)、提取溶剂体积分数(30%、50%、70%、90%)、提取时间(30、60、90 min)等进行了考察。综合考虑各个因素,最终确定提取方式为超声、提取溶剂为70%甲醇和提取时间为60 min。
3.2 色谱条件的考察采用HPLC-PDA,考察了多个C18键合硅胶色谱柱:Inertsil® ODS-SP(150 mm×4.6 mm,5 μm)、Kromasil C18(150 mm×4.6 mm,5 μm)、Hedera ODS-3(150 mm×4.6 mm,5 μm)、Phenomenex® ODS C18(250 mm×4.6 mm,5 μm),结果表明Inertsil® ODS-SP(150 mm×4.6 mm,5 μm)能够较好地分离各色谱峰,出峰时间比较适当,分离度好。
考察了乙腈-水和甲醇-水2种流动相体系对白术的检测,结果发现,乙腈-水系统分离得到对称性较佳的色谱峰,具有更好的分离效果。同时,采用梯度洗脱,考察了不同配比的流动相对白术中各化学成分的分离情况。
另外,分别对色谱条件如柱温(38、40、42 ℃)、体积流量(0.9、1.0、1.1 mL/min)、仪器(Waters 2695和Agilent 1260高效液相色谱系统)等进行了考察。综合考虑各个因素,确定了最终的色谱条件。
3.3 小结一般采用传统的TLC法对其定性和HPLC法对其进行定量测定,笔者更倾向于采用中药指纹图谱对中药饮片和产品进行整体的把控,从源头评价中药饮片的真实性、均一性。本研究建立了白术的HPLC指纹图谱,共标定了6个共有指纹峰,并利用高分辨UFLC-Q-TOF/MS方法对共有峰进行了定性鉴别,明确了6个共有峰的化学成分,分别为5-羟甲基糠醛、白术内酯Ⅲ、白术内酯I、白术内酯II、白术内酯VI和双白术内酯。方法简便易行且稳定可靠、重复性较好。采用相似度对指纹图谱进行评价,不同批次相似度较好,均大于0.95,说明不同产地(浙江、安徽和湖南等省)、不同批次白术的化学组成一致性较好。将指纹图谱用于生产过程,可为该产品提供更为全面的质量控制手段。若能在此基础上发展,和临床剂量与药效或毒性联系起来,则能从源头开始保证临床用药的安全有效性,对科研与生产实践的结合具有重要的指导意义。
| [1] | 李家实. 中药鉴定[M]. 上海: 上海科学技术出版社, 1996 . |
| [2] | 杨娥, 钟艳梅, 冯毅凡. 白术化学成分和药理作用的研究进展[J]. 广东药学院学报 , 2012, 28 (2) :218–221. |
| [3] | 邱琴, 崔兆杰, 刘延礼, 等. 白术挥发油化学成分的GC-MS研究[J]. 中草药 , 2002, 33 (11) :980–982. |
| [4] | Li C Q, He L C, Dong H Y, et al. Screening for the anti-inflammatory activity of fractions and compounds from Atractylodes macrocephala Koidz[J]. J Ethnopharm , 2007, 114 (2) :212–217. DOI:10.1016/j.jep.2007.08.002 |
| [5] | 陈建民, 俞敏倩, 沈银柱, 等. 组织培养白术和天然白术化学成分的比较[J]. 植物学报 , 1991, 33 (2) :164–167. |
| [6] | 黄宝山, 孙建枢, 陈仲良, 等. 白术内酯IV的分离鉴定[J]. 植物学报 , 1992, 34 (8) :614. |
| [7] | Han J H, Kim J, Kim S, et al. Anti-oxidative compounds from the aerial parts of Atractylodes macrocephala Koidz.umi[J]. Yakhak Hoeji , 2007, 51 (2) :88–95. |
| [8] | Chen Z L, Cao W Y, Zhou G X, et al. A sesquiterpene lactam from Artractylodes macrocephala[J]. Phytochemistry , 1997, 45 (4) :765–767. DOI:10.1016/S0031-9422(97)00036-8 |
| [9] | Kitajima J, Kamoshita A, Ishikawa T, et al. Glycosides of Atractylodes ovata[J]. Chem Pharm Bull , 2003, 51 (9) :1106–1108. DOI:10.1248/cpb.51.1106 |
| [10] | 李伟, 文红梅, 崔小兵, 等. 白术的化学成分研究[J]. 中草药 , 2007, 38 (10) :1460–1462. |
| [11] | 王瑶, 田薇, 王舒琳, 等. 浙江不同产区白术质量评价研究[J]. 中草药 , 2012, 43 (8) :1615–1620. |
| [12] | 池玉梅, 李伟, 文红梅, 等. 白术多糖的分离纯化和化学结构研究[J]. 中药材 , 2001, 24 (9) :647–648. |
| [13] | 于玲玲, 贾天柱, 才谦. 白术的化学对照品制备研究[J]. 亚太传统医药 , 2010, 6 (3) :36–38. |
| [14] | Ding H Y, Liu M Y, Chang W L, et al. New sesquiterpenoids from the rhizomes of Atractylodes macrocephala[J]. China Pharm J , 2005, 57 (1) :37–42. |
| [15] | 方学敏, 曹岗, 蔡银燕. 白术化学成分的制备研究[J]. 中华中医药学刊 , 2013, 31 (5) :993–995. |
 2016, Vol. 47
2016, Vol. 47



 [
[ [
[ [
[ [
[ [
[