黄芩苷是传统中药黄芩的主要成分,属于黄酮类化合物,分子结构中因含有羟基或羰基等基团而与金属离子有较强的螯合作用,目前已有关于黄芩苷-金属配合物(baicalin-metal complexes,BMC)的报道[1-5],显示其具有清除自由基、抗氧化、抑菌等生物活性,但BMC抗肿瘤研究的文献报道尚少[6-9],作用机制目前需进一步明确。
生物体内药物分子的生物活性功能是通过它们与生物大分子的相互作用得以实现。因此,药物分子与生物大分子相互作用一直是药理研究的热点领域,也是人们探索药物分子的生物学效应和功能的基本途径之一[10-12]。DNA是生物体的基本遗传物质,为许多的抗癌、抗病毒药物在体内的主要靶向分子,药物分子与DNA相互作用后不同程度地导致DNA分子结构与功能的变化,进而对DNA的复制和表达等功能产生影响[13-14],因此DNA与药物分子的相互作用研究对阐述药物的作用机制具有重要指导意义。
目前常用于药物与DNA相互作用的方法有紫外可见光谱分析、荧光分析、圆二色谱、线二色谱、凝胶电泳等[15-19],而电化学分析法具有灵敏度高、选择性好的特点,且电化学反应与生物反应的相似性使之可模拟生物体内的氧化还原反应,因此,电化学分析法在进行有关DNA研究方面,尤其在了解药物与DNA的作用机制方面体现了独特的优越性[20-21]。
本实验以提取的肝癌细胞DNA为靶点,利用功能化的多壁碳纳米管(F-MWCN)修饰电极,研究合成制备的新型BMC与肝癌细胞DNA的相互作用,探讨二者的作用方式及机制,为新型抗肿瘤药物的设计提供一种新的思路。
1 材料 1.1 仪器CHI660C电化学工作站(上海辰华仪器有限公司);三电极系统:修饰的CHI104玻碳电极(Φ=3 mm)为工作电极,饱和甘汞电极为参比电极,铂电极为对电极;SK3210HP超声波清洗器(上海科导超声仪器有限公司);电子分析天平(Sartorius公司);UV-2550型紫外分光光度计;HF90型二氧化碳培养箱(力康生物医疗科技控股有限公司);Thermo Scientific二级生物安全柜(赛飞世尔科技公司);CKX31型倒置显微镜(Olympus公司);Bio-Rad 680酶标仪、Universal Hood II型凝胶成像分析系统(Bio-Rad公司);MLS-3750高压灭菌器(Sanyo公司);3K15型离心机(Sigma公司);核酸蛋白分析仪(Eppendorf公司);DHG-9123A电热恒温鼓风干燥箱(上海恒科技有限公司)。
1.2 药物与试剂黄芩苷(质量分数98%,批号93644-912,上海金穗生物科技有限公司);Ce(NO3)3·6H2O、Y(NO3)3·6H2O、LaCl3·7H2O均购自于上海安耐吉化学有限公司。
黄芩苷与金属(Y3+、La3+、Ce3+)配合物(BC-Y、BC-La、BC-Ce)为本实验室根据文献方法[22-24]合成自制。
PBS缓冲液(0.5 mol/L磷酸氢二钠与0.5 mol/L磷酸二氢钠溶液按不同体积比配制成不同pH值的PBS缓冲液);改良型RPMI 1640培养基(HyClone,赛默飞世尔生物化学制品有限公司);胰蛋白酶粉剂(Gibco公司),使用前先用PBS缓冲液配制成2.5 mol/L存放于−20 ℃,使用时稀释10倍;胎牛血清(FBS,HyClone,上海超研试剂有限公司);1×PBS(NaCl 8.0 g、KH2PO4 0.2 g、KCl 0.2 g、Na2HPO4·12H2O 3.58 g溶解于三蒸水中,搅拌定容至1 L,高温灭菌后于−4 ℃保存备用);DNA提取试剂盒(博迈德生物科技有限公司);10×TBE(Tris碱108 g、硼酸55 g、EDTA 9.3 g,蒸馏水配成1 L,使用时稀释成1×TBE)。
1.3 细胞SMMC-7721肝癌细胞购于复旦大学肿瘤医学库。
2 方法 2.1 细胞总DNA的提取及检验 2.1.1 细胞培养将SMMC-7721细胞常规培养于含10% FBS及青霉素和链霉素各100 U/L的RPMI 1640培养液中,于37 ℃、5%CO2饱和湿度恒温培养箱中培养。细胞呈单层贴壁生长,根据细胞生长状态和生长速度进行换液及传代。
2.1.2 细胞总DNA的提取按试剂盒说明书,提取细胞总DNA,对其进行纯度和浓度分析及1%的琼脂糖凝胶电泳观察。最终所得DNA于−20 ℃保存备用。
2.1.3 DNA纯度及浓度检测参照紫外分光光度计上的核酸分析软件进行。具体步骤如下:以溶解DNA的灭菌水调零;取1 μL上述提取的DNA溶液与99 μL的灭菌水混匀,即稀释100倍,260、280 nm处测定样品的吸光度(A260、A280)值,计算DNA的质量浓度(μg/μL)。
DNA的质量浓度=A260×稀释倍数×0.05
计算A260/A280值,验证DNA的纯度(纯净的DNA,其A260/A280值在1.8附近,高于1.8说明RNA未除尽;低于1.8说明有蛋白污染);用灭菌水将提取的DNA稀释为0.1 g/L,−20 ℃保存备用。
2.1.4 DNA完整性检测取5 μL提取的DNA,加入6×Loading buffer上样缓冲液1 μL,混合后上样于1%琼脂糖凝胶上,用DNA Marker DL 2000作为标准相对分子质量对照,核酸染料染色,120 V电压,电泳30 min,在紫外凝胶成像分析仪上观察、照相、记录。
2.2 BMC电化学检测方法的建立F-MWCN修饰电极的制备:10 mg多壁碳纳米管(MWCN)溶于50 mL浓HCl中,磁力搅拌下加热回流7 h,以去除金属催化剂。纯化后的MWCN置于80 mL酸液(硝酸-硫酸1:3)中,室温超声反应10 h。蒸馏水洗至中性,得到功能化的多壁碳纳米管(F-MWCN)[25],干燥成粉末。取10 mg F-MWCN溶于N, N-二甲基甲酰胺中,超声20 min使其分散均匀备用。玻碳电极分别用0.3和0.05 μm的A12O3粉末在抛光布上进行抛光,二次蒸馏水冲洗后将玻碳电极移入超声清洗仪中依次用二次蒸馏水、无水乙醇、二次蒸馏水超声清洗(5 min/次),室温晾干。取5 μL F-MWCN溶液滴涂至预处理好的玻碳电极表面,自然干燥制成F-MWCN/GCE修饰电极。
F-MWCN修饰电极的表征:采用传统的三电极体系,以5.0 mmol/L [Fe(CN)6]4−/3−为氧化还原探针,以修饰电极为工作电极,饱和甘汞电极为参比电极,铂丝为辅助电极,于0.l mol/L KCl电解质溶液中,进行电化学阻抗表征。
BMC检测方法:常温下,在CHI660C电化学分析仪上应用循环伏安法考察1×10−4 mol/L BMC(BMC的浓度均以黄芩苷计,下同)在0.1 mol/L Britton-Robinson(B-R,pH 5.4~8.0)缓冲液、0.1 mol/L PBS(pH 5.4~8.0)缓冲液、0.1 mol/L Tris-HCl(pH 5.4~8.0)缓冲液中的伏安特性,筛选最佳电解质溶液。固定其他实验条件,循环伏安法考察溶液pH和扫速对电极响应信号的影响,确定最佳pH及扫速,建立BMC的检测方法。
2.3 BMC与肝癌细胞DNA相互作用的性能分析BMC与DNA相互作用的检测指标:通过应用循环伏安法检测DNA与不同浓度BMC的相互作用,获得电子转移系数(α)和电子转移速率常数(ks)及二者相互作用的结合数(m)和结合常数(β),进而分析BMC与SMMC-7721细胞DNA相互作用性能。
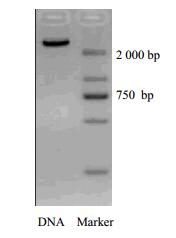
3 结果与分析 3.1 SMMC-7721细胞总DNA的提取及检验提取SMMC-7721细胞总DNA,并进行凝胶电泳检测,结果见图 1。核酸电泳显示仅有一条亮带出现,且经紫外分光光度计检测得该DNA的A260/A280值为1.78,说明该DNA片段完整、纯度较高,满足后续实验要求。
|
图 1 SMMC-7721细胞总DNA提取的核酸电泳图 Fig.1 Electrophoresis of SMMC-7721 cells for DNA extraction |
3.2 BMC的电化学分析方法考察 3.2.1 F-MWCN修饰电极的表征
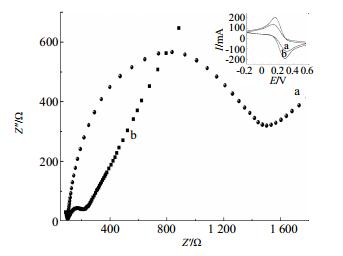
F-MWCN/ GCE修饰电极的交流阻抗表征结果见图 2。可知,a为裸电极交流阻抗,界面电子传递阻力很大,b为F-MWCN修饰电极,b比a界面电子传递阻力明显减少,这是因为功能化的碳纳米管极易被溶剂润湿,能形成较好的电极/溶液界面,能加速氧化还原物质与电极间的电子转移。由图 2右上方的循环伏安图可知,F-MWCN修饰电极具有更好的氧化反应可逆性,可用于电极检测反应。
|
a-玻碳电极b-F-MWCN/GCE修饰电极 a-bare GCE b-F-MWCN/GCE 图 2 不同电极在含[Fe (CN)6]4-/3--KCl溶液中的交流阻抗图 Fig.2 Electrochemical impedance spectrum of different modified electrodes measured in [Fe (CN)6]4-/3--KCl solution |
3.2.2 检测方法的优化
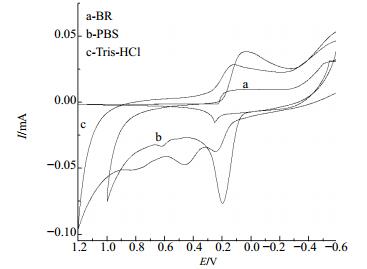
实验考察了多种缓冲溶液作为支持电解质时BMC的电化学行为,结果显示,BMC(BC-Ce)在PBS缓冲溶液中峰形对称,基线稳定,电极反应可逆性较好,因此实验选择PBS缓冲溶液为底液(BC-Y、BC-La的电化学行为相似)。BC-Ce检测结果见图 3。
|
图 3 不同缓冲液循环伏安图(CBC-Ce=3.0 × 10-4 mol/L) Fig.3 Cyclic voltammogram of various buffers (CBC-Ce=3.0 × 10-4 mol/L) |
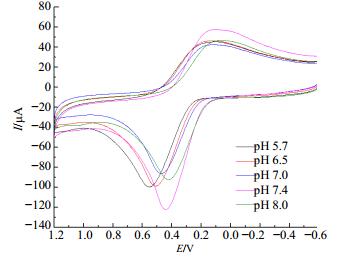
溶液的pH值是影响峰电流和峰电压的重要因素之一。本实验考察BMC在PBS缓冲溶液(pH 5.4~8.0)中的伏安特性,结果见图 4。
|
图 4 BMC (BC-Ce)在不同pH的PBS缓冲溶液中的循环伏安图(CBC-Ce=3.0×10-4 mol/L) Fig.4 Cyclic voltammogram of BMC (BC-Ce) in various PBS buffer solutions with different pH values (CBC-Ce=3.0 × 10-4 mol/L) |
如图 4所示,I随溶液pH值的增大先增大后减小,当pH值为7.4时BMC(BC-Ce)的I出现最大值,且峰形对称性最好,可逆性最好,因此本实验选择在pH值7.4的PBS缓冲溶液中实验。
扫描速率(50、100、150、200、250、300、350、400 mV/s)对BMC在电极上响应信号的影响结果见图 5。随着扫速的增加,BMC的峰电流均相应增加,峰电流与扫描速率的一次方呈良好的线性关系,说明3种配合物在F-MWCN修饰电极表面均发生了受吸附控制的氧化还原反应。本实验均在最佳条件下进行。
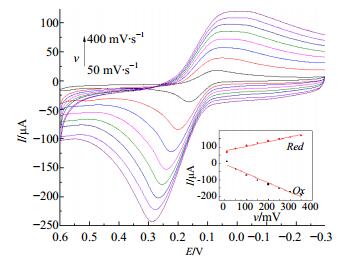
|
图 5 BMC (BC-Ce)在不同扫描速率下的循环伏安图 Fig.5 Cyclic voltammogram of BMC (BC-Ce) at different scanning rates |
3.3 BMC与DNA的相互作用分析
根据建立的方法体系,检测不同浓度DNA(0、5、10、20、30、40、50 mol/L)与BMC在F-MWCN/GCE电极上的循环伏安曲线,结果见图 6。以DNA浓度为横坐标,Epc为纵坐标,进行线性拟合,结果见图 7和表 1。
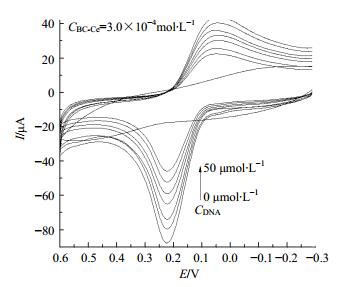
|
图 6 不同浓度DNA与BMC在F-MWCN/GCE电极上的循环伏安曲线 Fig.6 Cyclic voltammograms of DNA and BMC at different concentration in F-MWCN/GCE electrode |

|
图 7 不同浓度DNA与BMC相互作用线性拟合 Fig.7 Linear fitting of interactions between DNA and BMC at different concentration |
|
|
表 1 不同浓度DNA与BMC相互作用线性拟合 Table 1 Linear fitting of interactions between DNA and BMC at different concentration |
由图 6可知,−0.3~0.6 V电位内DNA在F-MWCN修饰电极上几乎没有峰电流产生;由前述可知,BMC本身可产生一对氧化还原峰;BMC与DNA相互作用后,其氧化还原峰电流均明显下降,且随着DNA浓度的增大,此现象更加明显,呈现良好的线性拟合;此外,峰电位发生不同程度的位移。根据Bard理论[26]:当配合物与DNA发生作用时,若峰电位负移,说明配合物与DNA发生静电作用,若峰电位正移,则说明为插入作用。以此可判断出BC及3种BMC与DNA均发生了不同程度的静电作用,且静电作用大小依次为BC-Ce、BC-La、BC-Y、BC。
3.4 BMC与DNA相互作用机制的探讨 3.4.1 电子转移数(n)的测定研究扫描速率(50、100、150、200、250、300、350、400、450、500 mV/s)对相互作用后电极响应信号的影响,可求得BMC与DNA相互作用过程中的n,结果见图 8,线性回归方程见表 2。
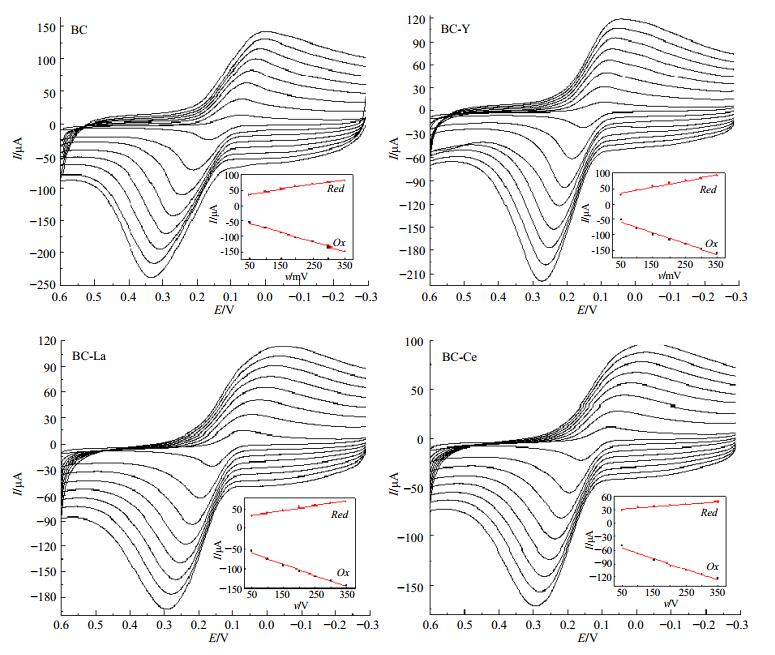
|
CBMC=3.0 × 10-4 mol·L-1, CDNA=5.0 g·L-1 图 8 扫描速率对峰电流的影响 Fig.8 Effect of scanning rates on peak current |
|
|
表 2 扫描速率对峰电流影响数据的拟合方程 Table 2 Fitting equations of effect of scanning rates on peak current |
结果表明,还原峰电流和氧化峰电流均随着扫描速率的增大而增强,且均与扫描速率呈良好的线性关系,说明BMC及BC与DNA相互作用后在F-MWCN修饰电极表面的电极反应没有多大变化,仍是受吸附控制。
根据Laviron理论[27],BMC及BC与DNA相互作用后在F-MWCN修饰电极上的吸附符合Langmuir吸附等温式,即
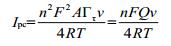
|
Q=nFAΓτ为循环伏安单一过程的峰面积(以电量计),上式表明,无需知道电极表面吸附量及电极面积的绝对值,只需测得某扫描速率下循环伏安图上的峰面积即可求得n。实验在100 mV/s扫描速率下测得BMC与DNA相互作用后的Ipc和峰面积Ah,求得加入DNA后参与电极反应的电子数n=1,见表 3。
|
|
表 3 BMC与DNA相互作用的Ipc、Ah及n Table 3 Ipc, Ah, and n of interactions between DNA and BMC |
3.4.2 α和ks的测定
由上述可知,DNA与BMC相互作用后为准可逆吸附反应,根据Laviron理论,可得公式:

|
电子转移速率常数ks可由公式算出[28]:
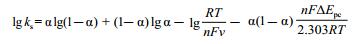
|
在一定的扫描速率范围内,以Epc对lgv作图得一直线,由直线斜率求出α,进而计算出ks,结果见表 4。表 4对比表 2发现,体系中加入DNA后,电化学参数α和ks均发生了显著变化。由此可推断BMC及BC与DNA确实发生了一定的相互作用,且形成了一种非电活性的超分子化合物,从而使得溶液中游离的BMC及BC浓度减少,峰电流降低。
|
|
表 4 扫速对峰电位影响数据的拟合方程 Table 4 Fitting equations of effect of scaning rates on peak potential |
3.4.3 m和β的测定
对于BMC及BC与DNA相互作用形成的非电活性超分子化合物,可根据参考文献报道[29]求算其相互作用的m及其β。假设BMC及BC与DNA只形成缔合物DNA-mBMC,即:
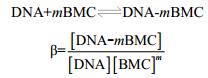
|
根据文献报道[29]所导出的方程,可得到BMC与DNA作用过程符合公式:

|
ΔIp, max为加入DNA前后的最大峰电流差,ΔIp为加入DNA前后的峰电流差。做lg [ΔIp/(ΔIp, max-ΔIp)]与lgCBMC关系曲线,根据斜率和截距可分别求出m和β,结果见图 9和表 5。
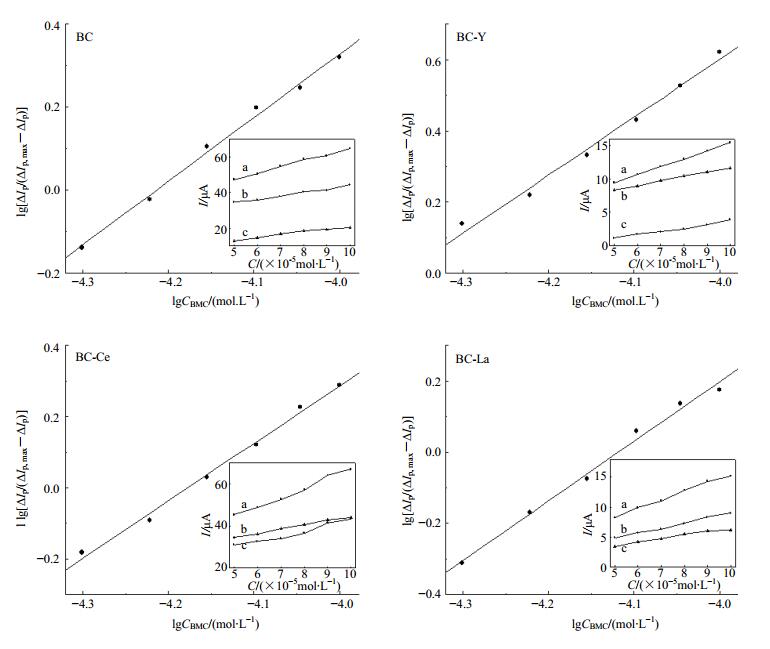
|
a-CDNA=0 mg·L-1 b-CDNA=10 mg·L-1 c-ΔIp=Ipa-Ipc 图 9 lg [ΔIp/(ΔIp, max-ΔIp)]与lgCBMC的关系图 Fig.9 Relationship between lg [ΔIp/(ΔIp, max-ΔIp)] and lgCBMC |
|
|
表 5 lg [ΔIp/(ΔIp, max-ΔIp)]与lgCBMC关系曲线的拟合方程 Table 5 Relationship curves of fitting equations between lg [ΔIp/(ΔIp, max-ΔIp)] and lgCBMC |
根据斜率求得BC及3种BMC与DNA相互作用的结合数m分别为0.63、0.71、0.77、0.76,表明4种物质与DNA可能形成1:1型的非电活性超分子化合物。为验证此推论的正确性,设m分别为1、2、3,并对其分别作相应的1/ΔIp~1/CBMCm关系曲线,由直线的斜率和截距分别求出ΔIp, max和β。结果表明4种物质均在m=1时,ΔIp, max与实验所测数值接近,因此4种物质均与DNA形成1:1复合物的推论可靠。由表 5可知,BMC及BC与DNA结合常数的大小顺序为βBC-Ce>βBC-La>βBC-Y>βBC。
4 讨论BMC在F-MWCN修饰电极上的电极过程为吸附控制的由1个电子和1个质子参加的准可逆电极反应;加入肝癌细胞SMMC-7721DNA后,BMC及BC和DNA通过静电作用形成一非电活性的超分子化合物DNA-BMC,电极过程仍为受吸附控制的准可逆电极反应,通过比较是否加入DNA反应前后α和ks的变化,可从理论上说明DNA与BMC及BC确实发生了相互作用,通过计算获得DNA-BMC的m=1,βBC=1.27×105 L/mol、βBC-Y=3.46×105 L/mol、βBC-La=6.24×105 L/mol、βBC-Ce=7.29×106 L/mol,即BMC与DNA结合作用的强弱为BC-Ce>BC-La>BC-Y>BC。BMC与DNA结合能力与其细胞毒性一致,具有关联性,说明BMC进入细胞后与DNA结合,阻滞DNA的复制,抑制细胞增殖,促进细胞凋亡,进而表现出抗肿瘤活性[5, 30]。本研究的重点是通过电化学的方法探讨BMC与肝癌DNA的结合能力,至于整体动物水平的疗效等,本实验室也做了相关细胞与动物实验,如MTT、荧光定量RT-PCR、蛋白印迹、裸鼠肝癌模型等[30-31],体内外实验均显示BMC可能是新型抗肿瘤药物的潜在化合物,本研究相关结果为新型抗肿瘤中药配合物研究提供参考。
| [1] | Orzechowska B, Jatczak B, Chaber R, et al. Baicalin from the extract of Scutellaria baicalensis affects the innate immunity and apoptosis in leukocytes of children with acute lymphocytic leukemia[J]. Int Immunopharm , 2014, 23 (2) :558–567. DOI:10.1016/j.intimp.2014.10.005 |
| [2] | Chen H J, Gao Y, Wu J L, et al. Exploring therapeutic potentials of baicalin and its aglycone baicalein for hematological malignancies[J]. Cancer Lett , 2014, 354 (1) :5–11. DOI:10.1016/j.canlet.2014.08.003 |
| [3] | 刘衍季, 何小燕, 刘晓华, 等. 黄芩苷铜和铝配合物的合成及其生物活性研究[J]. 中国中药杂志 , 2012, 37 (9) :1296–1301. |
| [4] | Li D J, Zhu M, Xu C, et al. Characterization of the baicalein-bovine serum albumin complex without or with Cu2+ or Fe3+ by spectroscopic approaches[J]. Eur J Med Chem , 2011, 46 (2) :588–599. DOI:10.1016/j.ejmech.2010.11.038 |
| [5] | 袁瑞娟, 王贝贝, 赵爽, 等. 黄芩苷锌配合物的合成及其对人宫颈癌HeLa细胞抑制作用[J]. 北京中医药大学学报 , 2014, 37 (9) :625–628. |
| [6] | 张齐熊陈剡. 新型黄芩苷稀土金属配合物的合成及其抗肿瘤活性和与DNA的相互作用[J]. 合成化学 , 2013, 21 (2) :137–140. |
| [7] | 武荣兰, 封顺, 王吉德, 等. 黄芩苷及其金属配合物的抗氧性研究[J]. 科技导报 , 2005, 24 (1) :36–37. |
| [8] | 胡默.黄芩苷铜稳定性分析及对小鼠肝损伤影响的研究.[D].重庆:西南大学, 2014. |
| [9] | Xue T, Li F J, Zhu L, et al. Study on the electrochemical behavior of anticancer herbal drug rutin and its interaction with DNA[J]. J Electroanal Chem , 2008, 621 (1) :1–6. DOI:10.1016/j.jelechem.2008.02.022 |
| [10] | 路萍萍, 孟志云, 王敏伟, 等. 表面等离子共振技术测定药物与人血清蛋白的相互作用[J]. 中国药理学与毒理学杂志 , 2007, 21 (2) :147–151. |
| [11] | Wei X, Hao Q L, Zhou Q, et al. Interaction between promethazine hydrochloride and DNA and its application in electrochemical detection of DNA hybridization[J]. Electrochim Acta , 2008, 53 (24) :7338–7343. DOI:10.1016/j.electacta.2008.04.007 |
| [12] | Wang L P, Lin L, Ye B X. Electrochemical studies of the interaction of the anticancer herbal drug emodinwith DNA[J]. J Pharm Biomed , 2006, 42 (5) :625–629. DOI:10.1016/j.jpba.2006.05.017 |
| [13] | 徐丽, 陈禹, 巫佳焕, 等. 钌多吡啶配合物与DNA作用及抗肿瘤活性[J]. 无机化学学报 , 2013, 29 (3) :613–620. |
| [14] | Yu F S, Ding Y B, Gao Y W, et al. Fluorescence enhancement effect for the determination of DNA with calcein-cetyl trmiethyl ammonium bromide system[J]. Anal Chim Acta , 2008, 625 (2) :195–200. DOI:10.1016/j.aca.2008.07.023 |
| [15] | 关郁芳, 雷丹丹, 谭玉荣, 等. 食品有害物质与DNA相互作用的体外研究方法[J]. 食品科学 , 2013, 34 (7) :302–306. |
| [16] | Sanchez-Carrasco S, Delcros J G, Moya-Garcia A A, et al. Study by optical spectroscopy and molecular dynamics of the interaction of acridine-spermine conjugate with DNA[J]. Biophys Chem , 2008, 133 (1/3) :54–65. |
| [17] | Guo Y J, Chao J B, Pan J H. Study on the interaction of 5-pyridine-10, 15, 20-tris-(p-chlorophenyl) porphyrin with cyclodextrins and DNA by spectroscopy[J]. Spectrochim Acta A , 2007, 68 (2) :231–236. DOI:10.1016/j.saa.2006.11.019 |
| [18] | 刘振佳, 司伊康, 陈晓光. 园二色谱测定技术在小分子化合物与DNA相互作用研究中的应用[J]. 药学学报 , 2010, 45 (12) :1478–1484. |
| [19] | Rauf S, Gooding J J, Akhtar K, et al. Electrochemical approach of anticancer drugs-DNA interaction[J]. J Pharm Biomed , 2005, 37 (2) :205–217. DOI:10.1016/j.jpba.2004.10.037 |
| [20] | 高铭徽, 韦明元, 郭良宏. 电化学方法研究小分子与核酸相互作用的进展[J]. 生态毒理学报 , 2010, 4 (5) :481–490. |
| [21] | 李思睿, 董慧茹, 毕鹏宇. 黄芩苷-Fe (Ⅱ)配合物的合成及表征[J]. 北京化工大学学报 , 2006, 33 (2) :97–99. |
| [22] | 邓毅, 赵爱华, 尹龙萍, 等. 黄芩苷-铬(Ⅲ)配合物的合成与表征[J]. 中国天然药物 , 2007, 5 (1) :38–39. |
| [23] | 王学军, 刘雄, 刘峰林. 黄芩苷稀土配合物的合成与表征[J]. 中医药学报 , 2009, 37 (5) :66–68. |
| [24] | 史巧霞, 王瑞琼, 杜丽东. 黄芩苷铈、钇配合物的镇痛抗炎作用研究[J]. 西部中医药 , 2013, 26 (6) :13–15. |
| [25] | Du D, Chen S Z, Cai J, et al. Electrochemical pesticide sensitivity test using acetylcholines-terase biosensor based on colloidal gold nanoparticle modified sol-gel interface[J]. Talanta , 2008, 74 (4) :766–772. DOI:10.1016/j.talanta.2007.07.014 |
| [26] | Feng Q, Li N Q, Jiang Y Y. Electrochemical studies of porphyrin interacting with DNA and determination of DNA[J]. Anal Chim Acta , 1997, 344 (1/2) :97–104. |
| [27] | 张祖训, 汪尔康. 电化学原理和方法[M]. 北京: 科学出版社, 2000 . |
| [28] | How G T S, Pandikumar A, Ming H N, et al. Highly exposed{001}facets of titanium dioxide modified with reduced grapheme oxide for dopamine sensing[J]. Sci Rep , 2014 . DOI:10.1038/srep05044 |
| [29] | Carter M T, Rodriguez M, Bard A J. Voltammetric studies of the interaction of metal chelats with DNA.2.Tris-chelated complexes of cobalt (Ⅲ) and iron (Ⅱ) with 1, 10-phenanthriline and 2, 2'-bipyridine[J]. J Am Chem Soc , 1989, 111 (24) :8901–8911. DOI:10.1021/ja00206a020 |
| [30] | 郭明, 伍周玲, 王春歌, 等. 黄芩苷-金属配合物的合成及其抗肿瘤活性研究[J]. 药学学报 , 2014, 49 (3) :337–345. |
| [31] | 高小艳.黄芩苷-铈、镧、钇三种金属络合药物合成、表征及抗肿瘤活性研究[D].阿拉尔:塔里木大学, 2015. |
 2016, Vol. 47
2016, Vol. 47

