随着人们生活方式的改变,冠心病的发病率逐年升高,目前经皮腔内冠状动脉成形术(PTCA)和经皮冠状动脉介入治疗(PCI)已经成为治疗冠心病、血运重建的常规手段之一,该类技术的应用,大大降低心肌梗死患者的病死率[1]。成熟的技术、先进的器械为该技术的广泛应用提供了保障,然而该技术目前仍存在无法摒除的缺点,即术后再狭窄(restenosis,RS)的发生,因此寻找一种能够解决该问题的方法成为了介入心脏病学研究的热点之一。目前RS的发病机制尚未最后阐明。研究证明冠状动脉球囊扩张术后发生的RS,可以使血管管腔面积缩小,管腔的狭窄表现在组织学上便是内膜的过度增生。内膜的过度增生是RS形成过程中最为重要的环节,该过程主要是平滑肌细胞的增殖、迁移以及细胞外基质的大量蓄积[2]。黄芪甲苷是黄芪的主要成分,属于皂苷类,是从黄芪中提取、分离得到的单一成分,研究发现黄芪甲苷具有保护血管内皮细胞、平滑肌细胞,抗血栓、扩张冠状动脉、改善循环等心血管保护作用。本研究通过不同剂量的黄芪甲苷作用于培养的血管平滑肌细胞(VSMCs)及RS动物模型,药物作用17 d后取损伤侧颈总动脉,通过HE染色观察血管壁的形态变化,光镜下观察细胞核中内膜增殖细胞核抗原(PCNA)的表达,探讨黄芪甲苷对内膜增生的影响,通过免疫组织化学技术半定量分析血小板源性生长因子-BB(PDGF-BB)在新生内膜的表达,探索黄芪甲苷影响内膜增生的具体机制。
1 材料 1.1 主要仪器CO2恒温细胞培养箱(美国Shel lab公司);倒置相差显微镜(日本Olympus公司);电热恒温培养箱(上海跃进医疗器械厂);立式压力蒸汽灭菌器(上海申安医疗器械厂);电子天平(梅特勒-托利多仪器有限公司);Leica自动脱水机、Leica自动染色机、Leica石蜡包埋机、Lica组织切片机、Leica超薄切片机、冰冻切片机、Leica组织展片考片机、Leica石蜡冷冻机(德国Lecia公司);Sunrise酶标仪(奥地利Tecan公司);MoticBA600全自动扫描显微镜及照相系统(中国麦克奥迪公司);Image-proplus software5.0图像分析软件(美国Media Cybernetics公司);电热鼓风干燥箱(上海实验仪器有限公司);Fogarty(2F)球囊导管(美国Edwards Lifescience公司)。
1.2 药品与试剂黄芪甲苷(质量分数98.34%,批号121224),西安旭煌生物技术有限公司;水合氯醛、羧甲基纤维素钠,上海化学试剂公司;二甲苯,天津天河化学试剂公司;苏木精、伊红,天津福晨化学试剂公司;3-氨丙基-3-乙氧基甲硅烷(APES)、即用型SABC免疫组化试剂盒,武汉博士德生物工程有限公司;DAB显色试剂盒,北京中杉金桥生物技术有限公司;一抗PCNA为兔抗鼠,Santa Cruz公司;一抗PDGF-BB为兔抗鼠,Abcam公司;二抗山羊抗兔,Santa Cruz公司。CCK-8试剂盒,碧云天生物技术研究所;肿瘤坏死因子-α(TNF-α),美国Sigma公司。
1.3 实验动物SPF级6~8周龄的雄性SD大鼠,体质量80~120 g,用于制备VSMCs;SPF级SD雄性大鼠50只,体质量250~300 g,用于动物实验;均购于山东济宁鲁抗辰欣药业有限公司实验动物中心,动物使用许可证号SCXK-鲁20130001。实验动物的使用符合伦理学标准。
2 方法 2.1 对大鼠VSMCs增殖的影响 2.1.1 大鼠VSMCs的原代培养及传代培养参照段超等[3]的方法,采用组织贴块法原代培养大鼠VSMCs成功后,然后传代培养VSMCs,传到5代左右进行细胞实验。
2.1.2 VSMCs的鉴定(1) 细胞形态学鉴定:根据VSMCs生物形态学特点,应用倒置相差显微镜观察细胞大小、形态、排列方式、生长特点及生长规律。(2) 免疫组织化学鉴定:用特异性小鼠抗大鼠α-平滑肌肌动蛋白(α-SM-actin)单克隆抗体进行免疫组织化学鉴定,同时设立阴性对照组。按SABC试剂盒和DAB显色试剂盒说明书进行免疫组织化学染色,显微镜下观察及图像分析。
2.1.3 细胞实验分组及处理实验分7组:对照组(培养液中含0.1%DMSO),TNF-α组(不给予药物预处理,单纯给予100 ng/mL TNF-α),TNF-α+黄芪甲苷(0.5 μg/mL)组,TNF-α+黄芪甲苷(5 μg/mL),TNF-α+黄芪甲苷(25 μg/mL),TNF-α+黄芪甲苷(50 μg/mL),黄芪甲苷(50 μg/mL)组。
2.1.4 CCK-8法检测VSMCs增殖能力采用CCK-8法测定各组细胞增殖能力,方法按照试剂盒说明操作,具体如下:选择生长良好的对数生长期VSMCs,按胰酶消化法收集细胞,并用完全培养基制备单细胞悬液,细胞计数板计数并调整细胞浓度约为2×104个/mL,以每孔2 000个细胞(100 μL)接种于96孔细胞培养板中,并将培养板置于37℃、5%CO2培养箱中常规培养24 h。吸弃原培养液,更换无血清的DMEM培养液饥饿培养24 h,使细胞同步于G0/G1期。按“2.1.3”项实验分组更换条件培养液,预先加入不同质量浓度黄芪甲苷(0、0.5、5、25、50 μg/mL)孵育2 h后,再加入TNF-α(100 ng/mL),TNF-α组和黄芪甲苷(50 μg/mL)组分别加入相应的1种药物,每组设3个复孔。加药完毕后,将培养板置于培养箱中继续孵育至24、48、72 h。吸尽孔内上清液,每孔加入新鲜培养液100 μL,避光加入CCK-8工作液10 μL,继续孵育2 h。选择450 nm波长,在酶标仪上测定各孔吸光度(A)值,记录结果并分析。
2.2 对颈动脉球囊损伤模型大鼠的影响 2.2.1 颈动脉球囊损伤模型的制备依据文献报道[4]方法,在手术前动物禁食12 h,采用10%水合氯醛3 mg/kg ip麻醉,仰卧位固定,取颈部正中切口,暴露左侧颈总动脉、颈外和颈内动脉。显微血管夹夹闭颈总及颈内动脉,结扎颈外动脉远心端,在近心端做切口送入2F Fogarty球囊导管至颈总动脉,注入0.1 mL生理盐水充盈球囊,扩张至动脉外径2倍,重复3次剥脱内皮,退出导管,结扎左侧颈外动脉,缝合皮肤。假手术组不插入球囊导管,其余手术操作相同。术后3 d内ip青霉素(每只20万U)预防感染。
2.2.2 动物分组及给药采用随机数字表法将50只健康成年雄性SD大鼠随机分为假手术组,模型组,黄芪甲苷低、中、高剂量(20、40、60 mg/kg)组,每组10只。假手术组与模型组大鼠ig等量生理盐水,黄芪甲苷各组分别ig相应剂量的黄芪甲苷。造模前3 d开始给药,每天1次,连续给药17 d。
2.2.3 取材术后第15天,大鼠禁食禁水12 h,麻醉大鼠,取损伤侧颈总动脉,PBS缓冲液中洗去血液,放入4%多聚甲醛溶液中固定24 h,然后逐级经70%、80%、95%、100%乙醇脱水,二甲苯透明、浸蜡等步骤后,垂直石蜡包埋,制成蜡块,切片后进行HE染色。
2.2.4 光镜下观察血管壁形态经过HE染色的切片组织,细胞胞浆为红色,胞核为蓝色。光镜下,可以看到组织由平滑肌细胞和纤维构成。内弹力板以内为内膜,外弹力板以外为外膜,内外弹力板之间为中膜。100倍光镜下拍照,保存。依据文献中描述的方法[5],采用Image-proplus software5.0图像分析软件用鼠标画出内弹力板、外弹力板和管腔的轮廓,计算管腔面积、内弹力板围绕面积和外弹力板围绕面积,并分别计算管腔面积、内膜面积(内弹力板围绕面积减去管腔面积)、内膜面积/中膜面积(外弹力板围绕面积减去内弹力板围绕面积)。以该3项指标反映血管的狭窄程度和内膜的增生程度。
2.2.5 免疫组织化学染色检测PCNA和PDGF-BB的表达将颈总动脉石蜡块切成4 μm切片,放入40℃水中,防脱载玻片捞片,放入烤箱中烤干。二甲苯I、II中各脱蜡5 min,分别放入100%、95%、85%、75%乙醇逐级脱水各2 min。配制好的灭活剂灭活内源性酶5 min后,PBS缓冲液洗3次。将枸橼酸盐缓冲液倒入高压锅内,加热3 min,冷却后PBS缓冲液洗3次。常温下用山羊血清封闭15 min,完毕后不甩,只把多余液体擦掉。加入稀释至1:200的一抗,37 ℃孵育1 h,PBS缓冲液洗3次。加入稀释至1:300的二抗,37℃孵育20 min,用PBS缓冲液洗3次,每次2 min。37 ℃条件下滴加SABC试剂,作用20 min,用PBS缓冲液洗3次,每次5 min。滴加DAB显色剂,控制反应时间,最佳状态下终止反应。用苏木素复染,经过脱水,透明,封片后镜下观察。镜下观察PCNA的表达位于平滑肌细胞的细胞核,阳性表达为胞核染为棕色。每张切片在400倍视野下,选取5个视野,应用Image-proplus software5.0图像分析软件计数分析功能,计算新生内膜中阳性细胞个数占全部细胞的比例,即PCNA阳性细胞标记指数。PDGF-BB细胞因子表达于细胞核及细胞浆,阳性表达为胞浆、胞核棕色。采用Image-proplus software5.0图像分析软件以积分吸光度值表示该蛋白的相对量。400倍视野下拍照,校正积分吸光度值;选定阳性区域,将背景转换为白色,新的图片转换为八灰度图片,记录软件的读数,即为累积吸光度值。
2.3 统计学分析通过SPSS 13.0统计软件进行分析,数据采用x±s表示,多组间计量资料应用单因素方差分析(One-way ANOVA),然后用SNK法进行组平均数的两两比较。
3 结果 3.1 VSMCs原代细胞、传代细胞生长状况大鼠胸主动脉组织块接种于培养瓶4~7 d后,倒置显微镜下可见90%的组织块边缘有细胞呈放射状爬出,向外生长形成细胞晕,进而形成细胞簇。细胞形态多样,折光性强。第8~10天,可见细胞布满瓶底,细胞密度低时呈单层平行排列、交织呈网状,密度高时则多层重叠、呈旋涡状或栅栏状,由此形成典型的“峰-谷”状生长结构(图 1)。原代细胞生长状况良好,能够满足实验要求。经过细胞纯化和多次传代后,逐步排除了成纤维细胞和内皮细胞的生长,而平滑肌细胞生长越来越占优势,5代左右平滑肌细胞的纯度达98%以上。在连续多代培养后,大部分细胞生长状态良好,生长方式和形态特点同原代细胞一致(图 1)。共计数1 000个细胞,其中28个细胞台盼蓝染色阳性,约有97%以上的细胞染色阴性,表明培养的细胞消化传代成活率较高,能够用于后续研究。

|
图 1 VSMCs原代细胞和传代细胞形态 Fig.1 Morphology of primary and sub-culture VSMCs |
3.2 VSMCs鉴定
形态学观察:倒置显微镜下观察原代VSMCs形态多样,呈长梭形、三角形或不规则形等,有长短不一的细胞突起;胞浆丰富,均质透明;胞核卵圆形,居中,可见2~3个核仁;折光性强。细胞密度高时可见典型的“峰-谷”状生长结构。
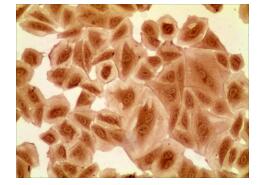
免疫细胞化学鉴定:平滑肌细胞经α-SM-actin抗体免疫化学染色后显示,98%以上的细胞染色阳性,即胞浆呈现棕黄色反应,表明细胞含有肌动蛋白,为VSMCs(图 2),能够用于后续研究。
|
图 2 VSMCs免疫细胞化学染色 Fig.2 Immunocytochemical staining of VSMCs |
3.3 对TNF-α诱导的VSMCs增殖能力的影响
图 3结果显示,终质量浓度为100 ng/mL TNF-α刺激VSMCs至预定时间后,A值增加,细胞增殖明显,与对照组相比,差异显著(P<0.001),随着时间的延长,增殖能力呈上升趋势。加入黄芪甲苷(0.5、5、25、50 μg/mL)预处理可明显抑制TNF-α所诱导的细胞增殖,各时间点的A值与单独TNF-α组相比明显下降,且50 μg/mL黄芪甲苷干预72 h时抑制VSMCs生长作用最强(P<0.001),提示黄芪甲苷在0.5~50 μg/mL内对VSMCs增殖的抑制作用呈明显的时间与剂量依赖性。上述结果表明,黄芪甲苷在TNF-α诱导的VSMCs增殖过程中发挥负性调节作用。而单纯50 μg/mL黄芪甲苷组与对照组比较差异无统计学意义(P>0.05),说明黄芪甲苷对正常培养的VSMCs增殖无调节作用。

|
与对照组比较:***P<0.001;与TNF-α组比较:#P<0.05 ##P<0.01 ###P<0.001 ***P < 0.001 vs control group; #P < 0.05 ##P < 0.01 ###P < 0.001 vs TNF-α group 图 3 黄芪甲苷对TNF-α诱导的VSMCs增殖能力的影响(x±s, n=3) Fig.3 Effect of AS-IV on VSMCs proliferative capacity under TNF-α-stimulated conditions(x±s, n=3) |
3.4 对颈动脉球囊损伤大鼠颈动脉内膜增生的影响
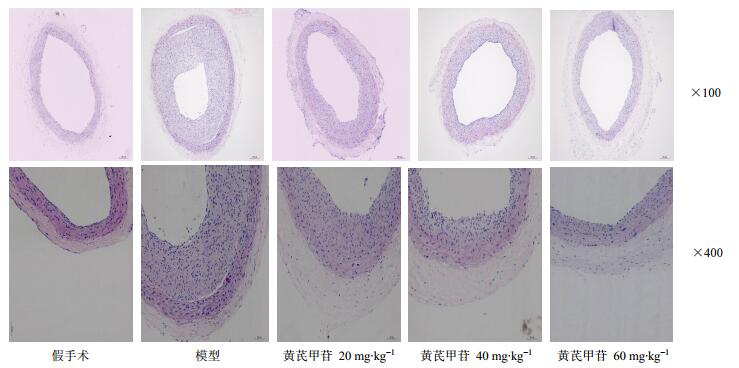
低倍光镜下可见模型组大鼠颈动脉管腔狭窄,内膜明显增生、变厚;而不同剂量黄芪甲苷干预后,颈动脉内膜呈剂量依赖性地逐渐变薄,内膜增厚减轻。高倍镜下可见,模型组大鼠颈动脉内膜靠近管腔侧的平滑肌细胞形态并不规则,排列也不整齐,而细胞核明显大于正常平滑肌细胞。内弹力板处可见平滑肌细胞,胞核小,排列紧密,黄芪甲苷呈剂量依赖性抑制大鼠颈动脉内膜增生。结果见图 4。
|
图 4 各组大鼠颈动脉血管壁形态(HE染色) Fig.4 Morphology of wall of carotid artery of rats in each group (HE stainin) |
与假手术组比较,模型组管腔面积显著降低(P<0.01),内膜面积、内膜面积/中膜面积均显著升高(P<0.01);与模型组比较,黄芪甲苷(20、40、60 mg/kg)均抑制了大鼠颈动脉内膜的增生,使管腔面积较模型组显著增加(P<0.05、0.01),而内膜面积、内膜面积/中膜面积较模型组显著降低(P<0.05、0.01)。结果见表 1。
|
|
表 1 黄芪甲苷对颈动脉球囊损伤大鼠颈动脉内膜增生的影响(x±s) Table 1 Effects of AS-IV on intimal hyperplasia of rat carotid artery after balloon injury (x±s) |
3.5 对颈动脉球囊损伤大鼠颈动脉内膜PCNA阳性表达的影响
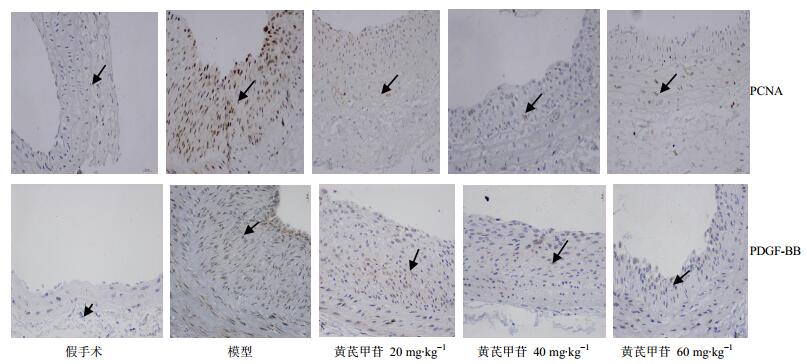
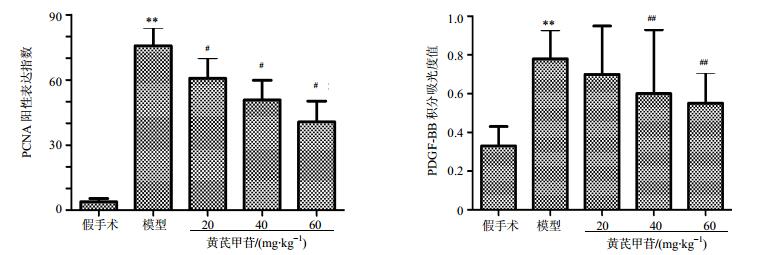
普通光镜下显示,PCNA在平滑肌细胞的胞核中表达,阳性细胞核为棕色,在假手术组中表达量很低,而模型组新生内膜中阳性表达指数明显升高(P<0.01),低、中、高剂量黄芪甲苷组对内膜中PCNA的表达均有抑制作用,阳性表达指数均较模型组显著降低(P<0.05)。结果见图 5和图 6。
|
箭头所示为阳性表达 The arrow indicated positive expression 图 5 PCNA和PDGF-BB在颈总动脉球囊损伤14 d后内膜中的阳性表达(免疫组织化学染色) Fig.5 Positive expression of PCNA and PDGF-BB in intima common carotid artery after balloon injuriy in 14 d (immunohistochemical staining) |
|
图 6 黄芪甲苷对颈动脉球囊损伤大鼠新生内膜中PCNA和PDGF-BB阳性表达的影响 Fig.6 Effect of AS-IV on positive expression of PCNA and PDGF-BB in intima of common carotid artery after balloon injury in 14 d |
3.6 对颈动脉球囊损伤大鼠颈动脉内膜中PDGF-BB阳性表达的影响
假手术组中,细胞因子PDGF-BB有少量的阳性表达,大鼠颈动脉球囊损伤后PDGF-BB表达明显升高。模型组新生内膜中有大量的PDGF-BB的阳性表达,与假手术组比较,差异显著(P<0.01)。黄芪甲苷低、中、高剂量组PDGF-BB表达均下降,其表达累积吸光度值均显著低于模型组(P<0.05、0.01),且随着黄芪甲苷剂量增加,抑制作用更显著。结果见图 5和图 6。
4 讨论近年来,PCI已经发展成为冠状动脉粥样硬化性心脏病(CHD)最有效的治疗方法之一[6]。尽管支架制作工艺和材料不断改进,支架内RS发生率从最初的裸金属支架时代的40%~50%降至目前的药物涂层支架的5%~10%,但RS仍为PCI术的主要并发症[7],因此寻找一种能够保护血管内皮、防治冠脉球囊扩张术后RS的药物仍然具有重要的临床意义[8]。黄芪甲苷是从传统中药黄芪中分离得到的一种具有多种药理活性的皂苷类化合物,近年来对黄芪甲苷的研究从器官组织水平到细胞分子水平不断深入,对其药理活性及药动学特点也有了更为广泛的认识[9-10]。虽有报道黄芪甲苷可通过干涉细胞分裂周期、促进细胞凋亡和提高平滑肌肌动蛋白的表达来抑制高糖诱导的VSMCs增殖[11];但黄芪甲苷对血管损伤后VSMCs增殖迁移的影响及其相关作用机制尚少报道。本研究通过TNF-α诱导平滑肌细胞增殖,然后通过黄芪甲苷干预探讨黄芪甲苷对血管平滑肌细胞增殖的影响,再通过建立球囊损伤大鼠颈动脉内膜模型,模拟支架植入血管损伤模型,用不同质量浓度的黄芪甲苷干预,从细胞及动物模型水平探讨黄芪甲苷对颈动脉内膜损伤的保护作用。
目前普遍认为RS主要发生机制是VSMCs的过度增殖与迁移、内皮细胞损伤、血管弹性回缩、持续存在的炎症反应和血管重构[12]。VSMCs作为一种多功能性间叶细胞,是构成大、中血管的主要细胞类型,当血管壁特别是血管内膜受到损伤后,VSMCs在各种刺激因素作用下发生表型转换并进入分裂周期,此种状态下的VSMCs可从血管中膜游走到内膜并在此大量分裂增殖,若能抑制这些细胞的增殖就能有效防止新生内膜的形成。根据分化程度的不同,VSMCs可分为2种表型:分化完全的收缩型和分化不完全的合成型,这2种表型具有高度可塑性,在一定条件下可以相互转化。研究表明,VSMCs由静止收缩型向合成分泌型转化,并由血管中膜向内膜迁移、增殖这一过程是RS形成的关键性起始步骤,既往研究显示[13],血管成形术后4 d VSMCs开始增殖,并由收缩型转变为合成型,7 d后VSMCs开始向内膜下迁移、增殖并形成新生内膜,14 d后新生内膜中的细胞外基质(ECM)逐渐增多。因此,VSMCs已成为PCI术后RS防治工作的重要靶细胞之一。有证据表明[14],VSMCs在体外经传代培养后,会向合成型转化,据此,采用体外培养大鼠胸主动脉VSMCs,应用重组大鼠生长因子TNF-α诱导VSMCs发生表型转化,模拟血管损伤时VSMCs的移行增殖,从而建立体外细胞实验模型。本实验结果显示:在100 ng/mL TNF-α刺激作用下,VSMCs增殖活性与未给予任何干预措施的对照组相比,VSMCs增殖能力明显提高,提示细胞因子TNF-α促进了VSMCs的增殖,此结论与已有研究结果一致[15]。为了探寻黄芪甲苷能否有效抑制TNF-α诱导的VSMCs增殖,本研究使用不同质量浓度的黄芪甲苷干预TNF-α刺激的VSMCs,采用CCK-8法检测细胞增殖能力,结果表明在药物干预达到24、48、72 h,随着时间的延长及黄芪甲苷药物质量浓度的增加,细胞增殖被抑制越明显,黄芪甲苷以时间与浓度依赖方式拮抗了TNF-α对VSMCs的促增殖作用。因此,黄芪甲苷可以通过抑制VSMCs的增殖来预防RS的发生。这与Yuan等[16]的报道相一致,但不同的是,Yuan在研究中以高糖作为刺激因素,以此来模拟糖尿病动脉粥样硬化的发生,而本研究以TNF-α作为刺激因素,以此来模拟血管损伤后VSMCs的增殖。李丽等[11]研究报道黄芪甲苷可通过清除氧自由基和逆转细胞内钙超载对阿霉素引起的心肌损伤发挥保护作用。Zhang等[17]研究发现黄芪甲苷可通过激活内皮依赖的NO-CGMP信号传导途径、减少细胞内钙离子(Ca2+)的释放和流动来对抗氯化钾和苯肾上腺素引起的大鼠主动脉环收缩。Liu等[18]研究表明黄芪甲苷可通过抑制肝星形细胞增生和胶原合成来对抗猪血清诱导的肝细胞纤维化。马海涛等[19]则通过建立过氧化氢诱导的人脐静脉内皮细胞(HUVECs)氧化应激损伤细胞模型,观察到不同质量浓度的黄芪甲苷预处理对HUVECs有保护作用。
在细胞实验证实黄芪甲苷可以抑制VSMCs的过度增生后,又通过球囊损伤颈动脉内膜建立颈动脉损伤模型模拟支架植入导致动脉内膜损伤,从动物水平探讨黄芪甲苷对内膜损伤的作用及可能机制。研究表明,内膜损伤导致内膜的过度增生,内膜增生发生发展的过程实际上是机体的一种修复血管内皮损伤的反应,该过程的始动因素便是内皮细胞的剥脱[20-21]。研究表明大鼠血管内皮损伤后发生RS的机制与人类介入术后再狭窄发生机制相似,球囊损伤24 h血管平滑肌细胞便可出现增殖和迁移,14 d增殖达最高峰,可靠的内膜增生已经形成。以往的细胞实验证明黄芪甲苷具有抑制血管平滑肌细胞增殖的作用,但体内实验未有报道。本实验通过应用不同质量浓度黄芪甲苷干预大鼠颈动脉球囊损伤导致血管狭窄的动物模型,血管HE染色结果显示球囊损伤组较假手术组管腔面积显著减小,内膜面积和内膜面积/中膜面积显著增大,而黄芪甲苷使内膜面积和内膜面积/中膜面积显著降低,从形态学角度表明其通过抑制血管内膜面积、内膜面积/中膜面积在体内具有抑制内膜增生的作用。实验中黄芪甲苷剂量参照相关文献设置[17]。既往体外实验表明,黄芪甲苷从降低平滑肌细胞增殖活力和诱导细胞凋亡方面抑制平滑肌细胞的增殖,改善血管重构,与本实验结果一致。杨勇等[22]研究发现黄芪甲苷抑制异常血管平滑肌细胞的增殖是通过抑制醛糖还原酶活性、增加一氧化氮产生的途径实现。
PCNA合成、表达在增殖的细胞核,很少出现在静止细胞中,其表达与细胞DNA复制有关,是细胞进行DNA复制和分裂增殖的表现。因此,测定其表达量可以很好地评价血管平滑肌细胞的增殖状态[23]。本实验中,模型组大鼠颈动脉球囊损伤后14 d新生内膜中PCNA的量最高,其分布具有“内疏外密”的特点,管腔侧较近弹力板侧稀疏,表明平滑肌细胞由外向内增殖和迁移,这与其他研究得出的平滑肌向内膜迁移的结论是一致的。在黄芪甲苷用药组,新生内膜中PCNA表达受到抑制,说明黄芪甲苷是通过抑制平滑肌细胞的增殖和迁移,从而发挥抑制新生内膜的增殖作用。
既往研究表明[23]在冠脉球囊扩张术后,血小板活化释放的PDGF等分子刺激中层VSMC迁移和增殖,导致一系列修复反应,这些自身修复反应,加重支架内RS的发生。PDGF-BB可直接作用于平滑肌细胞的受体上,激活细胞信号的传导通路,最终导致基因过量表达,使细胞过度增殖。因此,如果某类药物能够抑制这类生长因子的表达,便可抑制内膜的过度增生[24]。PDGF-BB是目前公认的平滑肌细胞增殖、迁移的最强的刺激生长因子,在血管内膜的过度增生过程中可能起主要作用。损伤的内皮细胞、激活的巨噬细胞、血管平滑肌细胞能够释放大量该生长因子,其与靶细胞受体结合后,一方面可以使细胞由静止期进入增殖期,直接促使平滑肌细胞增殖、迁移[25],另一方面可以激活RAS通路、磷脂酰肌醇-3激酶通路,介导平滑肌细胞的增殖。血管内皮细胞损伤早期,大量血小板聚集、黏附,释放PDGF-BB,在PDGF-BB刺激下,平滑肌细胞表型发生变化,由收缩型转化为合成型,并迁移到内膜。因此,拮抗该因子的表达或者阻断其通路的传导,便可能抑制血管损伤后内膜的增生,达到抗RS的目的。本实验表明黄芪甲苷抑制了PDGF-BB在新生内膜中的表达,黄芪甲苷对此生长因子的抑制与抑制PCNA表达的趋势是一致的,说明该因子在平滑肌细胞的增殖、迁移过程中起到了关键作用。ten Freyhaus等[26]研究发现通过加入氧化酶抑制剂能够减轻PDGF诱导的平滑肌细胞增殖迁移。因此,黄芪甲苷通过抑制PDGF-BB的表达,从而抑制了PDGF-BB诱导的血管平滑肌细胞的增殖迁移,进而减轻内膜的增生,保护血管的内皮细胞,起到预防血管RS的作用。
本研究通过应用黄芪甲苷干预TNF-α刺激的VSMCs增殖及大鼠颈动脉球囊损伤模型,从细胞及动物水平说明黄芪甲苷具有抑制血管内皮损伤后细胞及内膜增生的作用,从PDGF-BB的表达情况说明其具有抑制生长因子表达的作用,进而减轻平滑肌细胞增殖、迁移,防止内膜过度增生。这些为黄芪甲苷防治血管RS方面的应用提供了一些理论依据,但是黄芪甲苷抑制生长因子的表达可能只是抑制内膜增生复杂机制的一部分,其详细的机制仍需进一步深入研究。
| [1] | 魏亚静, 王阿利. 药物洗脱支架植入后冠状动脉支架内再狭窄的相关因素分析以及相应防治措施[J]. 现代中西医结合杂志 , 2016, 25 (10) :1118–1120. |
| [2] | Chen K, Chen Q J, Wang L J, et al. Increment of HFABP level in coronary artery in-stent restenosis segments in diabetic and nondiabetic minipigs:HFABP overexpre-ssion promotes multiple pathway-related inflammation, growth and migration in human vascular smooth muscle cells[J]. J Vasc Res , 2016, 53 (1/2) :27–38. |
| [3] | 段超, 陈鑫, 邱志兵, 等. 大鼠胸主动脉血管平滑肌细胞的原代培养和鉴定[J]. 临床肺科杂志 , 2010, 15 (4) :468–470. |
| [4] | Tulis D A. Rat carotid artery balloon injury model[J]. Methods Mol Med , 2007, 139 :1–30. DOI:10.1007/978-1-59745-571-8 |
| [5] | Du J R, Li X, Zhang R, et al. Tanshinone inhibits intimal hyperplasia in the ligated carotid artery in mice[J]. J Ethnopharmacol , 2005, 98 (3) :319–322. DOI:10.1016/j.jep.2005.01.038 |
| [6] | Banning A P, Baumbach A, Blackman D, et al. Percutaneous coronary intervention in the UK:recommendations for good practice 2015[J]. Heart , 2015, 101 (Suppl 3) :1–13. DOI:10.1136/heartjnl-2015-307821 |
| [7] | Byrne R A, Joner M, Kasrati A. Stent thrombosis and restenosis:what have we learned and where are we going? The andreas grüntzig lecture ESC 2014[J]. Eur Heart J , 2015, 36 (47) :3320–3331. DOI:10.1093/eurheartj/ehv511 |
| [8] | Katz G, Harchandani B, Shah B. Drug-eluting stents:the PAS, present, and future[J]. Curr Atheroscler Rep , 2015, 17 (3) :1–11. |
| [9] | 杨娟, 王洪新, 张英杰, 等. 黄芪甲苷对异丙肾上腺素致乳鼠心肌细胞肥大的影响及其机制[J]. 中草药 , 2013, 44 (21) :3018–3023. |
| [10] | 黄小平, 欧阳国, 丁煌, 等. 黄芪甲苷与三七有效成分配伍对小鼠脑缺血再灌注后神经细胞凋亡和内质网应激的影响[J]. 中草药 , 2015, 46 (15) :2257–2264. |
| [11] | 李丽, 陶辉宇, 陈杰斌, 等. 黄芪甲甙保护阿霉素心肌损伤大鼠抗凋亡作用的机制研究[J]. 中国中西医结合杂志 , 2006, 26 (11) :1011–1014. |
| [12] | de Caterina A R, Cuculi F, Banning A P. Incidence, predictors and management of left main coronary artery stent restenosis:a comprehensive review in the era of drug-eluting stents[J]. Eur Intervent , 2013, 8 (11) :1326–1334. |
| [13] | Zhang W D, Bai H Z, Sawa Y, et al. Association of smooth muscle cell phenotypic modulation with extracellular matrix alterations during neointima formation in rabbit vein grafts[J]. J Vasc Surg , 1999, 30 (1) :169–183. DOI:10.1016/S0741-5214(99)70189-8 |
| [14] | Zhang J, Wang L, Fu W, et al. Smooth muscle cell phenotypic diversity between dissected and unaffected thoracic aortic media[J]. J Cardiovasc Surg (Torino) , 2013, 54 (4) :511–521. |
| [15] | Guo L, Ning W, Tan Z, et al. Mechanism of matrix metalloproteinase axis-induced neointimal growth[J]. J Mol Cell Cardiol , 2014, 66 :116–125. DOI:10.1016/j.yjmcc.2013.11.014 |
| [16] | Yuan W, Zhang Y, Ge Y, et al. Asragaloside IV inhibits proliferation and promotes apoptosis in rat vascular smooth muscle cells under high glucose concentration in vitro[J]. Planta Med , 2008, 74 (10) :1259–1264. DOI:10.1055/s-2008-1081290 |
| [17] | Zhang W D, Zhang C, Liu R H, et al. Preclinical pharmacokinetics and tissue distribution of a natural cardioprotective agent Asragaloside IV in rats and dogs[J]. Life Sci , 2006, 79 (8) :808–815. DOI:10.1016/j.lfs.2006.02.032 |
| [18] | Liu H, Wei W, Sun WY, et al. Protective effects of asragaloside IV on porcine-serum-induced hepatic fibrosis in rats and in vitro effects on hepatic stellate cells[J]. J Ethnopharmacol , 2009, 122 (3) :502–508. DOI:10.1016/j.jep.2009.01.035 |
| [19] | 马海涛, 王辉. 黄芪甲苷对过氧化氢诱导损伤的人脐静脉内皮细胞的保护作用[J]. 郑州大学学报:医学版 , 2016, 51 (2) :248–251. |
| [20] | Qi-Hua L, Qi Z, Yu Z, et al. Long-term effect of second-generation drug-eluting stents for coronary artery disease, everolimus-eluting versus zotarolimus-eluting stents:a meta-analysis[J]. Coron Artery Dis , 2015, 26 (3) :59–65. |
| [21] | Shi N, Chen S Y. Mechanisms simultaneously regulate smooth muscle proliferation and differentiation[J]. J Biomed Res , 2014, 28 (1) :40–46. DOI:10.7555/JBR.28.20130130 |
| [22] | Yang Y, Xiao S Z, Ge Y K, et al. Inhibitory activity of Asragaloside IV on prolife-ration of aorta vascular smooth muscle cells in rats[J]. Space Med Med Eng , 2011, 24 (2) :79–84. |
| [23] | Wu X, Lu Q. Expression and significance of α-SMA and PCNA in the vascular adventitia of balloon-injured rat aorta[J]. Exp Ther Med , 2013, 5 (6) :1671–1676. |
| [24] | Salabei J K, Hill B G. Implications of autophagy for vascular smooth muscle cell function and plASicity[J]. Free Radic Biol Med , 2013, 65 :693–703. DOI:10.1016/j.freeradbiomed.2013.08.003 |
| [25] | Seo J M, Jin Y R, Ryu C K, et al. JM91, a newly synthesized indoledione derivative, inhibits rat aortic vascular smooth muscle cells proliferation and cell cycle progression through inhibition of ERK1/2 and Akt activations[J]. Biochem Pharmacol , 2008, 75 (6) :1331–1340. DOI:10.1016/j.bcp.2007.11.013 |
| [26] | ten Freyhaus H, Huntgeburth M, Wingler K, et al. Novel Nox inhibitor VAS2870 attenuates PDGF-dependent smooth muscle cell chemotaxis, but not proliferation[J]. Cardiovasc Res , 2006, 71 (2) :331–341. DOI:10.1016/j.cardiores.2006.01.022 |
 2016, Vol. 47
2016, Vol. 47


