2. 湖南农业大学食品科技学院, 湖南 长沙 410128
2. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China
黄花菜Hemerocallis citrina Baroni又称忘忧草、金针菜、柠檬萱草,属于百合科萱草属植物。在我国主要有湖南、陕西、甘肃、山西4个产区,主要品种有30余种[1],湖南省主要产地在祁东县,其黄花菜种植面积占全国的一半以上,总产量达全国总产量的70%以上[2]。黄花菜的花蕾可食用,是我国历史悠久营养丰富的特产蔬菜,其营养价值高,味道鲜美,深受消费者喜爱。
黄花菜鲜用有导致腹泻的报道,并认为是其中的秋水仙碱引起[3]。秋水仙碱最初是从秋水仙的球茎和种子中提取出的一种生物碱[4],由于具有减轻炎性反应而起止痛作用的生物活性,已被开发为治疗急性痛风的药物[5]。秋水仙碱主要存在于秋水仙属Colchicum L.、郁金香属Tulipa L.、萱草属Hemerocallis L.、山慈菇属Iphigenia Kunth[1, 4, 6-8]等百合科植物中。黄花菜自古有“忘忧草”美誉,翟俊乐等[9]研究表明黄花菜具有抗抑郁的作用,Uezu[10]研究表明黄花菜提取物有改善小鼠睡眠的功效,还有研究表明黄花菜中含有微量可用于治疗痛风的秋水仙碱[11],可用薄层色谱板用高效薄层色谱进行扫描,计算出各样品中的秋水仙碱量[12-13];朱礼芳[14]用紫外分光光度计检测黄花菜中秋水仙碱的量;陈志峰[15]采用高效液相色谱仪检测不同品种食用黄花菜中秋水仙碱量,最低量为1.69 μg/g。
参考陈志峰[15]的高效液相方法,向不同黄花菜样品中加入秋水仙碱对照品溶液时均发现在黄花菜HPLC图谱中原来认为是秋水仙碱的出峰位置边上多了一个并不重合的峰,对此本课题组产生了疑惑;同时笔者进行文献检索发现,所能找到最早与黄花菜中秋水仙碱相关的文献出自李宗浩[16]报道描述“本文来稿中有‘鲜黄花菜中毒’的报告······黄花菜中含微量的秋水仙碱”,未能搜索到其引用的报告;何航敏[17]描述“从薄层层析的结果看黄花菜中含生物碱, 但还不能肯定该生物碱就是秋水仙碱······认为黄花菜中含有秋水仙碱型的生物碱”;刘国舜[18]文中“据文献报道:鲜黄花菜中所含的一种无毒的秋水仙碱,经肠胃吸收后,分解成有毒的氧化二秋水仙碱······鲜黄花菜中毒的真正原因尚待进一步探讨”,但这2篇报道并未引用可支持的参考文献;王孚庆[19]的报道提到黄花菜中含有秋水仙碱,同样未见引用可支撑的参考文献;何红平等[20]的综述中并未提到萱草属的黄花菜中含有秋水仙碱,但被刘陈力为[11]作为黄花菜中含有秋水仙碱的依据引用;朱礼芳[14]虽然利用大孔树脂对黄花菜提取物进行提纯,声称得到秋水仙碱纯化物,但却未见核磁等结构确证数据。
基于以上的原因,对食用黄花菜中存有秋水仙碱的结论产生了质疑。旨在质证设计一种高灵敏度、专属性强的HPLC-DAD-Q/TOF MS定性检测方法,对食用黄花菜不同来源、不同部位的鲜材样、冷冻干燥样、加工干燥样不同形态样品,进行秋水仙碱检识。目的在于若能提取到秋水仙碱精确相对分子质量,则设法分离获得该成分结晶后进行NMR等定性鉴定;若未检测到,说明传统说法存疑,应通过后续实验设法分离获得导致误认的成分并确证其结构和是否具有导致腹泻的功能。
1 材料与仪器 1.1 仪器设备1290-6530超高效液相色谱串联四级杆/飞行时间质谱仪(美国安捷伦公司);冷冻干燥机(宁波新芝生物公司);冷冻离心机(德国贺默公司);YS-02小型高速粉碎机(北京燕山正德机械有限公司);超纯水机(贝徕美生物公司);DHG-9246A型电热恒温鼓风干燥箱(上海精宏公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器);真空旋转蒸发仪(IKA公司);分析天平(上海梅特勒-托利多仪器);Xaqua C18色谱柱(北京华谱新创公司);无菌注射器(圣光医用制品有限公司);有机相/水相通用针式滤器及样品瓶(北京八方世纪科技公司);移液枪(艾本德公司)。
1.2 材料与试剂原材料为自采,由湖南中医药大学杨广民教授鉴定为黄花菜Hemerocallis citrina Baroni及玫瑰重瓣秋水仙Colchicum Pleniflorum,其他样本信息见表 1。对照品秋水仙碱(批号101176-201202,中国食品药品检定研究院)、无水乙醇(分析纯)、甲醇(色谱纯)、二氯甲烷(分析纯)、醋酸乙酯(分析纯)、超纯水(由超纯水机制备)。
|
|
表 1 受试样品信息 Table 1 Information of samples |
2 方法 2.1 秋水仙碱对照品溶液的制备
精密称取秋水仙碱对照品25 mg,置25 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀即得1 mg/mL秋水仙碱储备液。用移液枪移取100 μL秋水仙碱储备液至100 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀即得1 μg/mL秋水仙碱对照品溶液。
2.2 供试品溶液的制备 2.2.1 鲜样(SX)前处理取编码SX的供试材料各30 g,共62个样品(SX001~SX062)分别搅碎,分别称取5 g置于具塞磨口锥形瓶中,加入85%乙醇35 mL,膜封口待进一步处理。
2.2.2 冷冻干燥样(SD)前处理取部分编码SX的供试材料各150 g,分别切碎后迅速放置于−80 ℃冰箱内速冻,取出后分别使用小型高速粉碎机迅速打碎使其呈细粉状,置于真空冷冻干燥机中干燥24 h,得到冷冻干燥样品(SD001~SD044)。分别取1 g干粉置于具塞磨口锥形瓶中,按料液比1︰35加入85%乙醇,膜封口待进一步处理。
2.2.3 加工干燥样(SG)前处理取部分编码SX的供试材料各150 g,分别置于烘箱中,在60 ℃左右的温度下将其烘干,与受试样品黄花菜干样中的4个干花样分别使用小型高速粉碎机打碎成粉末,分别得到加工干燥样品(SG001~SG045)。各分别取1 g干粉置于具塞磨口锥形瓶中,按料液比1︰35加入85%乙醇,封口膜封口待进一步处理。
2.2.4 商品黄花菜样(SP)前处理取供试材料中5个不同品牌的商品黄花菜各50 g分别使用小型高速粉碎机打碎成粉末,共得5个样品(SP1~SP5)。分别取1 g干粉置于具塞磨口锥形瓶中,按料液比1︰35加入85%乙醇,膜封口待进一步处理。
2.2.5 秋水仙球样(SS)前处理取供试材料中的秋水仙的球茎3份鲜材各50 g,分别按以上鲜材、冻干样和干燥样处理方法处理得SS1~SS3样品,膜封口待进一步处理。
将上述5组前处理中所有待进一步处理的样品置于25 ℃下超声处理2 h(功率250 W,频率50 kHz),倒出上清液至具塞离心管中,用冷冻离心机离心(10 ℃,6 700 r/min)10 min,再次倒出上清液至具塞离心管,使用无菌注射器吸取2 mL用微孔滤膜滤过(0.22 μm)于液相小瓶中,共制备159个供试品溶液。
2.3 秋水仙碱稳定性试验样品及质量控制样本制备 2.3.1 秋水仙碱稳定性样品制备取850 mL无水乙醇至1 000 mL量瓶中,取10 mL的1 μg/mL秋水仙碱对照品溶液,再用纯水定容至刻度线,摇匀得10 ng/mL秋水仙碱85%乙醇溶液(A1),取35 mL的A1置于100 mL磨口锥形瓶中,经25 ℃超声2 h处理得B0;取35 mL的A1置于250 mL的磨口圆底烧瓶中,经80 ℃回流6 h处理得B0'。
2.3.2 不同黄花菜冻干样的超声与加热回流对秋水仙碱稳定性影响试验样品制备随机选取5个不同来源黄花菜冷冻干燥样品(SD001、SD005、SD009、SD013、SD021)各1 g置于100 mL磨口锥形瓶中,分别加入35 mL A1溶液,分别在25 ℃下超声2 h得B1~B5;取上述对应的冻干样品各1 g至250 mL磨口圆底烧瓶中,分别加入35 mL A1溶液,置于80 ℃水浴回流6 h得溶液B1'~B5'。
2.3.3 秋水仙碱在黄花菜鲜样样本的水介质中超声及沸水水浴后稳定性影响试验样本制备取850 mL超纯水至1 000 mL量瓶中,取10 mL的1 μg/mL秋水仙碱对照品溶液,再用超纯水定容至刻度线,摇匀得10 ng/mL秋水仙碱水溶液(A2)。随机选取一个鲜样(SX024)即刻搅碎后分别称取5 g至2个100 mL磨口锥形瓶中,一份加入35 mL A2溶液在25 ℃下超声2 h得C1;一份加入35 mL A2溶液摇匀静置1 h后在100 ℃下水浴1 h得C1'。每个处理重复3次。
2.3.4 质量控制样品制备取10 ng/mL秋水仙碱对照品溶液35 mL作为对照品质量控制样本D0;用移液枪取0.2 μg/mL秋水仙碱对照品溶液1.75 mL加入到随机选取的“2.2.2”项处理得的SD021提取液33.25 mL,得到35 mL的(X+10)ng/mL(X为黄花菜中假定的秋水仙碱本底量)浓度的黄花菜样品溶液E0。
将上述所有溶液的上清液分别倒出至具塞离心管中,用冷冻离心机离心10 min,再次移出上清液至具塞离心管,用无菌注射器吸取2 mL后换上微孔滤膜过滤(0.22 μm),注入液相小瓶中制备得到A1、A2、B0~B5、B0'~B5'、C1、C1'、D0、E0共18个样品溶液以备稳定性试验。
2.4 富集样品制备500 kg新鲜黄花菜加入1 000 L的85%乙醇在50 ℃下搅拌浸提50 min,重复3次,提取液回收浓缩得50 kg流浸膏(SF001),往其中加入95%乙醇搅拌,不容物完全沉降后,再次取出上清液回收浓缩得浸膏(SF002),取SF001、SF002各1 g,分别加入5 mL甲醇溶解后使用无菌注射器吸取2 mL用微孔滤膜滤过(0.22 μm)于液相小瓶中以待检测。
取适量SF002用硅胶拌样、干燥。依次用二氯甲烷、醋酸乙酯、甲醇对此浸膏粉进行提取并将提取液浓缩制备富集样本(SF003~SF005),该样本还用于下一步分离制备黄花菜中其他成分。
2.5 色谱条件色谱柱:华谱Xaqua C18(150 mm×2.1 mm,5μm);流动相为0.1%甲酸水(A)-0.1%甲酸乙腈(B);体积流量0.3 mL/min;柱温35 ℃;检测波长350 nm和190~400 nm全扫描;进样量2 μL;梯度洗脱:0~3 min,10%~15% B;3~8 min,15%~30% B;8~16 min,30%~65% B;16~21 min,65%~95% B;21~25 min,95% B;25.1~30 min,10% B。
2.6 质谱条件离子源为Dual AJS ESI源;扫描模式:正离子全扫描(Positive scan);全扫范围m/z 100~1 000;毛细管电压4 000 V;鞘气温度350 ℃;鞘气体积流量11.0 L/min;干燥气温度345 ℃;干燥气压力310.275 kPa;干燥气体积流量10 L/min;毛细管电压4 000 V;碎裂电压(Fragmentor)135 V。
2.7 数据处理方法样品均按“2.5”“2.6”项中条件检测。数据采集与处理通过Agilent MassHunter Workstation Software(version B.05.00)软件完成。在样品的总离子流图中提取秋水仙碱分子离子峰(m/z400.175 5),若样品中提取出m/z400.175 5离子色谱峰且保留时间与秋水仙碱对照品一致,则认为样品中存在秋水仙碱,反之不存在。
2.8 HPLC-DAD-Q/TOF MS定性分析黄花菜中秋水仙碱方法学考察 2.8.1 线性关系取对照品溶液,分别制备500、200、100、50、20、10、5、2、1、0.5、0.25、0.125 ng/mL的秋水仙碱对照品溶液,以质量浓度为横坐标(X),以秋水仙碱提取离子峰面积为纵坐标(Y),绘制标准曲线,得到线性回归方程Y=24 642 X+201 140,R2=0.992 8,线性范围为1~500 ng/mL。
2.8.2 检测限为了评价“2.5”“2.6”项色谱和质谱条件对秋水仙碱的检出灵敏度,对秋水仙碱对照品溶液进行逐级稀释,实验结果显示秋水仙碱最低检测限为0.25 ng/mL,此时信噪比为6.4。
2.8.3 精密度考察分别取10、50 ng/mL秋水仙碱对照品溶液连续进样6次,结果显示秋水仙碱的峰面积RSD均小于2%。
2.8.4 稳定性考察对“2.3.1”项中制备样品进行检测分析,秋水仙碱乙醇溶液分别经超声和回流处理后与处理前相比峰面积基本无变化,RSD均小于5%,表明秋水仙碱在乙醇溶液中经超声和回流处理中均有很好的稳定性。
对“2.3.2”项中制备样品进行检测分析,以乙醇为溶剂超声与回流处理,超声处理组秋水仙碱峰面积与A1对比RSD为4.8%;回流组RSD为4.5%。说明黄花菜在乙醇介质中经超声与回流提取2种处理方式对秋水仙碱的稳定性没有影响。
对“2.3.3”项中制备样进行检测分析,秋水仙碱在黄花菜鲜样品的水介质超声处理后与秋水仙碱水溶液(A2)相比秋水仙碱峰面积RSD为0.7%;100 ℃沸水浴处理后RSD为3.5%。说明秋水仙碱在黄花菜鲜样品的水介质中经超声及沸水蒸煮处理后是稳定的。
取“2.3.4”项制备的D0和E0置于室温,在0、2、4、8、16、24 h进样分析,测定秋水仙碱峰面积并计算RSD。结果显示D0的RSD为3.9%,E0的RSD为1.2%,说明该检测方法精密度高,秋水仙碱在室温条件下24 h内稳定。
上述稳定性试验显示基于检测条件下秋水仙碱和水介质中的不同处理方式下均有很好的稳定性。
2.8.5 加样回收率试验取黄花菜粉末1.0 g,共9份,分别置具塞锥形瓶中,分别添加一定量的对照品溶液,使添加水平分别为500、50、5 ng/mL,按供试品溶液的制备方法处理,测定,计算加样回收率。结果表明,高、中、低3个质量浓度的平均加样回收率为97.7%。
3 结果与分析 3.1 秋水仙碱对照品的HPLC-DAD-Q/TOF MS定性分析结果秋水仙碱分子式为C22H25NO6,其在ESI+质谱条件下主要以[M+H]+的形式存在,其理论m/z为400.175 5,从总离子流图中提取[M+H]+ m/z: 400.175 5的提取离子色谱峰,色谱图见图 1。
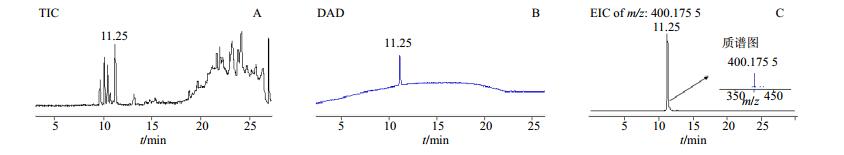
|
A-秋水仙碱总离子流图B-秋水仙碱350 nm紫外吸收色谱图C-秋水仙碱提取离子色谱图及质谱图 A-TIC of Colchicine B-350nm DAD of Colchicine C-EIC and MS of Colchicine 图 1 HPLC-DAD-Q/TOF MS定性分析秋水仙碱对照品的结果 Fig.1 HPLC-DAD-Q/TOF MS analysis on colchicine reference substance |
3.2 秋水仙球茎供试品溶液中秋水仙碱成分的HPLC-DAD-Q/TOF MS定性分析
采用“2.5”“2.6”项中方法对SS1~SS3待测样品进行HPLC-DAD-Q/TOF MS分析。结果(图 2)显示均能检测出秋水仙碱,且响应较高。说明实验所用提取方法以及检测方法可以提取并检测出植物中秋水仙碱。
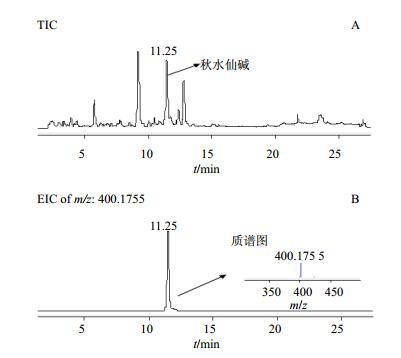
|
图 2 秋水仙球SS2样品HPLC-DAD-Q/TOF MS检测总离子流图(A)及秋水仙碱提取离子色谱图(B) Fig.2 HPLC-DAD-Q/TOF MS TIC (A) and EIC (B) in colchicine of SS2 sample |
3.3 黄花菜供试品溶液中秋水仙碱成分的HPLC-DAD-Q/TOF MS定性分析
取“2.2”项中黄花菜供试样品进行测试,并提取秋水仙碱的理论精确相对分子质量[M+H]+ m/z: 400.175 5,结果显示在所有样本中均未提取到,即未发现秋水仙碱成分。部分供试品样品HPLC-DAD-Q/TOF MS检测总离子流图及秋水仙碱精确相对分子质量离子提取色谱图见图 3,由于供试样品过多,仅随机放出部分样品图谱。检测结果表明,所有黄花菜供试样品均未检测到秋水仙碱。
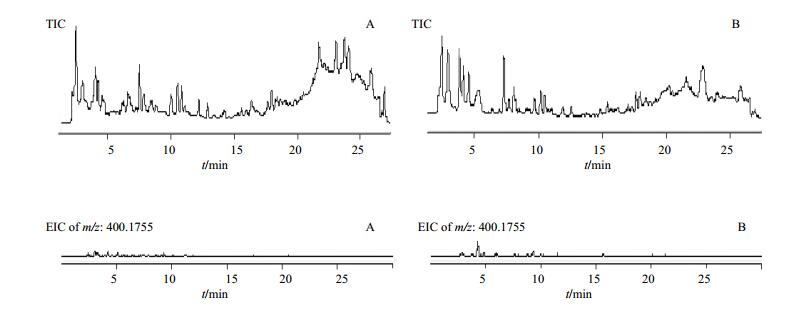
|
图 3 随机供试品样品(A-SD001,B-SD021)总离子流图(TIC)及秋水仙碱提取离子色谱图(EIC) Fig.3 TIC and EIC of random sample to be tested (A-SD001, B-SD021) |
3.4 疑似秋水仙碱成分分析
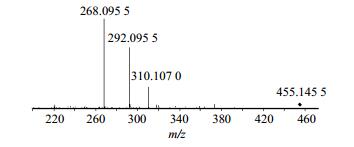
取“2.3”项不同处理的黄花菜与黄花菜样品和秋水仙碱对照品色谱图对比分析后发现黄花菜加标样品总离子流图中在接近秋水仙碱对照品保留时间位置出现1个小的色谱峰(图 4),对该色谱峰质谱图进行分析,为多个化合物的共流出组分,主要离子为m/z 455.145 5,经高分辨质谱分子式生成软件推测其分子式为C23H22N2O8。对主要离子m/z455.145 5进行二级质谱裂解碎片分析见图 5,但暂未能获得结构式,需要通过进一步分离纯化制备得到高纯度单体解析其结构。综上所述,对不同来源黄花菜样品,甚至包括不同部位、不同处理方式(鲜材、冻干、烘干)的样品检测均未发现秋水仙碱的踪迹。可以得出结论:食用黄花菜中没有秋水仙碱的存在。而对于m/z455.145 5这一物质具体是什么,还需对其进行定向分离做进一步研究。
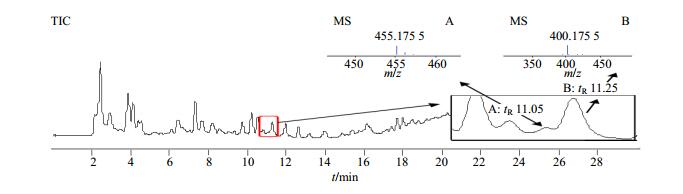
|
A-疑似秋水仙碱色谱峰B-添加的秋水仙碱对照品 A-the chromatogram of suspected compound B-colchicine standard 图 4 黄花菜加标样品中秋水仙碱及其疑似化合物色谱图及质谱图 Fig.4 Chromatogram and mass spectrogram of colchicine and suspected compounds in HC spiked sample |
|
图 5 黄花菜中疑似秋水仙碱化合物(m/z 455.1455)的二级质谱碎片图 Fig.5 MS/MS spectrum diagram of suspected colchicine (m/z 455.145 5) in HC |
4 讨论
本研究通过建立一种专属性强、高灵敏度的HPLC-DAD-Q/TOF MS分析方法检测不同来源黄花菜花、根、花葶和叶中秋水仙碱,均未检出秋水仙碱精确相对分子质量[M+H]+ m/z 400.175 5,而在秋水仙球球茎样品中能检出秋水仙碱。因此有理由相信食用黄花菜样本中应该不含有秋水仙碱,这个结论与所有文献报道黄花菜中含有秋水仙碱的结论相悖。至于是否可能存在未被纳入本研究待测样品的含秋水仙碱的其他黄花菜品种,认为这种可能性很小;对已报道含有秋水仙碱的黄花菜品种如猛子花,通过该研究并未发现有秋水仙碱;考虑到也许是秋水仙碱量过低检测不到的情况,对500 kg新鲜黄花菜富集后得到的黄花菜提取浓缩物(SF样)进行质谱检测时也并未提取到秋水仙碱精确相对分子质量。所以,认为可食用黄花菜中不含有秋水仙碱,传统认为食用鲜黄花菜后腹泻是秋水仙碱引起的这一结论值得商榷。
研究中还发现黄花菜样本HPLC图中与秋水仙碱对照品保留时间接近处有一个明显色谱峰,通过加标样品图谱比较分析,此峰与对照品峰不重叠,说明不是秋水仙碱。进一步对该疑似秋水仙碱的色谱峰进行质谱分析,其为多个化合物的共流出组分,主要化合物[M+H]+质荷比为455.145 5,经数据处理软件推测分子式为C23H22N2O8,可能是含双氮的生物碱。结合文献溯源并未见清晰的样品HPLC色谱图,更未见从黄花菜中分离制备获得秋水仙碱的结晶和该结晶的核磁分析报道,由此推测也许是前人因检测仪器条件有限而推断为秋水仙碱,可能是一个误判。研究小组后续将对此疑似秋水仙碱的化合物进行分离制备得到结晶后,通过核磁等方法做更精准的结构确定,并通过药理实验证明是否具有导致腹泻的功能。
另外,据“2.8.4”项结果中秋水仙碱单独及添加到黄花菜里热稳试验均验证其稳定性良好,说明加热与黄花菜基于秋水仙碱降解脱毒关系不大。针对真正导致腹泻的成分,仍需加强基础研究。目前看来新鲜黄花菜熟制后食用与扁豆熟食等一样是安全的,这对扩大黄花菜鲜菜的流通提供了一定依据。
黄花菜自古被称为“忘忧草”,通常认为其具有促进泌乳、改善睡眠和抗抑郁等作用。若能对这些功效作进一步系统评价研究,开发成保健食品可大大提高黄花菜的综合利用价值,进一步扩大市场从而增加农民收入,均有显著的重要意义。
| [1] | 刘永庆, 沈美娟. 黄花菜品种资源研究[J]. 园艺学报 , 1990, 17 (1) :45–50. |
| [2] | 张西露, 粟建文, 叶英林. 祁东县黄花菜产业发展现状及对策分析[J]. 湖南农业科学 , 2013 (15) :148–151. |
| [3] | 关颖. 中毒患者血清中秋水仙碱的快速检验[J]. 中国卫生检验杂志 , 2001, 11 (5) :625–626. |
| [4] | 李岩, 李晓静, 程雪梅, 等. HPLC法测定秋水仙药材中秋水仙碱[J]. 中成药 , 2013, 35 (1) :203–205. |
| [5] | 吴莹.中药治疗痛风的疗效及不良反应的循证研究[D].广州:广州中医药大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10572-1014359018.htm |
| [6] | 申利红, 李雅. 秋水仙碱的研究与应用进展[J]. 中国农学通报 , 2009, 25 (21) :185–187. |
| [7] | 许国英, 谢玉英, 毛祖美. 新疆郁金香属植物秋水仙碱的调查[J]. 干旱区研究 , 1996, 13 (3) :52–53. |
| [8] | 管伦兴, 储益平. 云南丽江山慈菇品种考证及有效成分秋水仙碱含量的研究[J]. 中药与临床 , 2015, 6 (3) :1–3. |
| [9] | 翟俊乐, 田欢, 李孟秋, 等. 黄花菜抗抑郁作用有效成分的筛选[J]. 中国食品添加剂 , 2015 (10) :93–97. |
| [10] | Uezu E. Effects of Hemerocallis on sleep in mice[J]. Psych Clini Neurosci , 1998, 52 (2) :136–137. DOI:10.1111/j.1440-1819.1998.tb00992.x |
| [11] | 陈力为, 刘雁, 匡琼秀, 等. 超声波法提取黄花菜中秋水仙碱的研究[J]. 湖南城市学院学报:自然科学版 , 2012, 21 (1) :69–71. |
| [12] | 洪亚辉, 成志伟, 李精华, 等. 不同处理方式对鲜黄花菜中秋水仙碱含量变化的影响[J]. 湖南农业大学学报 , 2003, 29 (6) :500–502. |
| [13] | 杨大伟.脱水黄花菜加工工艺研究[D].长沙:湖南农业大学, 2003. http://cdmd.cnki.com.cn/article/cdmd-10537-2003087059.htm |
| [14] | 朱礼芳.黄花菜中秋水仙碱的提取及其抑菌性能研究[D].福州:福建农林大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10389-1013327091.htm |
| [15] | 陈志峰.不同品种黄花菜秋水仙碱含量比较及其亲缘关系鉴定[D].太原:山西农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10113-1014416448.htm |
| [16] | 李宗浩. 植物中毒[J]. 赤脚医生杂志 , 1977 (7) :42–43. |
| [17] | 何航敏. 食用新鲜黄花菜引起食物中毒42例调查[J]. 铁道医学 , 1978 (2) :92. |
| [18] | 刘国舜. 鲜黄花菜致食物中毒27例报告[J]. 学校卫生 , 1989, 10 (2) :53. |
| [19] | 王孚庆. 一起食用新鲜黄花菜致食物中毒的流行病学调查[J]. 人民军医 , 1995 (9) :23–24. |
| [20] | 何红平, 刘复初. 秋水仙碱的研究进展[J]. 中草药 , 1998, 29 (10) :712–714. |
 2016, Vol. 47
2016, Vol. 47


