2. 东北林业大学 森林植物生态学教育部重点实验室, 黑龙江 哈尔滨 150040
2. Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin 150040, China
恶性肿瘤已经成为人类生命健康最危险的杀手,特别是人类对占恶性肿瘤90%以上的实体瘤一直无能为力[1]。喜树碱(camptothecin,CPT)是从中国珙桐科(Nyssaceae)植物喜树Camptotheca acuminata Decne.茎提取物中分离得到的抗癌活性物质[2],它是目前为止发现的唯一1种拓扑异构酶(topoisomerase I)的抑制剂[3-4]。临床研究证实喜树碱对胃癌[5-6]、直肠癌[7-8]、结肠癌[9]和白血病[10-11]等多种恶性肿瘤均有一定的疗效。我国是喜树碱的唯一原产国,目前喜树碱已成为继紫杉醇(paclitaxel)之后第2个由植物衍生的重要抗癌药物[12]。
喜树碱的分子式为C20H16N2O4,相对分子质量为348.34。喜树碱不溶于水,这就造成了它口服后生物利用度低的缺点,严重限制了其在临床中的使用[13-15]。虽然科学家后来通过成盐的方法水解其分子中的酯环,增加了水溶性,开发出了副作用更小的羟基喜树碱(hydroxycamptothecine)等其他喜树碱衍生物的注射液或粉针剂,但却伴随着其抗肿瘤活性的下降[16]。微粉化(micronization)颗粒是解决喜树碱水溶性差的方法之一,药物微粉化后,粒径变小、形态均一、比表面积增大,可以增大其在溶剂中的溶解度[17-18],进而增大其口服生物利用度。本研究利用乳化法,制备了喜树碱微粉,并对制备工艺进行了优化。在最优条件下制得的喜树碱微粉进行了形貌表征、溶出测试和生物利用度评价。
1 仪器与材料MM400型光学显微镜,日本Nikon公司;S4800型扫描电镜(SEM),日本Hitachi公司;Zeta PALS型激光粒度仪,美国布鲁克海文;3k-15型高速离心机,德国Sigma公司;BS110型电子分析天平,德国Sartorius公司;XW-80A旋涡混合器,上海医科大学仪器厂;KQ-250DE型超声机,昆山市超声仪器有限公司;WG500CY型连续式实验室乳化机,上海路诺流体设备制造有限公司;AH-100D型高压均质机,上海ATS工业系统有限公司;2795型高效液相色谱仪,美国Waters公司;液相色谱柱Diamonsil反向柱C18(250 mm×4.6 mm,5 μm),迪马科技有限公司;7890A-5975C型高效气相色谱仪,DB-WAX聚乙二醇毛细管柱(30.0 m×250 μm,0.25 μm),G1540N-210 FID检测器,美国Agilent公司;Scientz-18N型冷冻干燥机,宁波新芝生物科技股份有限公司。
喜树碱,质量分数98.5%,四川广瀚生物技术有限公司;聚山梨酯-80(Tween-80,T80)、乙醚,天津市博迪化工有限公司;聚乙烯吡咯烷酮K30(PVP-K30)、羧甲基纤维素钠(CMC-Na)、羟丙基甲基纤维素(HPMC)、泊洛沙姆188(Poloxamer 188,P188),天津光复精细化工研究所;甲醇、乙腈(色谱纯)、三氯甲烷(分析纯),山东禹王实业有限公司;甘露醇,天津市科密欧化学试剂有限公司;SD大鼠10只,体质量220~250 g,雌性,哈尔滨医科大学;肝素钠,湖北鑫润德化工有限公司;模拟胃液、去离子水,实验室自制。
2 方法与结果 2.1 单因素优化喜树碱初乳 2.1.1 表面活性剂种类对喜树碱初乳平均粒径的影响首先将T80、PVP-K30、CMC-Na、HPMC、P188共5种表面活性剂溶解在水相中,体积分数均为0.2%,药物质量浓度为3 mg/mL,水相与油相体积比(7:3),油相为三氯甲烷-甲醇(8:2),匀浆速率为5 000 r/min,匀浆时间为7 min。在前期预试验中发现,三氯甲烷与甲醇体积比为8:2时对喜树碱具有较好的溶解度,因此选择这个比例。待形成初乳后,检测其粒径。采用激光粒度分析仪进行粒径检测:室温下,样品反应完后用移液枪吸取3 mL放入样品池进行检测。每个试验重复测定3次。结果如表 1所示,T80和HPMC的加入对喜树碱乳剂粒径的影响较为明显。在制备过程中,加入适宜的表面活性剂可对乳滴表面进行改性,在控制乳滴生长和团聚的同时,也可以影响乳滴形貌。加入同样比例的T80和HPMC时粒径最小,然而由于加入T80时多分散系数更小,为0.005 0±0.000 1,得到的粒径更加均匀,故本研究选择以T80作为乳化剂。
|
|
表 1 不同表面活性剂对喜树碱初乳粒径的影响 Table 1 Effects of different kinds of surfactants on particle size of CPT foremilk |
2.1.2 药物质量浓度对喜树碱初乳平均粒径的影响
喜树碱质量浓度分别为1、2、3、4、5 mg/mL时,平均粒径分别为(64.4±5.1)、(135.5±19.3)、(156.1±31.8)、(160.2±21.3)、(213.4±27.6)nm。喜树碱的质量浓度变化对喜树碱乳剂粒径的影响较为明显,喜树碱乳剂粒径大小随着喜树碱的质量浓度增加而增大。喜树碱质量浓度的增加,油相黏度就会增加,乳滴间容易发生团聚,从而导致喜树碱乳剂粒径增大。考虑到工艺效率和成本,更低的喜树碱质量浓度水平没有进行进一步考察。因此以平均粒径作为优选指标,喜树碱的质量浓度选定为1 mg/mL。
2.1.3水相与油相体积比分别为9:1、8:2、7:3、6:4、5:5时,平均粒径分别为(153.4±20.1)、(116.2±5.4)、(42.3±4.6)、(66.7±15.2)、(113.5±15.4)nm。水与三氯甲烷-甲醇的体积比对喜树碱乳剂粒径的影响也较为显著。喜树碱初乳的粒径大小随着水与三氯甲烷-甲醇的体积比的增加而减小,而后随着体积比的进一步增大粒径又随之增大。综合考虑乳剂粒径大小和乳化状态,选取水相与油相体积比7:3作为最优条件。
2.1.4 表面活性剂用量对喜树碱初乳平均粒径的影响表面活性剂的用量分别为0.1%、0.2%、0.3%、0.4%、0.5%时,平均粒径分别为(176.3±22.1)、(138.4±7.5)、(99.7±12.8)、(46.7±5.4)、(135.0±14.1)nm。T80与水的比例对喜树碱乳剂粒径大小有较显著影响,也呈现出随着T80体积分数增加粒径先降低,当T80体积分数为0.4%时,粒径最小为(46.7±5.4)nm,之后再呈增加的趋势。因此,本实验优选T80体积分数为0.4%。
2.1.5 匀浆速率对喜树碱初乳平均粒径的影响匀浆速率对喜树碱乳剂粒径大小也有一定程度的影响。匀浆速率分别为3 000、4000、5 000、6 000、7 000 r/min时,平均粒径分别为(211.4±45.3)、(53.9±2.1)、(55.4±8.4)、(54.2±4.6)、(43.7±5.1)nm。匀浆速率由3 000 r/min提高到4 000 r/min时,平均粒径大幅度减小。匀浆速率处于4 000~7 000 r/min时,乳剂的粒径基本不随匀浆速率变化而变化。综合乳剂粒径和能耗的考虑,4 000 r/min被选择为最佳匀浆速率条件。
2.1.6 匀浆时间对喜树碱初乳平均粒径的影响匀浆时间分别为3、5、7、9、11 min时,平均粒径分别为(60.3±5.1)、(47.5±2.3)、(42.3±4.5)、(37.1±3.6)、(30.4±3.6)nm。随着匀浆时间增加,平均粒径随之逐渐减小。喜树碱乳剂的平均粒径随匀浆时间增加逐渐减小,可能是由于匀浆时间短导致乳化不充分,有些乳滴有团聚现象,因而粒径较大。随着匀浆时间增加,体系得到充分混合乳化,粒径逐渐减小。然而,机械搅拌产生的机械能会传递给乳剂使得乳滴能量增大,为了减小自身的能量,乳滴之间可能会采取相互团聚的方式来减小比表面积进而降低能量,所以匀浆时间也不能过长。因此选择11 min作为最佳条件匀浆时间。
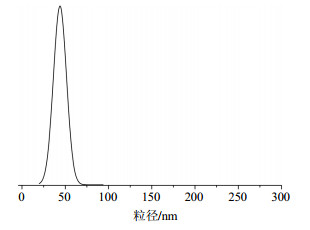
2.2 最优条件下喜树碱初乳的形貌特征通过单因素法得出初步乳化的最优条件:喜树碱的质量浓度为1 mg/mL、水相与油相体积比为7:3、匀浆速度为7 000 r/min、匀浆时间为11 min。在室温下,将在该条件下得到的样品用移液器吸取适量,滴在血球计数板上,采用光学显微镜进行形貌观察,可以清晰地看到均匀的液滴,见图 1。液滴边缘与内部具有一定的色差,这是由水相与有机相透光率的差异导致的。最优条件下得到的喜树碱初乳的粒径大小为(30.3±1.8)nm,如图 2所示。

|
图 1 光学显微镜下的喜树碱初乳状态(10 × 20) Fig.1 Status of CPT foremilk under optical microscope (10 × 20) |
|
图 2 喜树碱初乳的粒径分布 Fig.2 Particle size distribution of CPT foremilk |
2.3 喜树碱纳米乳的高压均质法制备
在喜树碱初乳制备最优条件后,在该条件下,对高压均质制备纳米乳工艺中高压均质压力和次数进行单因素优化。高压均质压力和均质次数分别为20、30、40、50、60 MPa及3、5、7、9、11次。先优化均质压力,均质次数固定为7次。
高压均质压力分别为20、30、40、50、60 MPa时,平均粒径分别为(15.3±1.8)、(15.5±2.1)、(15.7±3.2)、(15.9±3.6)、(18.7±3.4)nm。结果表明,在均质次数一定的情况下,随着压力的增大,粒径小幅度变大,但总体来讲粒径趋于稳定,这是因为经过高速匀浆后得到的喜树碱初乳,粒径已经很小,只是整体稍不均匀,使用高压均质机可以使初乳形成更加均一稳定的纳米粒。因此,只要较小的均质压力便可使喜树碱初乳形成均一稳定的纳米乳剂。
均质次数分别为3、5、7、9、11次时,平均粒径分别为(23.3±1.6)、(20.6±2.1)、(18.6±1.4)、(19.3±2.3)、(20.7±4.5)nm。结果表明,在一定均质压力下,随着均质次数的增加,粒径首先呈下降的趋势。由于均质次数增加,机械作用时间变长,大的乳滴被均质后变小。但当均质次数持续增加,粒径反而随次数的增加而增大。以粒径作为考虑选择高压均质压力20 MPa,均质7次,作为最优条件。
高压均质会使得纳米粒粒径减小、均匀,但高压均质的压力及次数,如果持续增大到某一个值后,纳米粒的粒径反而增大,可能是由于均质压力过高,或均质次数过多,乳状液中的乳滴重新聚集而使粒径增大,有限的乳化剂不能被有效地吸附到所有粒径表面,乳化作用下降,粒子液滴相互聚集,会出现粒径增大以及不稳定现象。
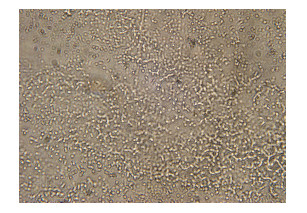
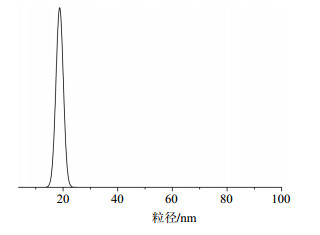
2.4 最优条件下喜树碱乳剂的形貌特征乳化均质后,用光学显微镜直接观察微乳的状态,如图 3所示,喜树碱纳米乳呈现近似球形的形貌,且颗粒大小比较均匀。最优条件下得到的喜树碱乳剂粒径大小为(18.7±1.3)nm,如图 4所示。
|
图 3 光学显微镜下的喜树碱纳米乳状态(10 × 20) Fig.3 Status of CPT nanoemulsion under optical microscope (10 × 20) |
|
图 4 喜树碱纳米乳的粒径分布 Fig.4 Particle size distribution of CPT nanoemulsion |
2.5 形貌、粒径表征及再分散性考察
获得最佳工艺条件制备的喜树碱纳米乳后,旋转蒸发法去除其中的有机溶剂即得到喜树碱纳米混悬剂,然后分别加入喜树碱用量5倍的甘露醇,混匀,在−40 ℃的低温冰箱中预冻2 h、真空冷冻干燥机中冷冻时间为48 h,即得喜树碱微粉。原粉用双面导电胶粘在观察台上喷金;喜树碱微粉用水复溶后滴在锡箔纸上,置于超净工作台内吹干,在氩气保护下进行喷金即可进行形貌观察。
图 5-A显示喜树碱原粉呈不规则片状,粒径在1~60 μm。甘露醇呈长条状,长度达几十微米(图 5-B)。喜树碱微粉(图 5-C)呈现细小颗粒状,被甘露醇包裹,颗粒大小比较均匀。由于喜树碱在碱性条件下容易开环,相对的酸性条件下会更加稳定,所以喜树碱微粉口服制剂经过胃肠道低pH值环境要比其衍生物的注射针剂稳定性更好一些。

|
图 5 喜树碱原粉(A)、甘露醇(B)和喜树碱微粉(C)的SEM检测 Fig.5 SEM images of raw CPT (A), mannitol (B), and CPT micronized powder (C) |
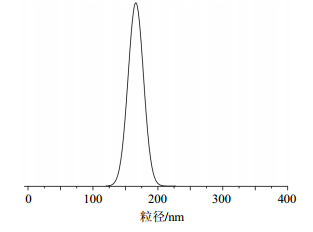
如图 6所示,喜树碱原粉(左)和微粉(右)在水中的分散情况,二者喜树碱用量一致,可以看出微粉复溶后状态良好,半透明且泛有乳光。用水复溶后,药物平均粒径大小测试为(165.5±5.3)nm,且分布很均匀,如图 7所示。

|
图 6 喜树碱原粉(左)和喜树碱微粉(右)在水中的分散性 Fig.6 Dispersion appearances of raw CPT (left) and CPT micronized powder (right) in water |
|
图 7 喜树碱微粉粒径分布图 Fig.7 Particle size distribution of CPT micronized powder |
2.6 溶出研究
搅拌速度和溶液温度分别控制在100 r/min和(37.0±0.5)℃,溶出介质选用模拟胃液。测平衡溶解度时加入过量样品,搅拌48 h后取上清过0.22 μm滤膜进HPLC检测。测溶出时将含有39 mg喜树碱的2组样品分别添加到500 mL溶出介质当中,在5、10、15、30、45、60、120、240 min时间点上取样品溶液5 mL,再补充相同体积溶出介质。取出的样品溶液用0.22 μm滤膜滤过除去杂质颗粒,得到滤液进HPLC检测药物浓度。检测条件如下:流动相组分为乙腈-水(40:60),体积流量1.0 mL/min,检测波长254 nm,进样量10 μL,柱温为室温。
HPLC结果显示喜树碱原药的饱和溶解度为92.46 μg/mL,喜树碱微粉的为218.28 μg/mL。图 8显示了喜树碱原药和微粉的溶出特性,与喜树碱原药对比,喜树碱微粉显示出了更快的溶出速率。喜树碱原粉由于水溶性差,未能完全溶解,45 min时仅溶出8.09%,而此时,喜树碱微粉已溶出72.48%。240 min时微粉溶出93.22%,而原粉仅为18.33%。喜树碱微粉的溶出速率较原药提高了4.09倍。
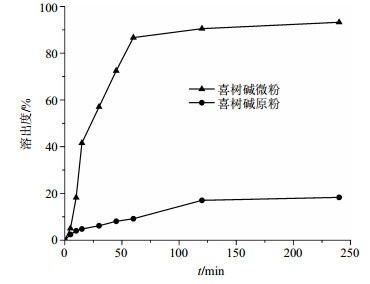
|
图 8 喜树碱原药和微粉在模拟胃液中的溶出曲线 Fig.8 Dissolution profiles of raw CPT and CPT micronized powder in simulated gastric fluid |
2.7 大鼠体内生物利用度评价
将10只大鼠随机分为2组,将大鼠在相同的温度、湿度、饮食条件下,饲养1周。实验前12 h禁食,自由饮水。根据大鼠的体质量,分别ig给予喜树碱原料药(对照组)和喜树碱微粉(实验组),给药剂量均为50 mg/kg(微粉按喜树碱实际质量计算)。采取眼底静脉取血,间隔时间为给药后0.25、0.5、1、2、3、4、6、8、10、12、24 h取血1 mL,置于肝素抗凝的离心管中。将取出的大鼠血样,放入离心管中(含肝素钠),3 000 r/min,离心10 min。取上清100 μL于1.5 mL离心管中,加甲醇300 μL,涡旋振荡混匀3 min,超声10 min,10 000 r/min离心10 min,取上清10 μL进HPLC检测。
喜树碱原料药和喜树碱微粉ig给药后平均血药浓度-时间曲线见图 9。口服喜树碱原料药后,药物在大鼠体内的吸收时间较缓慢,4 h后达到最大血药浓度是(1.549±0.155)ng/mL;口服喜树碱微粉后,0.5 h血药浓度达到(0.613±0.067)ng/mL,最大血药浓度增大到(2.737±0.233)ng/mL。根据相对生物利用度公式计算出,喜树碱微粉的相对生物利用度为喜树碱原药的3.10倍,微粉化后的喜树碱在大鼠体内的生物利用度大大提高。本实验采用DAS 2.0软件对数据进行模型拟合,拟合后得到喜树碱原药和喜树碱微粉的动力学参数值(表 2),喜树碱原药为权重系数为1的一室模型,喜树碱微粉为权重系数为1的二室模型,因为二者房室模型不同,所以部分对应的考察参数会有不同。
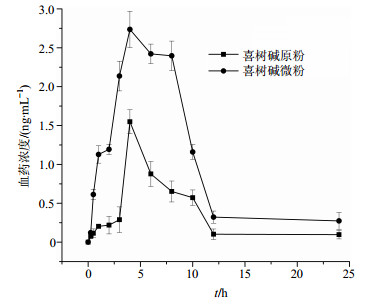
|
图 9 喜树碱原药和喜树碱微粉的血药浓度-时间曲线(x±s, n=5) Fig.9 Blood concentration of raw CPT and CPT micronized powder (x±s, n=5) |
|
|
表 2 喜树碱原药和喜树碱微粉房室模型药物动力学参数 Table 2 Pharmacokinetic parameters of compartment model for raw CPT and CPT micronized powder |
2.8 溶剂残留
称取100 mg喜树碱微粉,加入500 μL乙醇,超声萃取40 min,得喜树碱微粉乙醇溶液。而后配制甲醇和三氯甲烷标准乙醇溶液,其中甲醇质量分数为2 mg/g,三氯甲烷质量分数为0.06 mg/g。对以上2种样品10 000 r/min下离心5 min进样,进行GC检测。检测条件:柱温箱温度刚开始在80 ℃保持2 min,然后以15 ℃/min的速率升到270 ℃,并保持10 min。进样器和检测器温度都设为280 ℃。纯度为99.99%的氮气作为载气,体积流量为20 mL/min。氢气和空气体积流量为30、400 mL/min。样品每次进样量为2 μL,分流比为25:1。检测结果如图 10所示,图中A和B的尖峰代表乙醇,甲醇(峰1)和三氯甲烷(峰2)的保留时间分别为1.855 min和3.68 min,而对应的喜树碱微粉乙醇萃取溶液由于其中二者的量过低,在图 10-B中没有出现明显的峰,峰面积可由气相色谱仪检测报告获取。由外标一点法计算可得喜树碱微粉中甲醇和三氯甲烷残留量分别为0.064和0.014 mg/g。
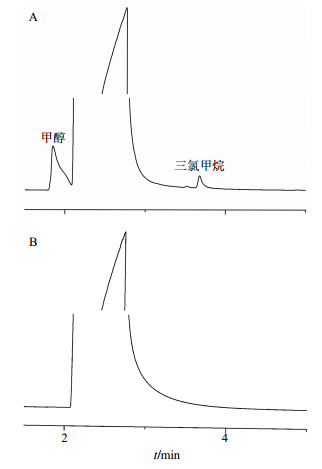
|
图 10 甲醇-三氯甲烷对照品溶液(A)及喜树碱微粉乙醇萃取溶液(B)的GC图 Fig.10 GC of methanol-chloroform reference substance solution (A) and ethanol extract liquor from CPT micronized powder (B) |
3 讨论 3.1 溶出和生物利用度研究
微粉化的喜树碱跟其原料粉相比,具有更小的粒径和更大的比表面积,因此它的溶出速率增快、溶解度增加。同时,它的口服生物利用度也得到了提高。
3.2 残留溶剂的考查本次研究中使用到了国际药品注册协调会议(International Conference on Harmonization,ICH)II类低毒溶剂甲醇和三氯甲烷。因此采用GC来检测喜树碱微粉的溶剂残留。最终测得的喜树碱微粉中甲醇和三甲烷残留量分别为0.064 mg/g和0.014 mg/g,符合ICH规定的甲醇和三氯甲烷3 mg/g和0.06 mg/g的限度。
| [1] | 江华, 蒋朱明, 蔡威, 等. 脂肪乳[J]. 中国临床营养杂志 , 2007, 15 (1) :17–20. |
| [2] | 刘丹, 张龙, 达飞, 等. 新型喜树碱类抗癌药物的研究进展[J]. 现代生物医学进展 , 2016, 16 (5) :990–992. |
| [3] | 谭慧心. 拓扑异构酶I抑制剂研究进展[J]. 中国药理学通报 , 2009, 25 (4) :436–441. |
| [4] | 江石湖, 谭继宏, 涂水平, 等. 药物诱导胃癌细胞凋亡的初步探索[J]. 胃肠病学 , 1998, 43 (3) :204–207. |
| [5] | Lian X H, Dong J X, Zhang J J, et al. Soluplus® based 9-nitrocamptothecin solid dispersion for peroral administration:Preparation, characterization, in vitro and in vivo evaluation[J]. Int J Pharm , 2014, 477 (1/2) :399–407. |
| [6] | Waterhouse D N, Sutherland B W, Dos Santos N, et al. Irinophore C (TM), a lipid nanoparticle formulation of irinotecan, abrogates the gastrointestinal effects of irinotecan in a rat model of clinical toxicities[J]. Invest New Drug , 2014, 32 (6) :1071–1082. DOI:10.1007/s10637-014-0138-x |
| [7] | Morise M, Niho S, Umemura S, et al. Low-dose irinotecan as a second-line chemotherapy for recurrent small cell lung cancer[J]. Jpn J Clin Oncol , 2014, 44 (9) :846–851. DOI:10.1093/jjco/hyu094 |
| [8] | Bhattacharya S, Ray R M, Johnson L R. Cyclin-dependent kinases regulate apoptosis of intestinal epithelial cells[J]. Apoptosis , 2014, 19 (3) :451–466. DOI:10.1007/s10495-013-0942-3 |
| [9] | 任贵兵, 毛中鹏, 王磊, 等. 喜树碱负载外泌体抗结肠癌作用[J]. 中华实用诊断与治疗杂志 , 2016, 30 (3) :231–234. |
| [10] | Shirazi A N, Tiwari R K, Oh D, et al. Cyclic peptide-selenium nanoparticles as drug transporters[J]. Mol Pharm , 2014, 11 (10) :3631–3641. DOI:10.1021/mp500364a |
| [11] | Kontek R, Jakubczak M, Matlawska-Wasowska K. The antioxidants, vitamin a and e but not vitamin c and melatonin enhance the proapoptotic effects of irinotecan in cancer cells in vitro[J]. Toxicol In Vitro , 2014, 28 (2) :282–291. DOI:10.1016/j.tiv.2013.11.007 |
| [12] | 郭鹏, 张莉. 喜树碱类抗癌药的研究进展[J]. 武警医学院学报 , 2001, 10 (3) :255–258. |
| [13] | 冯建灿, 张玉洁, 谭运德, 等. 喜树与喜树碱开发利用进展[J]. 林业科学 , 2000, 36 (5) :100–108. |
| [14] | 潘显道, 王存英. 天然抗肿瘤药喜树碱衍生物的研究进展[J]. 药学学报 , 2003, 38 (9) :715–720. |
| [15] | 王翔, 张梁宇, 丁宝月. 新型喜树碱纳米凝胶给药系统的构建及体外透皮特性[J]. 药学实践杂志 , 2016, 34 (2) :148–152. |
| [16] | Gottlieb J A, Guarino A M, Call J B, et al. Preliminary pharmacologic and clinical evaluation of camptothecin sodium (NSC-100880)[J]. Cancer Chemother Rep , 1970, 54 (6) :461–470. |
| [17] | 孙雁霞, 邬晓勇, 王跃华, 等. 喜树碱提取方法研究[J]. 成都大学学报:自然科学版 , 2008, 27 (2) :89–91. |
| [18] | 赵修华, 刘影, 王卫国, 等. 微粉化反式肉桂酸的反溶剂重结晶法制备与表征[J]. 中草药 , 2014, 45 (15) :2165–2171. |
 2016, Vol. 47
2016, Vol. 47



