2. 安徽省食品药品检验研究院, 安徽 合肥 230051 ;
3. 安徽中医药大学药学院, 安徽 合肥 230031 ;
4. 安徽省亳州市食品药品检验中心, 安徽 亳州 236800
2. Anhui Institute for Food and Drug Control, Hefei 230051, China ;
3. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230031, China ;
4. Anhui Bozhou Institute for Food and Drug Control, Bozhou 236800, China
牡丹皮Moutan Cortex为毛茛科(Ranunculaceae)芍药属Paeonia L.植物牡丹Paeonol saffuruticosa Andr.的干燥根皮,具有清热凉血、活血散瘀之功效,为临床常用药材。牡丹皮在我国具有悠久的药用历史,依据产地可分成道地药材凤丹皮(安徽铜陵)与一般药材(其他产区)。这种依据产地划分药材的“道地论”起源于《黄帝内经》中“天人相应”的理论[1],道地药材的“质优效佳”又源于内在化学成分/组分的外在表现。《中国药典》对中药材的检验包括水分、灰分、浸出物、某一(几个)化学成分的定量测定等,仅仅对中药材进行粗糙模糊的考量与评价,而脱离了整体性分析[2]。药物分析组合技术的发展为中药整体性分析提供了可能,本课题组已对牡丹皮的特征图谱、挥发性成分、无机元素等进行了分析[3-5]。基于UPLC-Q-TOF-MS技术的分析具有时间短、高分辨率、高灵敏度等优势,使得样品在不依赖对照品的情况下,对药材成分进行定性定量分析。本实验对牡丹皮药材产区进行考察,并选取安徽铜陵、安徽亳州、重庆垫江、山东菏泽、山西运城等主产区进行比较分析。
多元统计分析在中药材质量控制与评价研究中发挥着越来越重要的作用[6],对研究中出现的多变量、多指标且同时存在着一定相关性的数据进行分析,发现隐藏在其中的规律或数据间的关系,从而实现中药质量的有效评价。具体方法有聚类分析、因子分析、主成分分析(principal components analysis,PCA)、辨别分析和相关性分析等。其中PCA基于其简化数据,可快速实现模式化关系的可视化识别,因而广泛运用于现代中药复杂体系[7-8]。正交偏最小二乘法辨别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)是一种基于偏最小二乘法(partial least squares,PLS)回归的辨别分析分类方法,寻找类别中的差异成分[9-10]。运用多元统计分析结合UPLC-Q-TOF-MS的分析结果可以为牡丹皮药材的质量评价、道地药材的保护与开发利用提供依据。
1 仪器与材料Waters AcquityTM超高效液相系统、Waters XevoTM QTOF MS系统(美国Waters公司);S30H-D78224型超声清洗器(德国Elma Sonic公司);AL204型分析天平(瑞士Mettler toledo公司);XP26型分析天平(德国Mettler toledo公司,精度0.001 mg)。
亮氨酸脑啡肽(美国Sigma公司);没食子酸(批号110831-200302)、苯甲酸(批号100419-200301)、丹皮酚(批号110708-200506)、芍药苷(批号110736-200630)、槲皮素(批号100081-200907)、异鼠李素(批号110860-200407)、山柰素(批号110861-200606)均购于中国食品药品检定研究院;甲酸、乙腈均为色谱纯(德国Merck公司);纯净水为屈臣氏蒸馏水;乙醇为分析纯(中国医药集团上海化学试剂公司)。
牡丹皮药材分别采自安徽铜陵、安徽亳州、重庆垫江、山西运城、山东菏泽等地,经安徽省食品药品检验研究院黄丽丹主任中药师鉴定均为毛茛科植物牡丹皮Paeonol saffuruticosa Andr.的根皮,各产地牡丹皮按照《中国药典》2015版[3]进行统一制备,牡丹皮样品信息见表 1。
|
|
表 1 牡丹皮生品来源 Table 1 Sample resources of Moutan Cortex |
2 方法与结果 2.1 供试品溶液的制备
对采收鲜牡丹根皮,去除杂质,洗净,晾至外表面无水分,再去除木心部,阴干,即得。取牡丹皮饮片粗粉,精密称定粉末0.50 g,加入50 mL 70%乙醇回流提取2 h,滤过,定容至50 mL,摇匀后离心,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2 对照品溶液的制备精密称取没食子酸、芍药苷、苯甲酸、丹皮酚对照品适量,置于10 mL量瓶中,加70%乙醇溶解并定容,配制溶液质量浓度分别为0.886、4.121、0.572、3.576 mg/mL的混合对照品溶液T;精密称取槲皮素、异鼠李素、山柰素对照品适量,置于100 mL量瓶中,加70%乙醇溶解并定容,配制溶液质量浓度分别为31.459、31.601、22.700 μg/mL的混合对照品溶液H。
2.3 色谱条件色谱柱为Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm),Van Guard BEH C18(1.7 μm预柱);流动相为0.1%甲酸水溶液(A)-乙腈(B),洗脱程序为0~16 min,5%~30% B;16~18 min,30% B;18~21 min,30%~55% B;21~23 min,55%~80% B;23~24 min,80%~5% B;24~28 min,5% B;进样量2 μL;柱温30 ℃;体积流量0.4 mL/min;检测波长扫描范围210~400 nm。
2.4 质谱条件采用电喷雾离子源(ESI),毛细管电压分别为3.0 kV(正离子模式)和2.0 kV(负离子模式),样品锥电压分别为30 V(正离子模式)和40 V(负离子模式),提取锥电压为4 V,源温120 ℃,脱溶剂气温度450 ℃,脱溶剂气体积流量为800 L/h。采用MSE采集方式,采集时间28.0 min,扫描范围m/z 100~1 200,扫描间隔0.5 s。碰撞能量:碰撞低能量4 V,碰撞高能量为10~35 V。碰撞气为高纯氩气,雾化气为高纯氮气。Lockmass采用亮氨酸-脑啡肽(Leueine Enkephalin),质荷比(m/z)为556.277 1(正离子模式)和554.261 5(负离子模式)。数据采集由MassLynx v4.1软件控制[11]。
2.5 化合物推断分别取混合对照品T与混合对照品H,依“2.3”与“2.4”项下检测方法,分析与归纳各类对照品裂解信息,见图 1。依次取Y1~Y25供试品溶液,依“2.3”与“2.4”项下检测方法进行分析。依据文献资料[12-14]与Scifinder数据库对该属植物中的化合物进行检索,得到牡丹皮中潜在的化学成分数据库。并依据质量偏差小于5×10−6的原则,确定各色谱峰对应化合物的分子式,在已建立的毛茛科植物化学成分数据库中检索匹配的化合物,见表 2与图 2。其中峰号4、19、20的各碎片离子均相同,可能为同分异构体,因而推测为同一物质,峰号21与24同理。
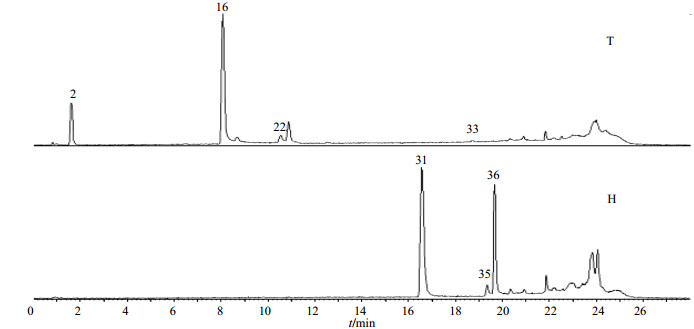
|
2-没食子酸16-芍药苷22-苯甲酸33-丹皮酚31-槲皮素35-山柰素36-异鼠李素 2-gallic acid 16-paeoniflorin 22-benzoic acid 33-paeonol 31-quercetin 35-kaempferol 36-isorhamnetin 图 1 混合对照品的总离子流图 Fig.1 Total ion current chromatogram of mixed reference substances |
|
|
表 2 牡丹皮的化学成分鉴定结果 Table 2 Identification of chemical constituents from Cortex Moutan |
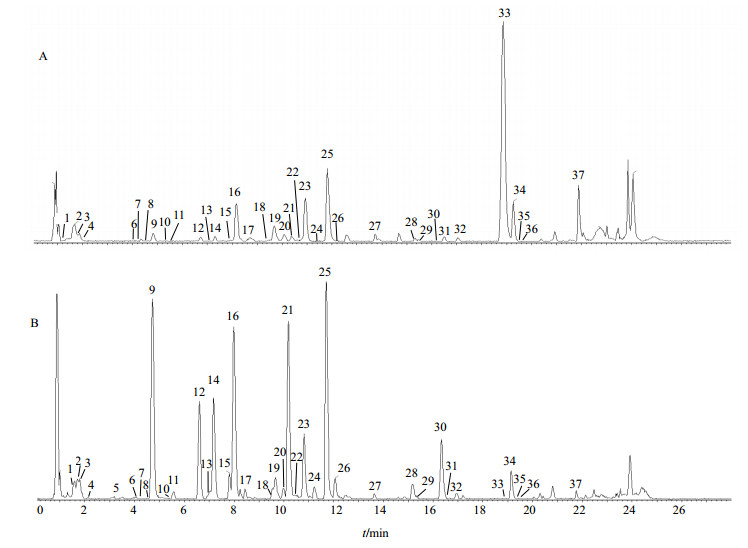
|
图 2 牡丹皮中正离子(A)和负离子模式(B)的总离子流图 Fig.2 Total ion current chromatogram in positive (A) and negative (B) ion mode for Moutan Cortex |
2.6 统计分析
对牡丹皮药材进行Q-TOF分析,总离子流色谱图见图 2。采用MarkerLynxTM v.4.1应用软件对质谱数据进行分析,优化参数设定为:保留时间范围为1.0~21.0 min,m/z 50~1 200,允许的质量误差为0.05,噪音消除水平为6.00,强度阈值为100,质谱窗口为0.05 amu,保留时间窗口设0.2 min。利用MarkerLynxTM v.4.1将数据转换为保留时间-精确质量数(RT-EM)数据对。对数据对进行多元统计分析,并根据同位素匹配、质量偏差、文献数据库等方式找出差异化合物可能的分子式与结构式[15-16]。
2.6.1 不同产地牡丹皮的PCA与PLS-DA分析从图 2可以看出,负离子模式下得到的总离子流图信息更丰富,因而采用负离子模式进行PCA模式识别,得到不同产地牡丹皮药材的得分图,见图 3。不同产地的牡丹皮样品点完全分离,同一产地药材可以很好聚在同一区域。在PCA分析基础上,依据产地将铜陵产地归为道地药材组,其他产地归为非道地药材组,运用有监督的PLS-DA分析,可以看出两组数据完全分开,同一组数据聚在同一区域,见图 4。
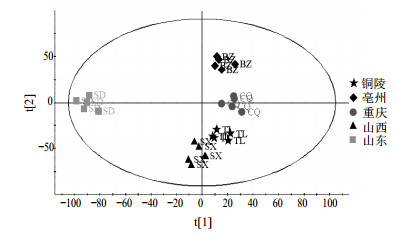
|
图 3 不同产地牡丹皮饮片的PCA图 Fig.3 PCA score plot of Moutan Cortex from different origins |
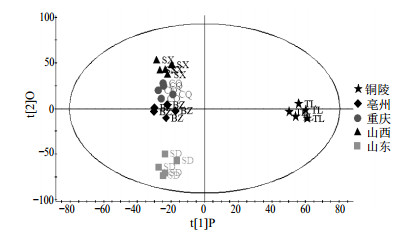
|
图 4 不同产地牡丹皮饮片的PLS-DA图 Fig.4 PLS-DA score plot of Moutan Cortex from different origins |
2.6.2 不同产地牡丹皮的OPLS-DA分析
在PLS-DA分析基础上,借助于OPLS-DA对数据进行两维数据分析[17],从而得到牡丹皮数据散点图,见图 5。散点图中每个点代表RT-EM数据,横轴(X轴)表示可变量,数据点离原点越远,该点对样品分组差异的贡献值也就越大。因而选取S型曲线两端的点,可认为是可信度较高的特征离子。利用此图筛选出不同产地牡丹皮中具有显著性差异的变量,即标志物(Marker),并结合自制的化学成分数据库、同位素匹配、质量偏差情况等找出Marker的可能分子式与结构式。从图 5中可找出凤丹皮(铜陵产)与非道地产区牡丹皮分离贡献较大的组分,Q-TOF高分辨率质谱为实验提供相应的m/z与元素组成。
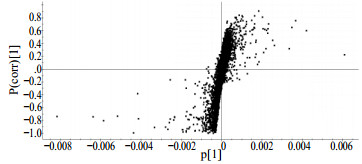
|
图 5 不同产地牡丹皮饮片的散点图 Fig.5 S-plot of Moutan Cortex from different origins |
2.6.3 Marker的推测分析
对OPLS-DA分析得出的S-Plot图,从图 5的两端选取数据对,通过多元数据分析再将结果导回Markerlynx结果中,由此高分辨质谱给出它们的质荷比和元素组成分别如下:①m/z 483.154 3,tR =6.60 min;②m/z 483.213 5,tR =7.18 min;③m/z 495.178 9,tR =4.73 min;④m/z 787.203 1,tR =10.0 min;⑤m/z 611.167 2,tR =10.18 min。通过精确相对分子质量与保留时间等信息,将数据与成分鉴定结果或数据库进行匹配,初步推断可能为①牡丹酚原苷或异构体;②牡丹酚原苷或异构体;③氧化芍药苷;④1, 2, 3, 6/1, 2, 4, 6-四没食子酰葡萄糖;⑤suffruticoside B/D。研究表明,道地药材与非道地药材主要差异可能表现在以上5种化学成分上。
2.7 相对含量分析依据化合物结构,将上述结果分为苯甲酸类、丹皮酚类、没食子酰葡萄糖类、芍药苷类、黄酮类等5类。色谱峰在254nm处各色谱峰峰形较好,色谱信息较为丰富,因而选取254 nm处对各成分进行积分,以相对峰面积大小为相对含量指标进行分析,由于黄酮类成分量均较低,因而本研究主要对其余4类成分相对峰面积与各类中差异较大的成分进行相对含量比较,可见凤丹皮(铜陵产)药材中的苯甲酸类、没食子酸类、芍药苷类量较其他产地高,其中四没食子酰葡萄糖、没食子酸、苯甲酰芍药苷、芍药苷等成分较为显著;丹皮酚类量居于中等,其中被认为是牡丹皮有效成分的丹皮酚量也居于中等,见图 6。因而作为质量标准指标的丹皮酚,并非是优质药材评价的唯一指标。
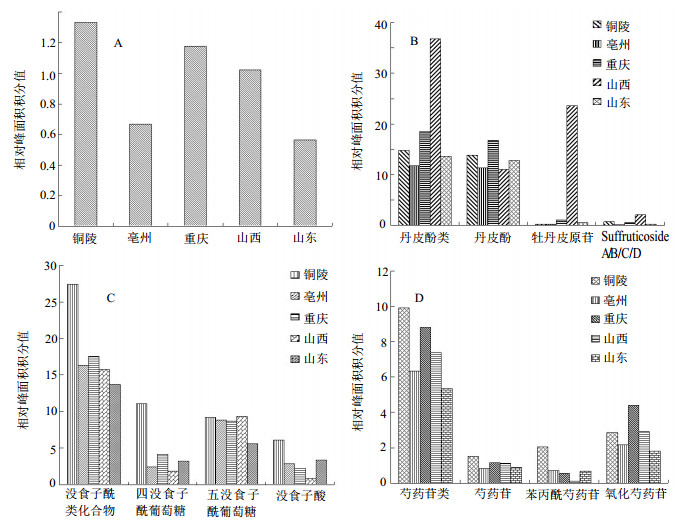
|
A-苯甲酸类B-丹皮酚类C-没食子酰葡萄糖类D-芍药苷类 A-benzoic acids B-paeonols C-galloyl glucoses D-paeoniflorin 图 6 不同产地牡丹皮药材的相对峰面积积分值 Fig.6 Relative peak area of Moutan Cortex from different origins |
3 讨论
中药材品质取决于其化学成分(群)质的区别与量的差异,遗传基因特征是形成道地药材的本质,产地生态环境影响其遗传基因的表达,特定的遗传因子与环境因子相互作用决定其次生代谢物的产生与累积[18]。目前基于单一(或少数)指标化学成分的定性、定量分析而制定的中药质量标准,不能全面体现中药的质量。随着中药质量控制的不断深入,双标多测法[19]已成为符合中药特点的多指标质量控制的有效模式之一(如以丹皮酚、芍药苷含量测定实现牡丹皮多个成分的同步测定),基于其价廉、操作方便与整体性(或多组分)评价等优点,将成为中药质量控制与评价的新热点。因而,如何运用现代仪器分析与统计,阐释道地药材药性的科学本质,具有重要的科学意义。
UPLC-Q-TOF-MS技术同时具有UPLC的高分辨以及Q-TOF-MS的高灵敏度、高选择性等优点,因而被广泛运用于中医药研究[20-21]。目前,运用该技术对牡丹皮分析已有一些报道[14-15, 22],但采用正、负离子两种模式分析却未见报道,多为部分成分鉴定且未进行数据分析。多元统计分析技术是一种综合分析方法,可以在多对象、多指标情况下分析统计规律[23]。采用双离子模式结合多元统计分析方法,可以更加准确地推测其化学成分,更好阐明数据差异内涵。
本实验利用UPLC-Q-TOF-MS结合多元统计分析方法对牡丹皮药材进行化学成分分析,利用该方法能很好地区分不同产地的牡丹皮药材,分离并鉴定了37个离子峰,运用数据处理软件推测了可能Marker的分子式与结构式,如牡丹皮原苷、四没食子酰葡萄糖、氧化芍药苷、Suffruticoside B/D等。对各指纹图谱峰面积进行分析,不同产地各类成分量均有不同程度的差异,与上述Marker具有较高相似处,因而可能为其特征性化学成分,为进一步分析研究凤丹皮道地性提供了科学依据。
| [1] | 谷素云.道地药材的形成和变迁因素的文献研究[D].北京:北京中医药大学, 2007. |
| [2] | 中国药典[S].一部.2015. |
| [3] | 胡云飞, 吴德玲, 徐国兵, 等. GC-MS结合化学计量学对5个产地牡丹皮提取物的比较分析[J]. 中成药 , 2015, 37 (9) :2003–2007. |
| [4] | 胡云飞, 徐倩, 徐国兵, 等. 牡丹皮炒制前后UPLC特征指纹图谱比较[J]. 中国药房 , 2015, 26 (6) :800–802. |
| [5] | 蒋磊, 胡云飞, 裴月梅, 等. ICP-MS/ICP-OES结合化学计量学对不同产地牡丹皮药材无机元素的比较分析[J]. 中国药房 , 2016, 27 (9) :1249–1253. |
| [6] | 刘娜, 李军, 李宝国. 多元统计分析在中药质量控制中的应用和思考[J]. 中国中药杂志 , 2014, 39 (21) :4268–4271. |
| [7] | 陈丽丽, 程显隆, 韩立炜, 等. UPLC-QTOF-MS结合主成分分析法用于白芍饮片的分级科学性研究[J]. 药物分析杂志 , 2013, 33 (5) :795–797. |
| [8] | Wang Q L, Liang Z T, Peng Y, et al. Whole transverse section and specific-tissue analysis of secondary metabolites in seven different grades of root of Paeonia lactiflora using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed , 2015, 103 :7–16. DOI:10.1016/j.jpba.2014.10.020 |
| [9] | Wiklund S, Johansson E, Sjöström L, et al. Visualization of GC/TOF-MS-Based metabolomics data for identification of biochemically interesting compounds using OPLS class models[J]. Anal Chem , 2008, 80 (1) :115–122. DOI:10.1021/ac0713510 |
| [10] | Wang Q L, Liang Z T, Peng Y, et al. Whole transverse section and specific-tissue analysis of secondary metabolites in seven different grades of root of Paeonia lactiflora using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed , 2015, 103 :7–16. DOI:10.1016/j.jpba.2014.10.020 |
| [11] | 张亚中. 基于超高效液相-四级杆-飞行时间串联质谱的白花蛇舌草注射液主成分分析[J]. 中草药 , 2013, 44 (7) :829–833. |
| [12] | 练杭芸, 徐王彦君, 梁乾德, 等. UPLC-QTOF MS法比较赤芍、白芍煎液化学成分差异[J]. 质谱学报 , 2014, 35 (3) :269–278. |
| [13] | Xu S J, Yang L, Zeng X, et al. Characterization of compounds in the Chinese herbal drug Mu-Dan-Pi by liquid chromatography coupled to electrospray ionization mass spectrometry[J]. Rapid Commun Mass Sp , 2006, 20 (22) :3275–3288. DOI:10.1002/(ISSN)1097-0231 |
| [14] | He C N, Peng B, Dan Y, et al. Chemical taxonomy of tree peony species from China based on root cortex metabolic fingerprinting[J]. Phytochemistry , 2014, 107 :69–79. DOI:10.1016/j.phytochem.2014.08.021 |
| [15] | Yin Q, Wang P, Zhang A, et al. Ultra-performance LC-ESI/quadrupole-TOF MS for rapid analysis of chemical constituents of Shaoyao-Gancao decoction[J]. J Sep Sci , 2013, 36 (7) :1238–1246. DOI:10.1002/jssc.201201198 |
| [16] | 薛英, 李晓伟, 李震宇, 等. 采用UPLC/Q-TOF MS与NMR代谢组学技术研究生长年限对远志药材质量的影响[J]. 药学学报 , 2015, 50 (3) :340–347. |
| [17] | 蔡爽.糖尿病大鼠模型和抗糖尿病药物作用机制的代谢组学研究[D].沈阳:沈阳药科大学, 2009. |
| [18] | 郑敏霞, 陈喆, 刘培, 等. 白芍中芍药苷及其衍生物的UPLC-MS/MS分析[J]. 中国中药杂志 , 2011, 36 (12) :1641–1643. |
| [19] | 孙磊, 金红宇, 马双成, 等. 中药标准物质替代测定法技术指导原则[J]. 中国药学杂志 , 2015, 50 (4) :284–286. |
| [20] | 练杭芸.基于UPLC-QTOF-MS技术对四物汤药效物质基础深入研究[D].合肥:安徽医科大学, 2014. |
| [21] | 徐倩, 胡云飞, 汪电雷, 等. 前胡香豆素类提取物的UPLC/Q-TOF-MS分析及其初步药效学研究[J]. 中草药 , 2014, 46 (24) :3637–3642. |
| [22] | 赵文军, 林阳, 李鹏飞, 等. 牡丹皮化学成分的HPLC-QTOF MS分析[J]. 药学实践杂志 , 2014, 32 (4) :261–265. |
| [23] | Wu S B, Meyer R S, Whitaker B D, et al. A new liquid chromatography-mass spectrometry-based strategy tointegrate chemistry, morphology, and evolution of eggplant (Solanum) species[J]. J Chromatogr A , 2013, 1314 :154–172. DOI:10.1016/j.chroma.2013.09.017 |
 2016, Vol. 47
2016, Vol. 47


