鸦胆子油(Bruceae Fructus oil,BFO)是从苦木科鸦胆子属植物鸦胆子Brucea javanica (L.) Merr.成熟果实中提取而得的油脂类物质。现代药理学研究表明BFO具有抗癌、抗病原体、抗氧化、抗胃溃疡等作用。临床上将其制成10% BFO乳剂,作为辅助抗肿瘤药物[1-4],用于治疗消化系统肿瘤。乳剂属于多相动力学不稳定分散体系,在受热、受冷及长期储存过程中均能引起乳析和破裂,渗漏的BFO毒性很大,对胃肠黏膜和血管壁的刺激性也很严重。
环糊精(cyclodextrin,CD)是由α-1, 4葡萄糖苷键连接的环状低聚糖,其独特的笼状结构可以包合药物分子形成包合物,此时药物分子被包含于CD分子空腔中,具有很高的分散度,同时由于CD外部多羟基的亲水性,使包合物具有良好的可润湿性,从而达到对难溶药物的增溶效果,能显著改善药物的理化性质[5-9]。本实验中所用的交联环糊精(环糊精聚合物,CDP)是一种将CD和环氧氯丙烷(EP)交联得到的聚合物。实验证明该聚合物易溶于水[10],当小分子药物与该类聚合物复合后,能使药物的溶解度增加、稳定性提高、毒副作用降低、药代动力学改善[11]。本实验研制了BFO-CDP包合物(BFO-CDP-IC),并对其进行表征,通过急性毒性试验测定其半数致死量(LD50),并与市售BFO乳剂进行安全性比较。
1 仪器与材料磁力搅拌器,上海沪西分析仪器厂;剪切乳化均质机,上海标本模型厂;Tensor27傅里叶变换红外光谱(FTIR)仪、AVANCE600核磁共振仪,德国Bruker公司;S-4800场发射扫描电子显微镜(SEM),日本Hitachi High-Technologies公司;Waters e2695高效液相色谱仪、Waters 2998 PDA检测器,美国Waters公司。
BFO,实验室自制;鸦胆子苦醇,中国食品药品检定研究院,批号140208,质量分数≥98%;BFO乳剂,广州白云山明兴制药有限公司,批号0114101412;β-环糊精(β-CD)、EP、NaOH和其他试剂均购自国药集团化学试剂公司。清洁级ICR小鼠120只,雌雄各半,体质量18~22 g。购自扬州大学比较医学中心,许可证号SCXK(苏)2010-0004。
2 方法与结果 2.1 BFO的提取将鸦胆子仁用万能粉碎机粉碎后,用滤纸包好,置于索氏提取器中,以石油醚(沸程60~90℃)为提取溶剂,液料比6:1,水浴回流提取,直到提取液无色为止[12],BFO得率为17.3%。以《中国药典》2015年版记载方法对本实验中所提BFO的理化性质进行测定,其色草绿,澄明,油状,味苦,有油脂香。密度0.900 g/mL;折光率1.470;酸值8.142 6 mg KOH/g;皂化值197.0 mg KOH/g;过氧化值6.038 3 mmol/kg;碘值0.991 7 g碘/g。
2.2 CDP的合成及其表征 2.2.1 CDP的合成将15.76 g NaOH加入32 mL H2O中,搅拌至溶解后称取20 gβ-CD加入,搅拌至溶液澄清。将9.64 mL的EP加入溶液中,搅拌24 h,冷却至室温。用透析法除去盐后,将透析后的溶液用旋转蒸发仪蒸发至黏稠状,加入无水乙醇析出白色固体,滤过,真空干燥,即得到CDP[13],反应产率为49.26%。根据苯酚-硫酸法测定水解液中葡萄糖的量,算出聚合物的交联度为8.47。
2.2.2 CDP的表征(1)SEM法:分别取少量β-CD、CDP均匀固定于样品台上,导电胶粘样、喷金镀膜后置于SEM中观察其表面形态特征。由于EP的交联作用致使两者晶格排列发生变化,产生形态学差异[14]。如图 1所示,β-CD与CDP的电镜行为有明显不同。β-CD表面疏松,而CDP表面光滑,可能是在与EP聚合过程中形成了多个支化点,因此得到了具有较好机械强度、良好稳定性的产物[15]。与聚合前相比,CDP的表面形态产生了显著变化,说明CDP的形成。

|
图 1 β-CD(a)和CDP(b)的SEM图 Fig.1 SEM pictures ofβ-CD (a) and CDP (b) |
(2)FTIR法:分别取β-CD、CDP适量,与KBr充分混合研磨,置于压片机中压片。扫描波数范围设定为4 000~400 cm−1,于相同条件下对两者进行测定。比较两者-OH、-CH2、C-O-C键吸收峰强度变化,判断是否成功合成CDP。
CD聚合反应过程为CD外部O-H键断裂,与EP键合,此过程中-OH减少,同时引入碳链和仲-OH,因此可以通过观察FTIR和1H-NMR图谱中羟基和质子峰的强弱或化学位移(δ)来判断是否合成CDP[16]。
如图 2所示,与β-CD相比,CDP的红外吸收光谱在3 400~3 300 cm−1处的吸收减弱,而1 100~1 000 cm−1左右-OH伸缩振动吸收变弱,这说明-OH的伸缩振动和平面弯曲也有所降低,这和EP与β-CD上-OH交联反应使-OH减少有关;在2 920 cm−1左右的吸收峰是-CH和-CH2的伸缩振动,CDP在此处的吸收峰增强,且在1 450 cm−1附近出现了-CH的弯曲振动,这进一步说明EP和β-CD反应;CDP经过交联聚合后仍保留了β-CD的C-O-C和C-O键,因此,在CDP中-OH的减少,-CH2和-CH链增长,极性较β-CD降低且保留了β-CD的原有空腔结构。
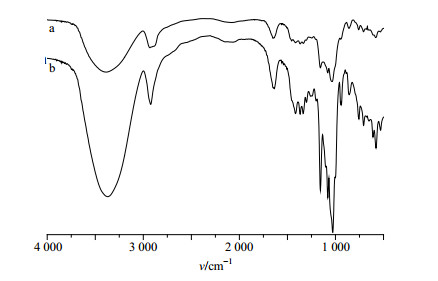
|
图 2 β-CD (a)和CDP (b) FTIR谱图 Fig.2 FTIR spectra ofβ-CD (a) and CDP (b) |
(3)1H-NMR法:分别取适量β-CD、CDP,以重水(D2O)为溶剂分别溶解,测定它们的1H-NMR谱图。1H-NMR法是一种运用较为广泛的分析检测和验证的方法,如图 3所示,图中δ 3.55~4.00的吸收峰为β-CD氢的化学位移,δ 4.02、3.97(双峰)为β-CD与EP发生交联反应后出现的新峰,说明发生了交联反应从而出现了新的羟基峰;δ 5.15(单峰)为碳链上-OH的峰,因此证明已成功合成CDP。EP与CD反应之后,会在δ 3.0~4.0出现新峰,和CD原有的峰重叠,所以出现谱图上的峰形。
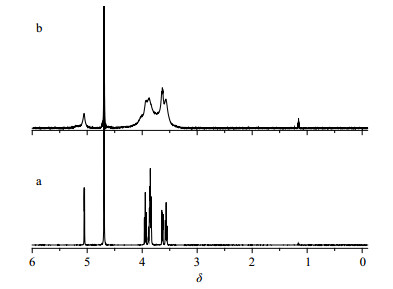
|
图 3 β-CD (a)、CDP (b)的1H-NMR谱图 Fig.3 1H-NMR spectra ofβ-CD (a) and CDP (b) |
2.3 BFO-CDP-IC的制备及其表征 2.3.1 BFO-CDP-IC的制备
精密称取10 g CDP置于烧杯中,加蒸馏水溶解,以300 r/min速度边均质边缓慢滴加1.7 mL BFO乙醚溶液,室温条件下均质6 min使成糊状,真空干燥,即得。
2.3.2 单因素考察(1)主客体分子BFO与CDP投料比的影响:主客体分子的投料比是影响包封率的关键因素,本实验分别采用质量为2、4、6、8、10、12 g的CDP对BFO进行包合,其他工艺参数设置为包合温度20℃,均质时间6 min,稀释BFO的乙醚用量为0.5 g。结果表明,当CDP用量为10 g时,包封率最高。因此在正交设计中,将CDP的投料量设定为8、10、12 g。
(2)包合温度的影响:保持其他条件不变,分别在20、30、40、50、60℃条件下对BFO进行包合,结果表明在20~40℃,随着温度的升高,包封率增加明显,当温度高于40℃以后,包封率升高不明显。考虑到BFO受热不稳定,温度升高易导致其挥发,影响BFO的包封率。综合考虑将正交温度定为20、30、40℃。
(3)均质时间的影响:保持其他条件不变,将均质时间分别设为3、6、9、12、15 min,考察均质时间对BFO包封率的影响。结果表明,当均质时间为6 min时,所得包封率最高。6 min后随着均质时间延长包封率下降,可能是因为CDP分子空穴大,均质时间延长易导致BFO从空腔析出,因此正交试验中将均质时间设定为3、6、9 min。
(4)稀释BFO的乙醚用量的影响:保持其他条件不变,改变稀释BFO的乙醚用量,将溶液中稀释BFO的乙醚用量分别设为0.2、0.3、0.4、0.5、0.6 g,考察其对BFO包封率的影响。随着稀释BFO的乙醚用量的增加包封率逐渐升高,但稀释BFO的乙醚用量过高时,也会导致包封率降低,故将正交试验中稀释BFO的乙醚用量设定为0.3、0.4、0.5 g。
2.3.3 HPLC定量测定方法的建立(1)色谱条件:色谱柱为Symmetry C18柱(250 mm×4.6 mm,5μm),流动相为甲醇-水(5:5),体积流量为0.8 mL/min,柱温为(25±5)℃,进样量40μL,检测波长为220 nm。对照品、BFO-CDP-IC供试品及空白样品的色谱图见图 4。
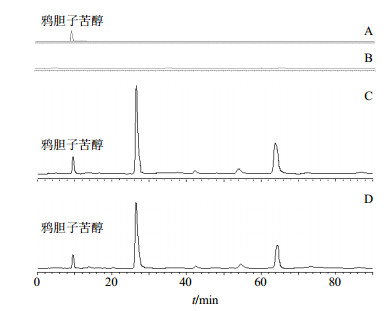
|
图 4 鸦胆子苦醇对照品(A)、CDP空白样品(B)、BFO (C)和BFO-CDP-IC (D)的HPLC图 Fig.4 HPLC of brusatol reference substance (A), blank sample of CDP (B), BFO (C), and BFO-CDP-IC (D) |
(2)对照品溶液的配制:精密称取鸦胆子苦醇对照品4 mg,溶于10 mL甲醇,配制成0.4 mg/mL鸦胆子苦醇的对照品储备液。
(3)BFO供试品溶液的配制:精密称取5 g BFO于10 mL量瓶中,甲醇定容至刻度,得0.5 g/mL的BFO供试品溶液。
(4)BFO-CDP-IC供试品溶液的配制:精密称取BFO-CDP-IC 1.0 g于10 mL量瓶中,加乙醚至刻度,置于超声波清洗机中超声1 h后,离心5 min,取上层,回收乙醚,加入甲醇定容至1 mL,得解包合BFO-CDP-IC供试液。
(5)空白样品溶液的制备:按照BFO-CDP-IC处方比例,不加鸦胆子油,按“2.3.1”项下方法制备阴性供试品,按“2.3.3(4)”项方法制得空白样品溶液。
(6)线性关系考察:精密吸取适量对照品储备液,用甲醇稀释至质量浓度分别为0.4、0.2、0.1、0.05、0.025 mg/mL,分别进样40μL,记录色谱图及峰面积。以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得鸦胆子苦醇标准曲线方程:Y=1×107 X+987 534,r=0.999 8,表明鸦胆子苦醇在0.025~0.4 mg/mL线性关系良好。
(7)精密度试验:分别精密移取“2.3.3(2)”项下的鸦胆子苦醇对照品储备液0.1、0.2、0.4 mL,置于10 mL量瓶中,甲醇定容至刻度,得质量浓度分别为4.0、8.0、16.0μg/mL的鸦胆子苦醇对照品溶液,按“2.3.3(1)”项下色谱条件注入液相色谱仪,每个质量浓度分别重复进样6次,以考察精密度。结果表明不同质量浓度下鸦胆子苦醇峰面积的RSD值分别为1.37%、1.44%、1.04%,表明该方法精密度良好。
(8)重复性试验:分别按“2.3.3(3)”和“2.3.3(4)”项方法制备BFO供试品溶液(0.1 g/mL)和BFO-CDP-IC供试品溶液,各6份,按“2.3.3(1)”项下色谱条件注入液相色谱仪,考察该方法的重复性。结果表明2种样品中鸦胆子苦醇的RSD值分别为1.06%、0.98%,表明该方法重复性良好。
(9)稳定性试验:分别按“2.3.3(3)”和“2.3.3(4)”项方法制备BFO供试品溶液(0.1 g/mL)和BFO-CDP-IC供试品溶液,在室温下放置0、2、6、8、12、24 h后,按“2.3.3(1)”项下色谱条件注入液相色谱仪,考察各供试品溶液稳定性。结果表明,2种供试品溶液不同时间下测定的鸦胆子苦醇峰面积RSD分别为0.40%、0.47%,表明24 h内2种供试品溶液稳定性良好。
(10)加样回收率试验:精密吸取按“2.3.3(4)”项下方法配制的已测定鸦胆子苦醇量的BFO-CDP-IC供试品溶液9份,每份各1 mL,分别精密加入一定量的鸦胆子苦醇对照品溶液(相当于鸦胆子苦醇0.025、0.050、0.100 mg),混匀,分为低、中、高3组,每组3份,按“2.3.3(1)”项下条件注入液相色谱仪,重复测定3次,取峰面积平均值,计算质量浓度、回收率和RSD值。测得鸦胆子苦醇加样回收率平均值为99.67%,RSD为1.64%,3个质量浓度的回收率符合定量测定要求,表明该方法加样回收率良好。
(11)包封率的测定:精密称取5 g BFO于10 mL容量瓶中,甲醇定容至刻度,得0.5 g/mL的BFO供试品溶液。精密称取BFO-CDP-IC 1.0 g于10 mL量瓶中,置于超声波清洗机中超声1 h后,2 000 r/min离心5 min,浓缩至1 mL,得解包合后的BFO-CDP-IC供试液。分别进样40μL,记录色谱图及峰面积。按照下式计算BFO-CDP-IC的包封率及载药量。经HPLC法测得BFO中指标成分鸦胆子苦醇的量推算得BFO-CDP-IC中BFO的包封率为80%,载药量为7.1%。
包封率=W包/W投=(W投-W游)/W投
载药量=(W投-W游)/W总
W投为总投药量,W包为包入的BFO量,W游为游离的BFO量,W总为BFO-CDP包合物质量
2.3.4 BFO-CDP-IC制备工艺优化根据单因素考察试验及相关文献报道[17-19],选取主客体分子BFO与CDP投料比(A)、包合温度(B)、均质时间(C)及稀释BFO的乙醚用量(D)4个因素进行考察,以包封率为评价指标,采用L9(34)正交试验设计筛选BFO-CDP-IC最佳工艺参数。因素水平、试验设计及结果见表 1,方差分析见表 2。
|
|
表 1 L9(34)正交试验设计与结果 Table 1 Design and results of L9(34) orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
对考察指标进行直观分析及方差分析,结果显示4个影响因素中对BFO-CDP-IC包封率的影响大小顺序为C>A>B>D,优组合为A2B1C2D3,优选出的最佳包合工艺为BFO与CDP投料比1:10,包合温度20℃,均质时间6 min,稀释BFO的乙醚用量0.5 g。
2.3.5 BFO-CDP-IC的表征(1)SEM法:对CDP和BFO-CDP-IC样品经导电胶粘样、喷金镀膜后置于场发射扫描电镜中观察其表面形态特征。图 5-a、b分别为CDP、BFO-CDP-IC的SEM图,它们显示了2种不同物质的表面形态学特征[20]。从图 5-a、b中可以明显看出CDP和BFO-CDP-IC的区别。CDP表面光滑,而BFO-CDP-IC表面有很多小孔,且能看到油滴状物质,说明BFO-CDP-IC的形成,BFO被包进CDP的空腔。

|
图 5 CDP (a)和BFO-CDP-IC (b)的SEM图 Fig.5 SEM pictures of CDP (a) and BFO-CDP-IC (b) |
(2)FTIR法:分别取BFO、CDP、BFO与CDP两者的物理混合物以及BFO-CDP-IC适量,与KBr混合,压片,在扫描波数为4 000~400 cm−1测定其FTIR图。图 6为BFO、CDP、BFO与CDP物理混合物以及BFO-CDP-IC的FTIR谱图。通过FTIR法可以有效地验证客体分子与CD是否产生包合作用,在包合物中可以观察到与包合之前客体分子的不同之处[21]。BFO主要成分为油酸,在BFO中其量高达63.3%,在图 6-a其FTIR谱图里可以观察到油酸的特征吸收峰,在图 6-a中可以看到3 007 cm−1处的吸收峰为油酸上的烯烃C-H伸缩振动,1 700 cm−1左右的吸收峰为油酸的C=O峰。图 6-b中在3 400~3 300 cm−1处的吸收峰为O-H的伸缩振动,在2 920 cm−1左右的吸收峰是-CH和-CH2的伸缩振动。以上特征吸收峰在BFO与CDP的物理混合物的FTIR谱图中均能找到。但是在图 6-d中,CDP的特征吸收峰均能找到,而油酸上的吸收峰有的发生变化,有的甚至消失,例如在3 007 cm−1处的C-H伸缩振动,在包合物的红外谱图中就完全消失[22]。
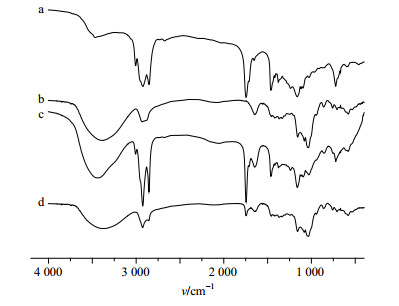
|
图 6 BFO (a)、CDP (b)、BFO与CDP物理混合物(c)和BFO-CDP-IC (d)的FTIR谱图 Fig.6 FTIR spectra of BFO (a), CDP (b), physical mixture (c), and BFO-CDP-IC (d) |
油酸原有的特征吸收峰应该在1 700 cm−1左右,而包合物中C=O的吸收峰却在1 745 cm−1。氢键的形成使电子云密度平均化,从而使伸缩振动频率降低,但包合物中C=O的吸收峰没有降低反而升高,说明BFO的C=O没有和CDP的-OH形成氢键,而是在环糊精的空腔内部。另外游离羧酸的C=O键频率出现在1 760 cm−1左右,在固体或液体中C=O键频率出现在1 700 cm−1,和FTIR谱图相符,由此可以判断进入到空腔内的BFO是游离分散的状态,也能进一步说明BFO在空腔内部,BFO的C=O吸收应该为二聚体的C=O吸收峰。
(3)1H-NMR法:以D2O为溶剂分别溶解CDP和BFO-CDP-IC,测定它们的1H-NMR谱图。如图 7所示,CDP中质子受BFO的影响均发生明显的位移(表 3),并且在包合物的1H-NMR谱图中BFO中油酸部分质子的化学位移和CDP重合,但是也有所显示,而其他大部分的峰都清楚的显示出来,部分峰发生位移[23]。在BFO-CDP-IC的1H-NMR谱图中出现了6组新的化学位移,其中高场区δ 0.88~2.26出现的5组新峰是油酸α-H以外其他的质子,而δ 5.31出现的新峰是油酸上的α-H。以上证据都能证明CDP中含有BFO。除此以外,还可以通过CDP的化学位移变化说明BFO已经包覆进入CDP的空腔内。包合物的1H-NMR谱图中可以看出CDP的化学位移发生了明显的变化。
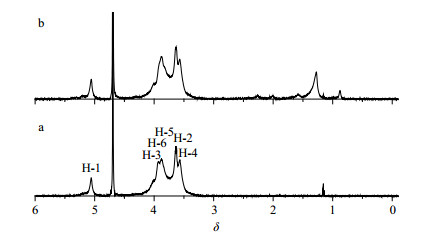
|
图 7 CDP (a)和BFO-CDP-IC (b)的1H-NMR谱图 Fig.7 1H-NMR spectra of CDP (a) and BFO-CDP-IC (b) |
|
|
表 3 CDP包合BFO前后1H-NMR化学位移 Table 3 1H-NMR chemical shifts for CH protons of CDP alone and in complex of BFO |
首先,BFO和CDP空腔内的H-3、H-5作用,使得其化学位移均发生了变化,向低场移动,说明客体分子进入了空腔内部,且客体分子插入较深,甚至位于空腔小口端的H-6也发生化学位移。同时其他峰也都有所不同,位于CDP分子空腔外部的H-1、H-2、H-4也发生化学位移,这进一步证明BFO已经进入到CDP内,形成了目标包合物。
2.4 急性毒性实验小鼠120只,随机分为12组,每组10只,雌雄各半,BFO-CDP-IC和BFO乳剂各6组。在预试验及参考文献报道[24]的基础上选1:0.8为剂量比,最高剂量为15.76 g/kg,最低剂量为6.29 g/kg,按等比稀释法配制不同质量浓度的BFO-CDP-IC和BFO乳剂,将其分别一次性ig给药后观察动物反应,连续观察14 d,并对死亡小鼠进行肉眼尸检,记录病变情况,试验结果用Bliss法计算半数致死量(LD50)。
运用Bliss法计算BFO乳剂的LD50值(表 4)。BFO乳剂的LD50值为9.780 g/kg,BFO-CDP-IC观察期内供试组小鼠未见有死亡,仅在给药后出现蜷缩少动、呼吸急促等症状,但一段时间之后即恢复正常,说明在15.36 g/kg的剂量下是安全的。以上结果表明,BFO-CDP-IC的安全性明显高于市售BFO乳剂。
|
|
表 4 BFO乳剂的LD50和置信区间(CI) (n=10) Table 4 LD50 and confidence interval for BFOE (n=10) |
3 讨论
本实验成功制备CDP,并以CDP为药物载体,制备BFO-CDP-IC,通过SEM、FTIR、1H-NMR对包合物进行表征,结果表明包合物制备成功。经HPLC法测得BFO中鸦胆子苦醇量为2 mg/g,测得BFO-CDP-IC的包封率为80%,载药量为7.1%。以包封率为考察指标通过正交试验优化制备工艺参数,确定最优工艺参数为CDP与BFO投料比为10:1(质量比),包合温度20℃,均质时间6 min,稀释BFO的乙醚用量为0.5 g。通过急性毒性实验将BFO-CDP-IC的安全性与市售BFO乳剂进行比较,通过实验测得市售BFO乳剂的LD50为9.780 g/kg,而BFO-CDP-IC的LD50未测出,由此可见BFO-CDP-IC的安全性显著高于市售BFO乳剂。
| [1] | 穆大成, 朱文武, 刘劲军. 鸦胆子油乳辅助治疗肺癌胸腔积液的效果观察[J]. 临床合理用药 , 2012, 5 (1B) :24–25. |
| [2] | 胡梦玮, 姚杨伟, 王海琴. 鸦胆子油乳剂对43例肺癌化疗患者疗效及免疫功能的影响[J]. 实用肿瘤杂志 , 2011, 26 (3) :306–308. |
| [3] | 田春桃, 韩利艳. 鸦胆子油对肝癌细胞SMMC-7721增值抑制作用[J]. 现代肿瘤医学 , 2010, 18 (4) :654–656. |
| [4] | 陈钢, 张晓, 卢刚, 等. 鸦胆子油微囊-原位凝胶的制备及体外释药机制的研究[J]. 中草药 , 2012, 43 (7) :1306–1309. |
| [5] | 李春艳. 浅谈β-环糊精在药物制剂中的应用[J]. 中国医药指南 , 2012, 10 (9) :53–54. |
| [6] | 赵红红, 阎克里, 刘焕蓉. 氧化分解白术挥发油与羟丙基-β-环糊精包合工艺的研究[J]. 中草药 , 2015, 46 (12) :1768–1773. |
| [7] | 夏海建, 张振海, 蒋俊, 等. 雷公藤红素环糊精与油自组装小珠载药系统的制备及其体外评价[J]. 中草药 , 2013, 44 (19) :2672–2676. |
| [8] | 李颖, 曾茂贵, 郑笈, 等. 星点设计-效应面法优化鱼腥草挥发油-β-环糊精包合物的制备工艺[J]. 中草药 , 2014, 45 (13) :1855–1862. |
| [9] | 杨建文, 任晓亮, 戚爱棣. 环糊精及其衍生物在中药提取中的应用研究进展[J]. 药物评价研究 , 2015, 38 (2) :208–213. |
| [10] | Gidwani B, Vyas A. Synthesis, characterization and application of epichlorohydrin-β-cyclodextrin polymer[J]. Colloids Surf B , 2014, 114 :130–137. DOI:10.1016/j.colsurfb.2013.09.035 |
| [11] | 龚敏阳. β-环糊精及其衍生物在中药制剂中的研究进展[J]. 中国中医药信息杂志 , 2009, 16 (S1) :90. |
| [12] | 欧阳辉桂, 张彬, 周武, 等. 鸦胆子油的提取工艺研究[J]. 安徽农业科学 , 2010, 38 (3) :1426–1428. |
| [13] | Zhang W, Chen M, Diao G W. Preparation and electrochemical behavior of water-soluble inclusion complex of ferrocene with β-cyclodextrin polymer[J]. Electrochim Acta , 2011, 56 (14) :5129–5136. DOI:10.1016/j.electacta.2011.03.062 |
| [14] | Zhang XL, Huang J, Chang P R, et al. Structure and properties of polysaccharide nanocrystal-doped supramolecular hydrogels based on cyclodextrin inclusion[J]. Polymer , 2010, 19 (51) :4398–4407. |
| [15] | 金文英, 刘海玲. β-环糊精交联聚合物的合成及表征[J]. 桂林工学院学报 , 2005, 25 (3) :339–341. |
| [16] | Liu H H, Cai X Y, Wang Y, et al. Adsorption mechanism-based screening of cyclodextrin polymers for adsorption and separation of pesticides from water[J]. Water Res , 2011, 45 (11) :3499–3511. DOI:10.1016/j.watres.2011.04.004 |
| [17] | 高振珅, 王兰. 姜黄素羟丙基-β-环糊精包合物的制备及其性质研究[J]. 中草药 , 2012, 43 (10) :1951–1956. |
| [18] | 张生潭, 张帆, 汪铁山, 等. 正交试验优选春砂仁挥发油羟丙基-β-环糊精包合工艺[J]. 中国药房 , 2011, 22 (3) :225–227. |
| [19] | 李仲谨, 杨威, 陈玉苗, 等. 薄荷油-β-环糊精聚合物微球包合物的制备与表征[J]. 中草药 , 2011, 42 (2) :271–274. |
| [20] | Chadha R, Saini A, Gupta S, et al. Encapsulation of rifampicin by natural and modifiedβ-cyclodextrins: characterization and thermodynamic parameters[J]. J Incl Phenom Macrocycl Chem , 2010, 67 (1) :109–116. |
| [21] | Zhang X L, Huang J, Chang P R, et al. Structure and properties of polysaccharide nanocrystal-doped supramolecular hydrogels based on cyclodextrin inclusion[J]. Polymer , 2010, 51 (19) :4398–4407. DOI:10.1016/j.polymer.2010.07.025 |
| [22] | Periasamy R, Kothainayaki S, Rajamohan R, et al. Spectral investigation and characterization of host-guest inclusion complex of 4, 4'-methylene-bis (2-chloroaniline) with beta-cyclodextrin[J]. Carbohydr Polym , 2014, 114 :558–566. DOI:10.1016/j.carbpol.2014.08.006 |
| [23] | Zhao R, Tan T, Sandström C. NMR studies on puerarin and its interaction with beta-cyclodextrin[J]. Biol Phys , 2011, 37 (1) :387–400. |
| [24] | 刘晓旭, 倪睿, 刘建平. 鸦胆子油脂质体的制备及其药效学评价[J]. 中国药科大学学报 , 2009, 40 (1) :37–40. |
 2016, Vol. 47
2016, Vol. 47


