2. 西南大学西藏农牧学院药用植物联合研发中心, 重庆 400715 ;
3. 中山大学生命科学学院, 广东 广州 510275 ;
4. 西南大学药学学院, 重庆 400715 ;
5. 西藏大学农牧学院, 西藏 林芝 850000
2. SWU-TAAHC Medicinal Plant Joint R&D Centre, Southwest university, Chongqing 400715, China ;
3. School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China ;
4. School of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China ;
5. Agricultural and Husbandry College, Tibet University, Linzhi 850000, China
颠茄是我国药典收录的托品烷类生物碱(tropane alkaloids,TAs)药源植物[1],其次生代谢产物莨菪碱(hyoscyamine)和东莨菪碱(scopolamine)具有重要的药用价值。TAs主要在须根中合成并存储于植物的根中,同时也存在转运机制将其运输到植物地上部位进行储存[2]。由于化学合成困难且昂贵,TAs无法进行大规模的人工合成[3]。目前,TAs主要从茄科类植物中提取[4]。因此,研究TAs代谢途径上的各种功能基因,进而采取分子生物学的方法提高颠茄中TAs的产量具有重要意义。
精氨酸脱羧酶(arginine decarboxylase,ADC)是生物体中多胺合成途径上的一个关键限速酶,属于磷酸吡哆醛依赖性酶基因超家族Ⅲ型PLPDE成员,含有Ⅲ型PLPDE典型的N端Orn-Arg-deC-N结构域和C端Orn-DAP-Arg-deC结构域[5]。在磷酸吡哆醛的催化作用下,ADC可以催化精氨酸(arginine)脱羧[6],生成鲱精胺(agmatine),再水解鲱精胺生成腐胺(putrescine),腐胺又可以在亚精胺合成酶(spermidine synthase)和精胺合成酶(spermine synthase)的作用下分别合成亚精胺(spermidine)和精胺(spermine)。
ADC的催化产物腐胺是托品烷类生物碱生物合成的前体物质,因此ADC基因对托品烷类生物碱的合成也具有重要作用。近年来,棉花[7]、甘蓝型油菜[8]、桃树[9]、甘蓝[10]、水稻[11]等多种植物的ADC基因已经被克隆,并证明其参与广泛的生理过程和胁迫反应,然而有关颠茄ADC(AbADC)基因的研究尚未见报道。本研究从颠茄中克隆到2条ADC基因,并进行了生物信息学分析、组织表达谱分析及盐胁迫和低温处理诱导表达分析,旨在为AbADC的进一步研究奠定基础,同时也为颠茄中托品烷类生物碱的合成代谢调控提供候选基因。
1 材料与试剂 1.1 材料样品由西南大学博士生导师廖志华教授鉴定为颠茄Atropa belladonna L.,植株保存于西南大学甘薯研究中心。大肠杆菌DH5α来源于复旦大学唐克轩教授实验室,现由本实验室保存。
1.2 试剂总RNA提取试剂盒为RNA simple Total RNA Kit(TIANGEN);RNA反转录及3’RACE试剂盒为RNA PCR Kit(AMV)Ver.3.0(TaKaRa);5’RACE试剂盒为BD SMARTTM RACE cDNA Amplification Kit,BD AdvantageTM 2 PCRKit(CLONTECH);质粒提取及胶回收试剂盒为BioSpin Gel Extraction Kit、BioSpin plasmid DNA Extraction Kit(BioFlux);高保真Taq DNA聚合酶为PrimeSTAR HS DNA Polimerse(TaKaRa);T载体、连接试剂盒、荧光定量相关试剂分别为pMD19-T Vector、DNA Ligation 2.0、PrimerScipt TM RT-PCR Kit和SYBR® Premix Ex TaqTM Ⅱ(Perfect Real Time)(TaKaRa)。本研究所用引物及测序服务由上海英骏生物技术有限公司提供。其他试剂均为国产分析纯试剂。
2 方法 2.1 RNA的提取与cDNA的合成取适量颠茄样品在液氮中研磨,按照RNA simple Total RNA Kit说明书提取总RNA,HITACHI U-3010紫外可见分光光度计检测RNA纯度和浓度。严格按照RNA PCR Kit(AMV)Ver.3.0(TaKaRa)试剂盒说明书反转录获得第一链互补链DNA(cDNA)用于核心片段PCR扩增和3’RACE,按照BD SMARTTM RACE cDNA Amplification Kit和BD AdvantageTM 2 PCR Kit(CLONTECH)试剂盒说明书反转录获得第一链互补链DNA(cDNA)用于5’RACE。
2.2 AbADC1和AbADC2基因的克隆在NCBI网站上下载已报道的烟草、曼陀罗、大豆、马铃薯ADC基因的cDNA序列。使用软件Vector NTI8.0进行ADC核苷酸序列的多重比对,根据保守区段的核苷酸序列设计一对简并引物F-AbADC、R-AbADC(本研究所有引物序列均见表 1),以上述第一条cDNA链为模板进行AbADC核心片段的扩增。PCR产物经1%琼脂糖凝胶电泳和紫外检测后,回收合适大小的DNA条带。胶回收产物与PMD19-T载体连接,转化大肠杆菌DH5α感受态细胞,涂布于加有氨苄霉素的LB平板上,37 ℃培养约12 h后挑取抗性菌落,PCR检测为阳性后送测序。根据测序结果,分别设计3’RACE的基因特异性引物(F-AbADC1-3-1、F-AbADC1-3-2、F-AbADC2-3-1、F-AbADC2-3-2)和5’RACE的基因特异性引物(R-AbADC1-5-1、R-AbADC1-5-2、R-AbADC2-5-1、R-AbADC2-5-2),以相应的cDNA为模板进行巢式PCR扩增,同上方法回收并测序。将获得的AbADC1、AbADC2的核心片段,3’RACE序列和5’RACE序列在VectorNTI8.0软件中进行电子拼接,拼接后获得AbADC1、AbADC2的电子拼接cDNA全长序列。根据电子全长序列设计扩增AbADC1、AbADC2的物理全长的PCR引物(F-AbADC1、R-AbADC1、F-AbADC2、R-AbADC2),进行PCR扩增。回收合适大小的电泳条带,连接T载体后转化大肠杆菌,对PCR检查为阳性的克隆进行测序。将测序结果在NCBI上进行BLAST比对,判断其序列为AbADC1、AbADC2的物理全长序列。
|
|
表 1 基因克隆和荧光定量PCR所用到的引物 Table 1 Primers designed for detection of gene cloning and real-time PCR |
2.3 AbADC基因的生物信息学分析
利用生物信息学软件和生物信息学网站进行AbADC1、AbADC2的生物信息学分析。核苷酸序列比对使用Vector NTI8.0 软件进行。开放阅读框(ORF)的查找和核苷酸的翻译在http://www.ncbi.nlm.nih.gov网站的ORF Finder上进行。利用http://www.expasy.org网站提供的相关生物信息学分析软件(如TargetP)进行蛋白质基本性质及转运肽的预测。在PBIL网站进行二级结构预测。利用CLUXTALX进行氨基酸序列的多重比对。在CCD数据库和InterPro中分析蛋白保守结构域。利用WOLF POSRT网络服务器对AbADC1和AbADC2进行亚细胞定位分析。利用MEGA4.1中的邻位相联法(neighbor-joining,NJ)构建进化树,重复次数设为1 000次。
2.4 AbADC基因的组织表达谱分析提取颠茄的主根、须根、老叶、嫩叶、嫩茎、花蕾、花蕊、花萼、花瓣、青果和果萼11个部位的总RNA,使用RNA PCR Kit(AMV)Ver.3.0(TaKaRa)试剂盒将各组织的RNA进行反转录,得到cDNA第一链作为实时定量PCR(qRT-PCR)模板。使用BIO-RAD IQTM5 Multicolor Real-Time PCR仪,参照SYBRR Premix Ex TaqTM Ⅱ(Perfect Real Time)试剂盒说明书进行qRT-PCR反应。反应条件及程序均按照相关试剂盒说明书进行。以PGK基因作为内参,根据Pfaffl Method方法计算各基因的相对表达量。
2.5 AbADC基因的诱导谱分析取3根3~5 cm长的颠茄发根尖接种于150 mL MS液体培养基中,25 ℃、110 r/min,摇床黑暗培养30 d后,收取发根材料作为空白对照,其余培养瓶倒掉先前的MS培养基,重新加入150 mL MS培养基。NaCl诱导项:培养基中加入NaCl使其终浓度为100 mmol/L,继续置于25 ℃,转速为110 r/min的摇床上培养;4 ℃诱导项:将换培养基后的三角瓶放置在4 ℃培养;所有诱导项分别在诱导0、4、12、24 h后取材,应用qRT-PCR技术分别检测AbADC1和AbADC2的表达情况。
3 结果与分析 3.1 AbADC基因的克隆和序列分析以颠茄总RNA逆转录获得的cDNA为模板,利用兼并引物进行AbADC保守结构的PCR扩增,成功获得一段约1 226 bp和一段约1 232 bp的核心片段,分别命名为AbADC1和AbADC2。根据获得的AbADC核心片段信息,设计3’RACE和5’RACE巢式引物,用于AbADC基因3’端和5’端序列的克隆。经过2轮巢式扩增,由AbADC1核心片段获得长度分别为437 bp的3’端和630 bp的5’端片段,由AbADC2核心片段获得长度分别为837 bp的3’端和719 bp的5’端片段,将获得的核心、3’端和5’端序列在Vector NTI 8.0软件中进行重叠群分析,拼接得到2 817 bp的ADC1和2 992 bp的AbADC2基因cDNA电子全长序列。设计物理全长引物并利用高保真酶进行PCR扩增,得到AbADC1基因cDNA全长序列为2 817 bp,该物理全长包括长约2 136 bp的编码框,预测编码712个氨基酸;得到的AbADC2基因全长序列为2 992 bp,该物理全长包括2 145 bp的编码框,预测编码715个氨基酸。
3.2 AbADC基因编码蛋白的生物信息学分析 3.2.1 理化性质分析AbADC1蛋白由712个氨基酸编码,预测相对分子质量为77 600,理论等电点为4.94;AbADC2蛋白由715个氨基酸编码,预测相对分子质量为76 700,理论等电点为4.93。
3.2.2 AbADC编码蛋白二级结构预测PBIL网站预测AbADC1编码蛋白包含36.52%的α-螺旋、16.15%的延伸链和47.33%的无规卷曲;AbADC2编码蛋白包含35.38%的α-螺旋、17.34%的延伸链和47.27%的无规卷曲。
3.2.3 AbADC氨基酸序列与保守结构域分析用NCBI网站的BLAST服务器对AbADC1和AbADC2氨基酸序列和保守结构域进行分析(图 1)。结果表明,AbADC1氨基酸序列与马铃薯Solanum tuberosum L.(XP_006360614)的ADC序列一致性最高,为89%,其次为烟草Nicotiana tabacum L.(BAD06581),一致性为87%;AbADC2的氨基酸序列与曼陀罗Datura stramonium L.(AJ251898)的ADC序列一致性最高,达到90%,其次为马铃薯(XP_006359602.1)的ADC,一致性为87%。结构域预测发现AbADC包括2个保守的氨基酸结构域:ADC家族2磷酸吡哆醛结合位点和ADC家族2标记2序列[7],分别负责结合吡哆醛磷酸盐和甲基丙烯酸十二氟庚酸(DFMA)的赖氨酸、半胱氨酸残基。

|
图 1 来自不同植物的ADC氨基酸序列多重比对 Fig.1 Multi-alignment of amino acid sequences of ADC from other plants |
3.2.4 AbADC编码蛋白信号肽和亚细胞定位预测分析
利用Signal 4.1 Server网络服务器对AbADC1和AbADC2进行信号肽分析,AbADC1和AbADC2都不存在信号肽,属于胞质蛋白。利用WOLF POSRT网络服务器对AbADC1和AbADC2进行亚细胞定位分析,AbADC1主要定位于细胞质,AbADC2主要定位于细胞质膜。
3.2.5 AbADC分子进化树的构建将AbADC1和AbADC2蛋白的氨基酸序列与来源于其他植物和大肠杆菌的ADC蛋白氨基酸序列在CLUSTALK和MEGA4.1软件中进行进化树分析,以大肠杆菌的ADC作为系统树的外类群基于NJ的原理建树(图 2)。系统树可以分为2个主要分支,第一个主分支包括水稻和燕麦的单子叶序列;第二个分支包括茄科、十字花科和蔷薇科为代表的双子叶序列。由进化树可知AbADC1与番茄的ADC亲缘关系较近,而AbADC2与曼陀罗的ADC的亲缘关系较近。

|
图 2 基于MEGA4.1软件平台用NJ方法构建AbADC分子进化树 Fig.2 Phylogenetic tree of AbADC from different organisms constructed by NJ method on MEGA 4.1 |
3.3 AbADC基因的组织表达和诱导表达分析
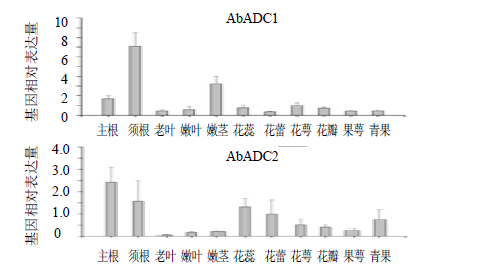
采用qRT-PCR技术对AbADC在颠茄花、叶、须根和主根等组织中的表达情况进行了分析,采用PGK作为内参基因(引物序列见表 1)。结果表明,AbADC1在须根中表达量最高,其次为主根和嫩茎(图 3);AbADC2在主根中表达量最高,其次为须根、花蕊、花蕾和青果(图 3)。
|
图 3 AbADC1和AbADC2在不同组织中的表达分析 Fig.3 Tissue-expression analyses of AbADC1 and AbADC2 using real-time PCR |
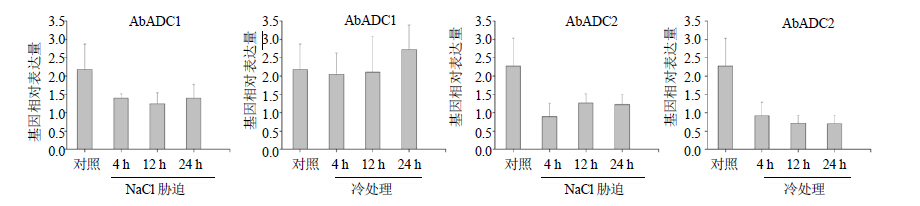
将黑暗培养1个月的发根分别进行盐胁迫处理(100 mmol/L NaCl)和4 ℃冷处理,qRT-PCR检测结果显示,在NaCl处理项中相比于对照组,AbADC1和AbADC2表达量在各时间点都有所降低,但无显著性的变化(图 4)。在4 ℃冷处理项,AbADC1表达量基本无变化;AbADC2在4、12、24 h 3个时间点的基因表达量都显著的降低(图 4)。
|
图 4 不同处理下AbADC1和AbADC2基因表达 Fig.4 Expression of AbADC1 and AbADC2 in hair roots with different treatments |
4 讨论
ADC是多胺合成途径上的一个关键酶,其催化产物腐胺也是尼古丁和托品烷类生物碱生物合成的前体物质。本实验采用RACE技术获得了颠茄中的2个ADC基因AbADC1和AbADC2,蛋白质结构域分析表明AbADC属于磷酸吡哆醛依赖性酶(PLPDE)家族Ⅲ型PLPDE亚家族成员,具有2个保守结构,ADC家族2磷酸吡哆醛结合位点和ADC家族2标记2序列,这2个保守的功能域在所有原核和真核生物中普遍存在。
组织表达谱显示AbADC1主要在须根中表达,AbADC2主要在主根中表达,AbADC1和AbADC2在茎和叶片中的表达量都较低,这与已经报道[7]的其他物种中同源基因的表达模式并不相同。在棉花中,ADC在叶片组织中的表达量远远高于根部和茎部,且在所检测的3个组织中根中的表达量最低[7];在桃树中,ADC在根和老叶中表达量最低而在嫩枝和幼嫩叶片中的表达高于花和茎[9];在拟南芥中,AtADC1为组成性表达,AtADC1仅在莲座叶和角果中表达,并对多种非生物胁迫有响应[12];在芥菜中,ADC主要在根和茎中表达,在叶片中几乎不表达[13]。托品烷类生物碱主要在根部合成,预示着颠茄ADC与生物碱的合成有一定的关系,也说明同源蛋白间组织表达的差异,可能与其参与的功能相关。
许多植物的ADC表达量会受不同诱导因素的影响,本研究中,仅AbADC2在冷处理后表达量出现下调,在盐胁迫下均略有降低;AbADC1的表达量在2种处理中均无显著变化,这与该基因在黄瓜[14]、森林草莓[15]、拟南芥[16]和芥菜[13]等植物中的表达情况并不相同。在低温处理的黄瓜幼苗中,ADC活性有一定的提高。冷、盐胁迫后的森林草莓中,FvADC表达量均出现上调。拟南芥ADC1在受到盐胁迫后基因表达量显著提高,而ADC2并无明显变化。同样,受盐胁迫后的芥菜中,ADC3表达量也显著提高,但是ADC1和ADC2表达量并无变化。根据本实验的结果,AbADC2是低温胁迫响应基因,而AbADC1和AbADC2都不是盐胁迫响应基因,推测颠茄中可能还存在另外一条或多条ADC基因,其表达受盐胁迫响应。此外,AbADC1和AbADC2是否对颠茄中生物碱的合成有重要影响还有待进一步研究。在后期的工作中,将分别构建AbADC的超表达和干扰载体,并导入颠茄获得转基因发根和植株,在代谢水平上进一步研究AbADC的功能及其对TAs生物合成的影响。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | Kanegae T, Kajiya H, Amano Y, et al. Species-dependent expression of the hyoscyamine 6-beta-hydroxylase Gene in the Pericycle[J]. Plant Physiol , 1994, 105 (2) :483–490. |
| [3] | Oksman-Caldentey K M, Arroo R. Regulation of tropane alkaloid metabolism in plants and plant cell cultures[A]//Verpoorte R, Alfermann A W. Metabolic Engineering of Plant Secondary Metabolism[M]. Kluwer:Dortrecht, 2000. |
| [4] | Jaber-Vazdekis N, Barres M L, Ravelo A G, et al. Effects of elicitors on tropane alkaloids and gene expression in atropa baetica transgenic hairy roots[J]. J Nat Prod , 2008, 71 :2026–2031. |
| [5] | Saowarath J, Heidi K, Delphine C, et al. Structural modeling and environmental regulation of arginine decarboxylase in Synechocystis sp.PCC 6803[J]. Archiv Microbiol , 2006, 184 :397–406. |
| [6] | Sandmeier E, Hale T I, Christen P. Multiple evolutionary origin of pyridoxal-5-phosphate-dependent aminoacid decarboxylases[J]. Eur J Biochem , 1994, 221 (3) :997–1002. |
| [7] | 李亚栋, 默辉娟, 王省芬, 等. 棉花精氨酸脱羧酶基因GhADC1克隆与表达分析[J]. 棉花学报 , 2013, 25 (4) :291–299. |
| [8] | 洪林, 闫晓红, 袁亚宾, 等. 甘蓝型油菜BnADC基因的克隆及原核表达[J]. 中国油料作物学报 , 2012, 34 (1) :8–15. |
| [9] | Liu J H, Yusuke B, Wen X P, et al. Molecular cloning and expression analysis of an arginine decarboxylase gene from peach (Prunus persica)[J]. Gene , 2009, 429 :10–17. |
| [10] | Hummel I, Gouesbet G, Amrani A E, et al. Characterization of the two arginine decarboxylase (polyamine biosynthesis) paralogues of the endemic subantarctic cruciferous species Pringlea antiscorbutica and analysis of their differential expression during development and response to environmental stress[J]. Gene , 2004, 342 :199–209. |
| [11] | Akiyama T, Jin S. Molecular cloning and characterization of an arginine decarboxylase gene up-regulated by chilling stress in rice seedlings[J]. J Plant Physiol , 2007, 64 :645–654. |
| [12] | Urano K, Yoshiba Y, Nanjo T, et al. Characterization of Arabidopsis genes involved in biosynthesis of polyamines in abiotie stress responses and developmental stages[J]. Plant Cell Environ , 2003, 26 (11) :1917–1926. |
| [13] | Mo H, Pua E C. Up-regulation of arginine decarboxylase gene expression and accumulation of polyamines in mustard (Brassica juncea) in response to stress[J]. Physiol Plant , 2002, 114 (3) :439–449. |
| [14] | Shen W Y, Kazuyoshi N, Shoji T. Involvement of polyamines in the chilling tolerance of Cucumber cultivars[J]. Plant Physiol , 2000, 124 (1) :431–439. |
| [15] | 王静, 赵密珍, 王壮伟, 等. 森林草莓精氨酸脱羧酶基因的电子克隆与序列分析[J]. 江苏农业学报 , 2011, 27 (3) :628–633. |
| [16] | Urano K, Yoshiba Y, Nanjo T, et al. Arabidopsis stress-inducible gene for arginine decarboxylase AtADC2 is required for accumulation of putrescine in salt tolerance[J]. Biochem Biophys Res Comm , 2004, 313 :369–375. |
 2016, Vol. 47
2016, Vol. 47


