近年来,医药市场出现当归的掺假、掺伪现象,如一些当归属植物的根在干燥或切片后冒充当归使用[2],严重影响当归质量,并且《中国药典》2015年版中仅以阿魏酸作为单指标成分来评价当归质量,这种借鉴化学药品的质量控制模式,目前来说是切实可行、操作性强、相对有效的,但也存在很大的弊端。这实际上是将中药简单化,被监测的指标成分并未被证明就是其真正起疗效的药效成分。
中药质量评价的最终目的是保证药品的临床疗效,而只有能被机体吸收、能分布到作用靶点、能参与机体代谢的成分才是真正起到治疗作用的成分,也是需要控制的成分[3]。对于中药而言,其疗效是中药中多个功能组分的整体表现,是多成分协同作用的结果。因此,以疗效为核心,将质量评价与多成分体内代谢相结合,建立“质代关联”的中药质量评价方法,是中药质量评价研究的新思路[4-5]。
中药传统用药方式产生疗效的过程是中药饮片中的化学成分水煎煮后进入提取液,口服后通过胃肠道代谢和吸收进入肝脏,再通过肝脏代谢后进入血液循环系统中运载到全身的相关组织产生药理作用。本研究以当归水提物为研究对象,采用大鼠体内实验,借助高效液相色谱仪,对当归多成分吸收代谢的全过程开展系统的研究。通过比较不同阶段可检出成分谱中代表化学成分色谱峰信息,揭示当归药效物质基础的多成分动态变化过程,为当归药材质控成分的筛选提供合理的实验依据。
1 材料 1.1 实验动物SPF级健康雄性SD大鼠,6周龄,体质量(300±40)g,北京斯贝福实验动物科技有限公司提供,许可证号SCXK(京)2015-0004。饲养于符合国家标准的屏障环境中,室温22~24 ℃,相对湿度60%。实验前适应性喂养大鼠1周以上,自由饮水和进食。
1.2 药材与试剂当归饮片(购于北京同仁堂药店)经北京中医药大学王晶娟副教授鉴定为伞形科植物当归Angelica sinensis (Oliv.) Diels. 的干燥根;甲醇(色谱纯,美国Fisher 公司);纯净水;其余试剂均为分析纯。
1.3 仪器高效液相色谱仪(Agilent 1260,安捷伦科技有限公司);1-15 PK离心机(德国西格玛公司);BT-100-1F蠕动泵(保定兰格恒流泵有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);HH-2恒温水浴锅(江苏省金坛市晨阳电子仪器厂);FE20 pH酸度计(梅特勒-托利多仪器上海有限公司);制氧机(氧立得,北京市皓月楼工贸有限责任公司);CM-12水浴氮吹仪(北京成萌伟业科技有限公司);QL-901涡旋振荡器(海门市其林贝尔仪器制造有限公司)。
2 方法 2.1 溶液的制备 2.1.1 Krebs-Ringer’s(K-R)营养液配制称取7.80 g NaCl、0.35 g KCl、0.37 g CaCl2、1.37 g NaHCO3、0.32 g NaH2PO4、0.02 g MgCl2、葡萄糖1.40 g,加蒸馏水定容至1 000 mL,调节pH值为7.39~7.41,放置备用。
2.1.2 供试品溶液的制备称取当归饮片50 g,置具有冷凝回流装置的圆底烧瓶中,用10倍量的去离子水回流提取3次,每次0.5 h,滤过,合并3次滤液并悬蒸浓缩,水浴至近半干,用配制好的K-R营养液定容至50 mL,放置,待用。
2.1.3 人工胃液的配制[6]取稀盐酸16.4 mL,加水约800 mL,与胃蛋白酶10 g,摇匀后,加水稀释成1 000 mL,即得。
2.1.4 人工肠液的配制[6]取磷酸二氢钾6.8 g,加水500 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10 g,加水适量使溶解,将两液混合后,加水稀释至1 000 mL,即得。
2.2 色谱条件采用色谱柱为依利特Hypersil C18 ODS-2(250 mm×4.6 mm,5 μm);流动相为1%甲酸水溶液(A)-甲醇(B);梯度洗脱:0~5 min,5%~10% B;5~10 min,10% B;10~25 min,10%~35% B;25~42 min,35%~65% B;体积流量1 mL/min;柱温30 ℃,双波长紫外检测器,检测波长270 nm,进样量10 μL。
2.3 多成分代谢 2.3.1 胃稳定性研究取50 mL人工胃液,37 ℃预温孵5 min后,加入1 mL供试品溶液,在37 ℃水浴情况下,不断轻微振摇使其混合均匀,人工胃液中温孵6 h,每隔1.5 h,即分别于0、1.5、3.0、4.5、6.0 h时间点取样6 mL,立即用0.1 mol/L的NaOH调pH值6~7,从而终止反应并用去离子水定容至10 mL,摇匀,过0.45 μm微孔滤膜滤过,取续滤液进样分析。
2.3.2 肠稳定性研究取50 mL人工肠液,37 ℃预温孵5 min后,加入1 mL供试品溶液,在37 ℃水浴情况下,不断轻微振摇使其混合均匀,人工肠液中温孵7.5 h,每隔1.5 h,即分别于0、1.5、3.0、4.5、6.0、7.5 h时间点取样6 mL,并立即用去离子水定容至10 mL,摇匀,过0.45 μm微孔滤膜滤过,取续滤液进样分析。
2.3.3 肠代谢研究5只SD大鼠禁食12 h,自由饮水,分为2组,4只为供血组,1只为实验组。5只大鼠全部ip水合氯醛麻醉,供血组腹主动脉取血,血液放于肝素化离心管并置于37 ℃水浴锅中保温,用于补充实验组大鼠手术过程中损失的血液。实验组大鼠颈静脉插管,管的另一端通过蠕动泵连接到从供血组取出的血液中。肠系膜静脉插管采血,沿其腹中线打开腹腔选取结肠段8 cm作为供试肠段,在肠段首末端事先系上丝线,用注射器将供试品溶液缓慢注入肠腔,当溶液到达肠段末端,用丝线结扎。用37 ℃生理盐水湿润过的纱布盖住裸露的肠段,保温板加热。开启蠕动泵给实验鼠供血,同时结扎门静脉,肠系膜静脉开始收集血液,实验持续1 h,收集的血样分2个时间段(0~30 min和30~60 min),分别放入肝素化的离心管中,4 000 r/min离心10 min,取上清液加入3倍量甲醇,涡旋2 min,10 000 r/min离心10 min,取上清液40 ℃氮吹浓缩至干,精密加1 mL甲醇溶解。过0.45 μm微孔滤膜,进行液相分析。
2.3.4 肝代谢研究1只SD大鼠,禁食12 h不禁水,待麻醉后打开腹腔,同样选取结肠段8 cm系上丝线,将供试品溶液封闭在结肠中,不需要供血,不结扎门静脉,1 h后腹主动脉采血约10 mL,样品处理同肠代谢实验。
3 结果 3.1 当归供试品溶液的HPLC图谱根据确定的色谱条件,分别对当归原水提物和溶解在K-R营养液中的供试品溶液进行液相分析,经对比发现K-R营养液不会对原水提物产生干扰峰,由于后续均是用更符合肠道环境的当归供试品溶液进行的实验研究,所以应首先确定当归供试品溶液的指纹图谱,如图 1所示,并标出有特征性的15个成分峰,其中峰C10、C12、C13经对照品指认分别为阿魏酸、洋川芎内酯I和洋川芎内酯H。
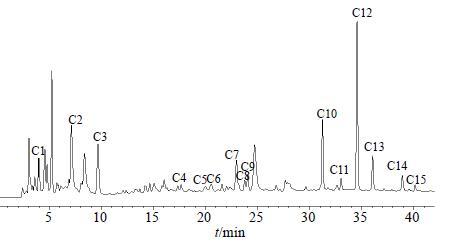
|
图 1 当归供试品溶液的HPLC图谱 Fig.1 HPLC of test solution of ASR |
3.2 胃肠道稳定性
由于胃肠道的酸碱物理环境及消化酶均有可能改变中药成分的结构,因此在进行肝代谢、肠代谢研究之前,应首先考察当归水提物口服经过消化道的多成分变化情况。以未温孵样品溶液(即0 h)色谱峰峰面积(A0)为参照,与温孵不同时间后的样品溶液色谱峰的峰面积(Ai)作比较,计算出不同时间点各成分的变化率(f,f=|Ai-A0-A0)。人工胃液和人工肠液中各成分变化率的最大值(fmax)及对应的时间见表 1。由表 1可知,成分C1和C5在人工胃液和人工肠液中的fmax均大于10%,成分C15在人工肠液中的fmax>10%,但其对应时间均在4.5 h之后。而药物在胃液中的滞留时间一般不超过2 h,肠道中滞留时间一般不超过4 h[7]。所以认为当归水提物中这15种成分在胃肠道中较稳定。
|
|
表 1 当归水提物在人工胃液中温孵6 h和在人工肠液中温孵 7.5h各色谱峰峰面积fmax及相应时间 Table 1 Maximum change rate and corresponding time of multicomponents in water extract from ASR decoction incubated for 6 h in artificial gastric juice and 7.5 h in artificial intestinal juice |
3.3 肠代谢
肠道在药物的全身代谢中具有重要的地位,其中肠道菌代谢是影响药物吸收的最为重要的过程,中药成分在肠道菌的作用下会发生水解、氧化、还原等生物转化[8]。由于菌群在整个肠道内的分布是不均匀的,研究发现结肠是肠道菌的主要存在部位[9],所以本实验选取结肠段作为受试肠段进行肠代谢研究。从图 2中可以看出,当归水提物中的大部分成分可通过肠道吸收入血,并在肠道菌和肠壁酶的作用下代谢生成了多种新成分。为使得实验结果具有可比性,以C12色谱峰(即洋川芎内酯I)作为参比峰,计算其他色谱峰与C12峰(洋川芎内酯I)的相对峰面积,来说明各成分的代谢情况。结果见表 2。
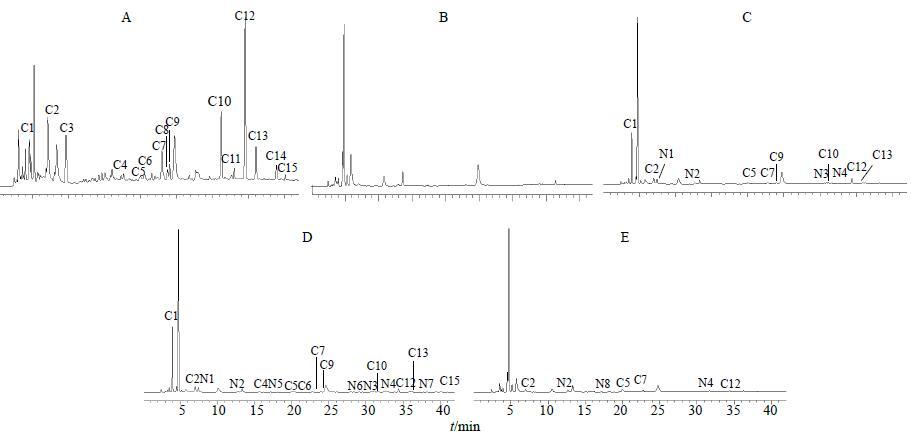
|
图 2 当归供试品溶液 (A)、空白血浆 (B)、肠代谢物 (0~30 min,C;30~60 min,D) 和肝代谢物 (E) 的HPLC图谱 Fig.2 HPLC of test solution of ASR (A),blank plasma (B),intestinal metabolite (0−30 min,C and 30−60 min,D) and liver metabolite (E) |
|
|
表 2 当归供试品、肠代谢物和肝代谢物中各色谱峰的相对峰面积 Table 2 Each relative peak area of test solution of ASR, intestinal metabolites,and liver metabolite |
从图 2和表 2中可以看出,成分C3、C8、C11、C14未在肠系膜静脉血中检测到,可能是由于在肠道发生了代谢,或是未被肠道吸收入血。成分C1的相对峰面积在肠代谢物血样中剧烈升高,这提示成分C1的渗透性可能比较好或同时也是某些成分代谢产物。通过肠代谢物1(0~30 min)和肠代谢物2(30~60 min)的对比可知,肠代谢物2中能检测到的成分明显增多,成分C4、C6、C15在肠代谢1中未检测到,而在肠代谢物2中均能检测到,说明药物在肠道吸收入血过程比较缓慢。并且肠代谢物2中除成分C6外,大部分成分的相对峰面积均有不同程度地增加,说明随着时间的延长,绝大多数成分的血药浓度有所升高。从结果还可以看出,药物通过肠道代谢共生成了7种新成分,这些成分在当归水提物和空白血浆中均未发现。其中前4种成分是肠代谢物1和肠代谢物2 中共有成分,新成分N5、N6、N7只在肠代谢物2中能检测到,是给药30 min后经肠代谢生成的新成分,说明其代谢过程比较缓慢。
3.4 肝代谢肝脏是外源性物质代谢最主要的器官[10]。口服药物在进入全身血液循环前都会经历肝代谢,其内含有丰富的I相代谢和II相代谢酶能使部分或全部成分发生生物转化,生成新的物质。
从图 2和表 2中可以看出,成分C3、C8、C11、C14也未能在肝代谢血样中检测到。成分C1、C4、C6、C9、C10、C13、C15在肠代谢物血样中能检测到,而在肝代谢血样中消失,并且经肠代谢生成的新成分N1、N3、N5、N6、N7再经肝脏后也未能检测到,说明这些成分在肝脏中发生了代谢。新成分N8只有在肝代谢血样中能检测到,说明是经过肝代谢新生成的产物。肝代谢血样中各成分的相对峰面积较肠道代谢血样中均有明显增大,说明这些成分可能也是肝代谢的产物。以上实验结果表明肝脏中拥有更丰富的代谢酶和更强的代谢能力。
综上可知,当归水提物中选出的15种特征成分中,只有成分C2、C5、C7、C12这4种成分能以原型经过肠道和肝脏吸收进入全身血液循环。同时在血液中检测出3种经过肠肝代谢生成的新成分。通过与对照品比对得知,洋川芎内酯I(即成分C12)能以原型形式吸收入血,阿魏酸(即成分C10)和洋川芎内酯H(即成分C13)均被肝脏代谢,不能以原型吸收入血。
3.5 代谢轮廓总结药物进入体循环前,要经过一个连续的吸收代谢过程,将胃肠液稳定性、肠代谢和肝代谢过程串联起来,重点研究4种以原型入血成分(C2、C5、C7、C12)的代谢变化过程。为了保证实验结果的可比性,利用公式进行归一化处理。结果见图 3。
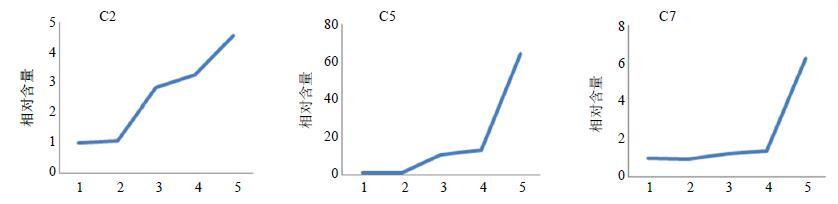
|
图 3 原型入血的3个成分沿消化道系统相对含量的变化情况 Fig.3 Changes of relative content of three prototype components into blood in digestive tract system |
相对含量=样品溶液相对峰面积/当归水提物相对峰面积
样品溶液相对峰面积为供试品溶液经过不同的代谢过程后血样中各成分相对于洋川芎内酯I内标成分的相对峰面积,当归水提物相对峰面积为当归水提物中各成分相对于洋川芎内酯I内标成分的相对峰面积
表 3综合分析了15个原型成分和8个代谢产物的可能代谢位点,可见当归在消化液中基本稳定,化学成分代谢主要发生在肠道和肝脏,尤其在肝脏中会经历严重的代谢反应。
|
|
表 3 当归水提物中各成分及代谢产物的可能代谢位点 Table 3 Possible metabolic sites of each component of water extract from ASR and its metabolite |
4 讨论
本实验以临床使用最广泛的水煎汤剂为研究对象,在最大量地掌握当归可检测成分的前提下,选取了当归水提物中的15种特征成分,且这些成分在人工胃液和人工肠液中均相对稳定。然后通过比较不同时间段肠系膜静脉血中成分、腹主动脉血中成分的HPLC化学成分特征谱,系统分析当归水提物多成分的代谢情况。
研究结果显示,在选定的15种成分中有4种成分可能被肠代谢,未能吸收入血,同时经肠代谢生成7种新成分,并且各成分在不同时间段的代谢程度不同,绝大多数成分在30 min以后的代谢程度明显增强,从而影响血药浓度。肝脏是最主要的代谢器官,大部分成分在肝脏中会发生比较严重的代谢反应。有7种原型成分和5种新成分均被肝代谢,1种新成分为肝代谢产物。其中阿魏酸也在肝脏中被代谢转化,但是这些未被吸收入血的成分是否能通过生成代谢产物产生药效,是否应将其作为质控成分有待于进一步研究。当归水提物成分在经历了复杂的吸收代谢后进入体循环的成分已与最初的成分差异较大。水提物中只有4种成分以原型吸收进入全身血液循环,其中一种成分被指认为洋川芎内酯I,其他成分的指认还需结合MS做进一步研究,这4种以原型被吸收入血的成分可以作为当归的质量控制成分。同时在腹主动脉血中还检测到3种新成分,其转化的原型成分有待于进一步研究。
本研究采用封闭肠循环法并行血液灌流技术探讨中药多成分体内动态代谢情况[11-12],同时采用化学成分指纹图谱技术全程检测对比分析多成分代谢过程,形象地反映出多成分体内吸收代谢轮廓,整个研究过程始终以体现药效为核心,将多成分药物代谢学术思想与中药鉴定学体系结合应用,开创一种流程化“质代关联”的方法学路线。该研究最终筛选出能吸收入血产生药效的质控成分,并阐明了当归药效物质基础的变化规律。
| [1] | 陈江弘, 杨崇仁. 当归属植物的研究进展[J]. 天然产物研究与开发 , 2004, 16 (4) :359–365. |
| [2] | 张春, 王晓丽, 朱桦. 中药当归及其混伪品的序列分析与鉴别[J]. 四川农业大学学报 , 2013, 29 (2) :218. |
| [3] | Wang L, Wang Z J, Wo S, et al. A bio-activity guided in vitro pharmacokinetic method to improve the quality control of Chinese medicines, application to SiWu Tang[J]. Int J Pharm , 2011, 406 (1/2) :99–105. |
| [4] | 王晶娟, 刘洋, 赵保胜, 等. 中药"质效代关联"研究方法与理论的建立[J]. 中草药 , 2014, 45 (11) :1507–1510. |
| [5] | 王晶娟, 刘洋, 赵保胜, 等. 质效代关联理论在道地药材质量研究中的应用分析[J]. 中草药 , 2015, 46 (2) :157–162. |
| [6] | 中国药典[S]. 一部. 2015. |
| [7] | 孙进. 口服药物吸收与转运[M]. 北京: 人民卫生出版社, 2006 . |
| [8] | 杨秀伟, 美荣, 服部征雄, 等. 中药成分代谢分析[M]. 北京: 中国医药科技出版社, 2003 . |
| [9] | Guarner F, Malagelada J R. Gut flora in health and disease[J]. Lancet , 2003, 361 (9356) :512–519. |
| [10] | Thummel K E, Kunze K L, Shen D D. Enzyme-catalyzed processes of first-pass hepatic and intestinal drug extraction[J]. Adv Drug Deliv Rev , 1997, 27 (2) :99–127. |
| [11] | Masaoka Y, Tanaka Y, Kataoka M, et al. Site of drug absorption after oral administration:Assessment of membrane permeability and luminal concentration of drugs in each segment of gastrointestinal tract[J]. Eur J Pharm Sci , 2006, 29 (3) :240–250. |
| [12] | 刘洋, 潘艳丽, 王晶娟, 等. 多成分药物代谢理论及技术方法分析[J]. 中草药 , 2014, 45 (12) :1663–1667. |
 2016, Vol. 47
2016, Vol. 47



