党参多糖(Codonopsis pilosula polysaccharides,CPPs)具有抗肿瘤活性[1-6],而其抗肿瘤活性与许多因素有关,如单糖组成、相对分子质量、溶解性、黏度及其空间结构。其中,单糖组成分析是多糖分子特性研究的重要内容[7]。目前关于党参多糖的提取分离及定量测定的文献报道较多[8-9],然而作为多糖的重要特性的单糖种类及其量与其抗肿瘤活性的相关性研究鲜有报道。基于此,收集来自甘肃省党参主要产区如渭源县、陇西县、文县、宕昌县、临洮县以及山西省陵川县、湖北省恩施县等地的26批党参样品,水提醇沉法提取其水溶性多糖,苯酚硫酸法测定总多糖,气相色谱(GC)法和间羟基联苯法测定多糖中半乳糖醛酸,糖腈乙酸酯衍生化法分析多糖中鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖及半乳糖的量,三甲基硅醚衍生化法测定多糖中果糖的量,MTT法检测党参多糖对肝癌HepG2细胞的细胞毒活性,采用聚类分析法对26批党参多糖进行聚类分析,以偏最小二乘法(PLS)分析不同党参多糖样品中鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸及果糖的量与HepG2细胞毒活性间的相关性,探 究各单糖组成对HepG2细胞毒活性的影响,可为党参多糖的构效关系研究提供理论支持,并进一步对其抗肿瘤机制研究提供参考。
1 材料 1.1 仪器与试剂中性单糖对照品葡萄糖(Glu,批号110833- 201205)、果糖(Fru,批号111504-200001)、半乳糖醛酸(GalA,批号111646-200301)、鼠李糖(Rha,批号111683-200401)、阿拉伯糖(Ara,批号111506-200001)、半乳糖(Gal,批号100226- 201105)、甘露糖(Man,批号140651-200602)、木糖(Xyl,批号111508-200404)、葡萄糖醛酸(GluA,批号140648-200602)均购自中国食品药品检定研究院;三氟乙酸(郑州阿尔法化工有限公司),盐酸羟胺(天津化学试剂厂),肌醇六乙酰酯(上海洽姆仪器科技有限公司),吡啶、乙酸酐(北京化工厂);NaBH4、732型阳离子交换树脂(国药集团化学试剂有限公司);Na2B4O7(天津市化学试剂三厂);DMEM高糖培养基[赛默飞世尔生物化学制品(北京)有限公司];胎牛血清(浙江天杭生物科技有限公司)。
分析天平[赛多利斯科学仪器(北京)有限公司];Shimadzu GC-2014气相色谱仪(Shimadzu,日本);Agilent 7890气相色谱仪-5977质谱检测器(Agilent,美国);LabServ CO150二氧化碳培养箱(Thermo Fisher Scientific,美国);Bio-Rad 680酶标仪(Bio-Rad,日本);凤凰牌倒置显微镜(江西凤凰光学控股有限公司)。
1.2 药材来源26批党参药材Codonopsis Radix(表 1)分别采集自甘肃省渭源县、陇西县、文县、宕昌县、漳县、临洮县以及山西省陵川县、湖北省恩施县等地,均经兰州大学药学院周印锁教授鉴定,鉴定结果:甘肃省文县各地党参均为纹党参,是桔梗科植物素花党参 Codonopsis pilosula Nannf. var. modesta (Nannf.) L. T. Shen的干燥根;甘肃省漳县、陇西县、宕昌县、临洮县、渭源县党参均为白条党参,是桔梗科植物党参Codonopsis pilosula (Franch.) Nannf. 的干燥根;山西省陵川县党参为潞党参,湖北省恩施县党参为板桥党参,均为桔梗科植物党参Codonopsis pilosula (Franch.) Nannf. 的干燥根,样品均为《中国药典》2015年版收载品种。
|
|
表 1 党参药材信息 Table 1 Information of Codonopsis Radix |
2 方法与结果 2.1 党参多糖样品的制备
党参药材清洗烘干后,粉碎,称取党参药材粗粉适量,以95%乙醇脱脂(回流2次,每次1 h),弃去醇提液,药渣干燥后,分别以12、10、8倍量水煎煮,每次40 min,合并水煎液并浓缩,加入95%乙醇至终体积分数为80%,静置过夜,弃去上清液,沉淀冷冻干燥,即得党参多糖,并按公式计算多糖得率,结果见表 2。
|
|
表 2 26批党参制得的多糖得率与质量分数 Table 2 Yield and content of CPPs from 26 batches of C. pilosula |
多糖得率=提取得到的党参多糖质量/党参药材质量
2.2 样品中多糖的测定 2.2.1 葡萄糖对照品溶液的配制精密称取经105 ℃干燥至恒定质量的无水葡萄糖对照品1.04 mg,置10 mL量瓶中,蒸馏水溶解并定容,摇匀,得0.104 mg/mL葡萄糖对照品溶液,4 ℃保存备用。
2.2.2 标准曲线的制备分别精密移取葡萄糖对照品溶液0、0.1、0.2、0.4、0.5、0.6、0.8、1.0 mL于试管中,加蒸馏水补至2.0 mL。加入5%苯酚溶液(称取5.07 g重蒸苯酚用蒸馏水定容于100 mL棕色量瓶中)1 mL,摇匀,迅速加入浓硫酸5 mL,摇匀,放置10 min。于100 ℃水浴中保温30 min,取出,于冷水中冷却至室温,于490 nm处测吸光度(A)值。以A值为纵坐标(Y),葡萄糖对照品质量浓度为横坐标(X),绘制得到标准曲线为Y=27.454 X-0.017 2(r=0.997 4)。
2.2.3 样品溶液的制备及测定分别精密称取干燥粗糖粉末12.00 mg加蒸馏水溶解并定容于25 mL量瓶中,配制成粗糖溶液。精密移取0.2 mL样品溶液,加水补至2.0 mL。按“2.2.2”项下方法,自“加入5%苯酚溶液1 mL”起,进行余下操作,测定A值,按照标准曲线计算样品中的多糖质量分数。结果见表 2。由结果可知,26批党参制得的多糖样品中多糖的质量分数均有不同,其中,26号党参样品制得多糖的质量分数最低,为25.12%;11号党参样品制得多糖的质量分数最高,为49.84%。
2.3 糖醛酸定量测定本实验采用GC法[10]及间羟基联苯法2种方法对26批党参多糖中糖醛酸的量进行测定。
2.3.1 GC法(1) GC条件:色谱柱OV-101(50 m×0.25 mm);进样体积2 μL;程序升温:160 ℃保留 4 min,以5 ℃/min升到190 ℃保留4 min,再以3 ℃/min升到210 ℃保留15 min,以10 ℃/min升到260 ℃保留5 min。
(2) 混合单糖对照品溶液的制备:精密称取葡萄糖、半乳糖、甘露糖、阿拉伯糖、木糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸对照品各20.00 mg,蒸馏水定容于10 mL量瓶中,摇匀,配制成混合单糖对照品溶液,4 ℃保存备用。
(3) 标准曲线的制备:依次分别精密移取混合单糖对照品溶液2.0、1.5、1.0、0.75、0.50、0.20 mL于6个2 mL量瓶中,蒸馏水定容,配成2.0、1.5、1.0、0.75、0.50、0.20 mg/mL的混合对照品溶液。分别从上述6个量瓶中,各精密移取1 mL,转移至6个10 mL圆底烧瓶中,分别将其旋干。加入78 μL 0.5 mol/L碳酸钠,于30 ℃保持45 min后,加入4% NaBH4溶液0.5 mL,室温放置1.5 h。滴加25%乙酸至不产生气泡为止以除去多余的NaBH4。溶液通过阳离子交换柱(732型阳离子交换树脂),以6 mL蒸馏水洗脱。蒸干洗脱液(45 ℃),加入甲醇3 mL,重复多次以除去硼酸盐。85 ℃真空加热2 h将糖醛酸转变为内酯。残渣溶于1 mL吡啶中,加入1 mL正丙胺,盖严后55 ℃加热30 min。冷却至45 ℃以下后再加热至55 ℃氮气吹干。残渣分别加入0.5 mL吡啶和0.5 mL乙酸酐,95 ℃加热1 h。冷却后,0.45 μm滤膜滤过,进行GC分析。混合单糖对照品衍生化后的色谱图见图 1,各单糖均得到较好地分离,建立半乳糖醛酸质量浓度(X)与各单糖衍生物峰面积(Y)的回归方程为Y=104 399X-6 236(r=0.996 1)。
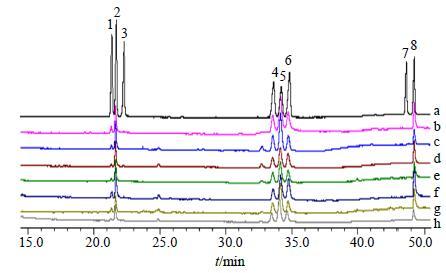
|
图 1 半乳糖醛酸定量测定GC图 Fig.1 Quantitative determination of galacturonic acid by GC |
(4)样品的制备及测定:精密称取党参多糖样品10 mg于特弗伦管中,加入2 mol/L三氟乙酸(TFA)2 mL,120 ℃水解3 h,冷却后,减压蒸干,加入甲醇1 mL,蒸干,重复3次,完全除去TFA。按“2.3.1(3)”项下方法操作,自“加入78 μL 0.5 mol/L碳酸钠”起,进行余下操作。结果如图 1所示,党参多糖样品中的各单糖均得到较好地分离,且党参多糖中均含有半乳糖醛酸,而不含有葡萄糖醛酸。将各样品中的半乳糖醛酸衍生物的峰面积代入回归方程,计算各党参多糖的半乳糖醛酸的量,结果见表 3。
|
|
表 3 26批党参多糖中各单糖质量分数 (x±s) Table 3 Contents of each monosaccharide in 26 batches of CPPs (x±s) |
2.3.2 间羟基联苯法
由“2.3.1”项下GC法测定糖醛酸种类及量的GC图可知,党参多糖只含有半乳糖醛酸,而不含有葡萄糖醛酸。因此,选择半乳糖醛酸为对照品,采用间羟基联苯法对上述GC法所测半乳糖醛酸的量进行验证。
(1) 半乳糖醛酸对照品溶液的制备:称取干燥的半乳糖醛酸对照品2.50 mg置5 mL量瓶中,用蒸馏水溶解并定容,摇匀,配成0.50 mg/mL半乳糖醛酸对照品溶液,4 ℃保存备用。
(2) 标准曲线的制备:取8支洁净试管,依次精密移取0、0.1、0.2、0.4、0.5、0.6、0.8、1.0 mL半乳糖醛酸对照品溶液,补加蒸馏水至1.0 mL。加入5 mL Na2B4O7-H2SO4溶液(1.19 g Na2B4O7用浓硫酸定容于250 mL量瓶),立即于漩涡混合器上混匀,煮沸5 min,冰水浴冷却。加100 μL 0.15%间羟基联苯(m-HDP)溶液(15 mg m-HDP溶于10 mL 0.5% NaOH溶液),混匀。30 min后于520 nm处测定A值。以A值为纵坐标(Y),半乳糖醛酸对照品质量浓度为横坐标(X),绘制得到标准曲线为Y=19.473 6 X+0.004 8(r=0.998 4)。
(3) 样品溶液的制备及测定:精密称取多糖5.00 mg,用蒸馏水定容于25 mL量瓶中。精密移取样品溶液1.0 mL,按“2.3.2(2)”项下方法,自“加入5 mL Na2B4O7-H2SO4溶液”起,进行余下操作,测定A值,并计算样品中半乳糖醛酸的量。结果见表 3。
将“2.3.1”项GC法所测半乳糖醛酸的量及“2.3.2”项间羟基联苯法所测半乳糖醛酸的量进行比较,由结果可知,2种方法所测结果差别不大,从而验证了所测半乳糖醛酸的量的准确性。
2.4 党参多糖的单糖组成分析糖腈乙酸酯衍生化法因具有衍生物制备简便、试剂易得及每种单糖能得到单一的色谱峰等优点而常被用于单糖的定性及定量分析,但酮糖(如果糖)因缺乏还原端而难以衍生,不适用于此法[11-12]。当测定含有酮糖和醛糖的样品时,可选用糖肟三甲基硅醚衍生化法,酮糖和醛糖均能得到较好的分离。但此法的缺点是由于各种单糖异构体的存在,造成色谱峰数目多于组分单糖的数目,从而导致混合物的定性定量分析复杂化[13]。基于此,本实验采用糖腈乙酸酯衍生化法测定党参多糖中鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖及半乳糖的量;同时,为了检验党参多糖是否含有果糖,采用糖肟三甲基硅醚衍生化法并利用GC-MS对党参多糖中果糖的量进行测定。
2.4.1 单糖组成及定量测定(1) GC条件:色谱柱OV-101(50 m×0.25 mm);进样体积2 μL;程序升温:以15 ℃/min从175 ℃升到190 ℃,保留5 min;再以5 ℃/min升到250 ℃,保留1.5 min。
(2) 混合单糖对照品溶液的制备:精密称取葡萄糖、半乳糖、甘露糖、阿拉伯糖、木糖、鼠李糖各100.00 mg,用吡啶定容于10 mL量瓶中,摇匀,得到混合单糖对照品溶液。
(3) 标准曲线的制备:分别精密移取混合单糖对照品溶液0.4、0.3、0.2、0.15、0.1、0.04 mL于6个2 mL量瓶中,分别加入1.0 mL内标肌醇六乙酰酯的吡啶溶液(精密称取内标肌醇六乙酰酯36.00 mg,用吡啶定容于5 mL量瓶中),用吡啶定容,配成2.0、1.5、1.0、0.75、0.50、0.20 mg/mL的混合单糖对照品溶液。将上述对照品溶液分别精密移取1 mL转移至6个10 mL圆底烧瓶中,分别加入10 mg盐酸羟胺后,封口,于90 ℃反应30 min,冷却至室温。加入0.5 mL乙酸酐,90 ℃反应30 min,减压蒸干,溶于1 mL氯仿中,即得混合单糖对照品的糖腈乙酸酯衍生物,0.45 μm滤膜滤过,进行GC分析,结果如图 2所示。每种单糖的糖腈乙酸酯衍生物在GC分析时都为单峰。以各标准单糖质量浓度与内标质量浓度比值为横坐标(X),单糖衍生物峰面积/内标衍生物峰面积的比值为纵坐标(Y),做回归方程,各单糖糖腈乙酸酯衍生物的回归方程如表 4所示。
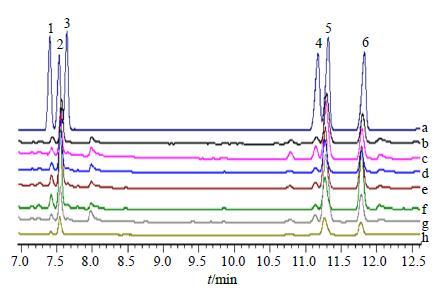
|
图 2 糖腈乙酸酯衍生物GC图 Fig.2 GCof aldononitrile acetate precolumn-derivative |
|
|
表 4 6种单糖糖腈乙酸酯衍生物的回归方程 Table 4 Regression equation of aldononitrile acetate precolumnderivatives of six monosaccharides |
(4) 样品的制备及测定:分别称取党参多糖10 mg于特弗伦管中,加入2 mol/L TFA 2 mL,120 ℃水解3 h。冷却后,减压蒸干。加入甲醇1 mL,蒸干,重复3次,完全除去TFA。再加入10 mg盐酸羟胺,加入0.5 mL内标肌醇六乙酰酯的吡啶溶液,封口。按“2.4.1”项下方法操作,自“于90 ℃反应30 min”起,进行余下操作,得到样品的糖腈乙酸酯衍生物,0.45 μm滤膜滤过,进行GC分析,结果如图 2所示。根据保留时间,可确定各党参多糖主要由阿拉伯糖、葡萄糖、半乳糖和少量鼠李糖、甘露糖及痕量木糖组成;将各单糖衍生物的峰面积/内标衍生物的峰面积的比值代入各回归方程,则可知各单糖的质量分数,如表 3所示,党参多糖各单糖的量均有所不同。
2.4.2 果糖定量测定(1) 色谱条件:色谱柱为HP-5MS毛细管柱(60 m×0.32 mm);进样体积1 μL;进样口、传输线和离子源温度均为250 ℃,柱温箱采用程序升温,起始温度140 ℃,2 ℃/min升温至198 ℃,保温4 min;4 ℃/min 升温至214 ℃,1 ℃/min 升温至217 ℃,保温4 min;5 ℃/min升温至250 ℃,保温18 min,载气体积流量1 mL/min,质谱扫描范围m/z 40~650。
(2) 混合单糖对照品溶液的制备:精密称取单糖对照品(葡萄糖、半乳糖、甘露糖、阿拉伯糖、木糖、鼠李糖、果糖)各20.00 mg,蒸馏水定容于10 mL量瓶中,摇匀,配制成混合单糖对照品溶液,4 ℃保存备用。
(3) 标准曲线的制备:依次分别精密移取混合单糖对照品溶液2.0、1.2、1.0、0.8、0.4、0.2 mL于6个5 mL量瓶中,蒸馏水定容,摇匀。依次从上述6个量瓶精密移取2.5 mL溶液转移至10 mL圆底烧瓶中,加热混悬均匀,60 ℃减压蒸干。加入0.5 mL 2.5%盐酸羟胺的吡啶溶液,封口后,于70 ℃烘箱中加热反应30 min,然后加入0.9 mL六甲基二硅胺烷和0.1 mL三氟乙酸,于100 ℃烘箱中加热反应60 min,即得标准单糖的三甲基硅醚衍生物,进行GC-MS分析,结果如图 3所示。各单糖均得到较好的分离,建立果糖质量浓度(X)与果糖衍生物峰面积(Y)的回归方程,线性方程为Y=3×106X+312 585(r=0.999 3)。
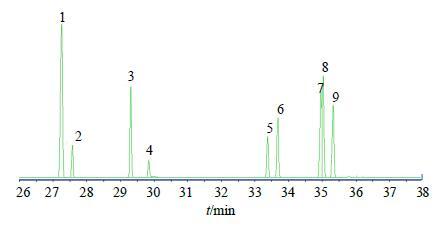
|
图 3 混合单糖对照品的三甲基硅醚衍生物GC图 Fig.3 GC of trimethylsilysated oxime of mixed mono saccharide reference substances |
(4) 样品的制备及测定:称取样品10.00 mg于特弗伦管中,加5 mL 2 mol/L TFA溶液,120 ℃水解2 h,水解液转入10 mL圆底烧瓶中减压蒸干,残余物按“2.4.2(3)”项下方法操作,自“加入0.5 mL 2.5%盐酸羟胺的吡啶溶液”起,制备水解后样品的三甲基硅醚衍生物。将生成物转入25 mL量瓶,用氯仿定容,并取1 mL稀释至10 mL,进行GC-MS分析,混合单糖对照品的GC-MS图见图 3,4号党参多糖水解后衍生物GC图见图 4。将各样品中的果糖衍生物峰面积代入方程,计算各党参多糖中果糖的量,如表 3所示。
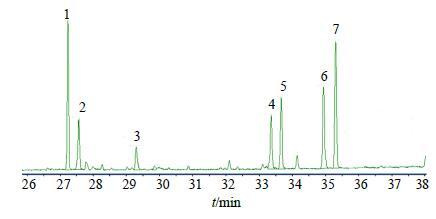
|
图 4 党参多糖酸水解后的三甲基硅醚衍生物GC图 Fig.4 GCof trimethylsilysated oxime after acid hydrolyzation of CPPs |
2.5 党参多糖对肝癌HepG2的细胞毒活性研究
取对数生长期的肝癌HepG2细胞(由兰州大学医学院提供)接种于96孔培养板内,每孔100 μL(约含5×103个细胞)。细胞贴壁后,加入100 μL各批用培养基配制的党参多糖(按照“2.1”项方法制备)溶液(经0.22 μm滤膜滤过),使其终质量浓度为200 μg/mL[3, 14],阳性药组给予相同体积的甲氨蝶呤(MTX)溶液,并使其终质量浓度为8 μg/mL[3],另设调零孔(只加200 μL培养基)、对照孔(只加100 μL细胞悬液和100 μL培养基),每组均设4个平行孔。37 ℃、5% CO2培养箱中培养48 h后,每孔加入5 mg/mL的MTT 20 μL,于CO2培养箱中继续培养4 h后,沿着培养液上部小心吸取上清液后,每孔加入150 μL DMSO,小心振荡10 min,利用酶标仪于570 nm处测A值,并计算细胞生长抑制率。
抑制率=1-(A实验组-A调零组)/(A对照组-A调零组)
结果如图 5所示,在相同的给药浓度下,各党参多糖的细胞毒活性均有所不同。其中,细胞毒活性最强者为8号党参多糖样品,其抑制率为36.36%,稍低于甲氨蝶呤阳性药组(抑制率为47.01%);细胞毒活性最低者为25号党参多糖样品,其抑制率为11.40%。
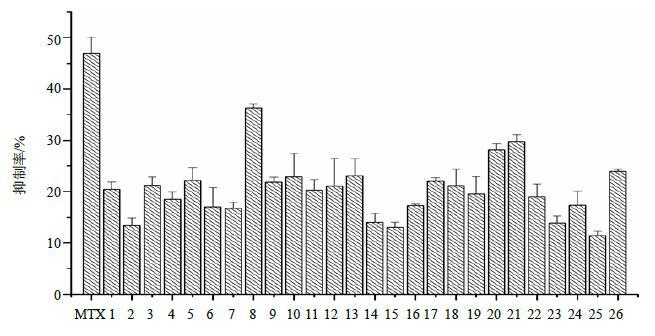
|
图 5 26批党参多糖细胞毒活性 Fig.5 Cytotoxic activities of 26 batches of CPPs |
2.6 聚类分析
利用SPSS 16.0软件,以党参多糖的单糖质量分数为指标,对26批不同党参进行聚类分析,结果如图 6所示。本实验中,1~7号及14~23号为白条党参,应分成一类;8~13号为素花党参,应分成一类;24~25号为潞党参,应分成一类;26号为板桥党参,应分成一类。结合聚类分析结果可知,党参多糖的单糖种类及质量分数不能作为党参分类的指标。
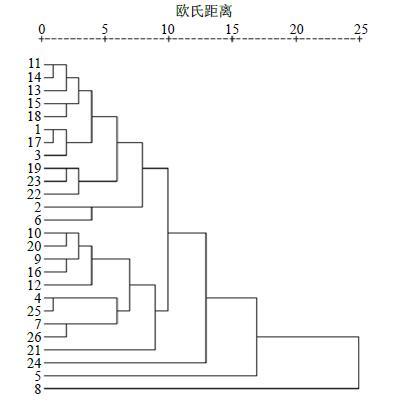
|
图 6 26批党参聚类分析结果 Fig.6 Cluster analysis of 26 batches of C. pilosula |
2.7 党参多糖的单糖组成与其对HepG2细胞毒活性的相关分析
由表 3及图 5可知,党参多糖主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸及果糖组成,但不同产地的党参多糖,其单糖的量及对HepG2细胞毒活性均有所不同。为明确单糖种类及量与HepG2细胞毒活性间是否有关联,利用Simca-p 11.5软件采用PLS分析法对党参多糖的单糖种类及量与其对HepG2细胞毒活性进行相关性分析,探讨两者的关系。
以党参多糖的单糖组成为独立变量(X),以党参多糖对HepG2肿瘤细胞的抑制率作为因变量(Y),采用PLS进行相关分析,得到各单糖的回归系数。其中系数绝对值反映单糖种类及量对HepG2细胞毒活性贡献的大小,回归系数绝对值越大,说明相关性越大;回归系数的符号反映单糖与HepG2细胞毒活性相关性(正相关或负相关)。拟合出党参多糖的单糖种类及量与HepG2细胞毒活性之间的回归方程为Y=0.124 XRha+0.325 XAra-0.098 XXyl-0.192 XMan-0.140 XGlu+0.050 XGal+0.482 XGalA+0.120 XFru。由此方程可知,各单糖对HepG2细胞毒活性的贡献大小为半乳糖醛酸>阿拉伯糖>甘露糖>葡萄糖>鼠李糖>果糖>木糖>半乳糖。其中,半乳糖醛酸、鼠李糖、阿拉伯糖、半乳糖、果糖与多糖样品对HepG2细胞毒活性呈正相关,木糖、甘露糖及葡萄糖与HepG2细胞毒活性呈负相关。
3 讨论Yang等[3]通过党参多糖的分离纯化获得了均一性的党参果胶多糖,而果胶多糖是一种杂多糖[15],按照其结构分类,果胶多糖主要包含3大类:半乳糖醛酸聚糖(HG)、鼠李半乳糖醛酸聚糖-I(RG-I)及鼠李半乳糖醛酸聚糖-II(RG-II)[16]。Zhang等[17]报道果胶多糖的抗肿瘤活性与Gal及RG-1的量有关,其量越多,多糖抗肿瘤活性越强;Gao等[18]发现人参果胶多糖的抗肿瘤活性并非只与GalA的量有关,Gal及Ara也可抑制肿瘤细胞的增殖。Fan等[19]证实人参果胶多糖抑制肿瘤细胞的增长与GalA的量HG及RG-I的量呈正相关。
26批党参多糖的单糖种类基本相同,但量差异很大,各多糖对HepG2细胞的细胞毒活性差异较大。分析测定的8种单糖中,半乳糖醛酸、鼠李糖、阿拉伯糖、半乳糖、果糖与HepG2细胞毒活性呈正相关,而甘露糖、木糖和葡萄糖与HepG2细胞毒活性呈负相关,而GalA对多糖的细胞毒活性贡献最大,此结果与上述文献所报道的结果相一致。8~13号党参多糖样品(主产区为文县)与其他样品相比半乳糖醛酸的量相对较高,细胞毒活性也相对较强。值得一提的是,尽管26批不同产地的党参多糖的单糖量差异较大,但并不能据此实现甘肃2种主要的党参品种——白条党参和素花党参的分类鉴别。
| [1] | Xu C, Liu Y, Yuan G X, et al. The contribution of side chains to antitumor activity of a polysaccharide from Codonopsis pilosula[J]. Int J Biol Macromol , 2012, 50 (4) :891–894. |
| [2] | 杨瑾, 刘杰书, 袁德培. 板桥党参多糖体内抗肿瘤活性实验研究[J]. 中国处方药 , 2014, 12 (3) :25–26. |
| [3] | Yang C X, Gou Y Q, Chen J Y, et al. Structural characterization and antitumor activity of a pectic polysaccharide from Codonopsis pilosula[J]. Carbohydr Polym , 2013, 98 (1) :886–895. |
| [4] | Xin T, Zhang F B, Jiang Q Y, et al. The inhibitory effect of a polysaccharide from Codonopsis pilosula on tumor growth and metastasis in vitro[J]. Int J Biol Macromol , 2012, 51 (5) :788–793. |
| [5] | 冯浩丽, 高建平. 党参多糖体内抗肿瘤活性研究及急性毒性实验[J]. 山西中医 , 2012, 28 (8) :49–50. |
| [6] | 杨丰榕, 李卓敏, 高建平. 党参多糖分离鉴定及体外抗肿瘤活性的研究[J]. 时珍国医国药 , 2011, 22 (12) :2876–2878. |
| [7] | 倪力军, 王媛媛, 何婉瑛, 等. 8种多糖的单糖组成、活性及其相关性分析[J]. 天津大学学报:自然科学与工程技术版 , 2014, 47 (4) :326–330. |
| [8] | He J Y, Ma N, Zhu S, et al. The genus Codonopsis (Campanulaceae):A review of phytochemistry, bioactivity and quality control[J]. J Nat Med , 2015, 69 (1) :1–21. |
| [9] | Sun Y X, Liu J C, Kennedy J F. Application of response surface methodology for optimization of polysaccharides production parameters from the roots of Codonopsis pilosula by a central composite design[J]. Carbohydr Polym , 2010, 80 (3) :949–953. |
| [10] | Jacob L. Simultaneous gas-liquid chromatographic determination of aldoses and alduronic acids[J]. J Chromatogr A , 1987, 408 (1) :245–253. |
| [11] | 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999 . |
| [12] | 付海宁, 赵峡, 于广利, 等. 盐藻多糖单糖组成分析的四种色谱方法比较[J]. 中国海洋药物杂志 , 2008, 27 (4) :30–34. |
| [13] | 宋叶涵, 李冬梅, 杨静峰, 等. 三种色谱法分析鲍鱼生殖腺多糖的单糖组成[J]. 食品与机械 , 2012, 28 (2) :44–47. |
| [14] | Chen W X, Gou Y Q, Li W, et al. Activation of intrinsic apoptotic signaling pathway in A549 cell by a pectin polysaccharide isolated from Codonopsis pilosula and its selenized derivative[J]. J Carbohydr Chem , 2015, 34 (8) :475–489. |
| [15] | 孙元琳, 汤坚. 果胶类多糖的研究进展[J]. 食品与机械 , 2004, 20 (6) :60–63. |
| [16] | 蔡为荣, 孙元琳, 汤坚. 果胶多糖结构与降血脂研究进展[J]. 食品科学 , 2010, 31 (5) :307–311. |
| [17] | Zhang W B, Xu P, Zhang H. Pectin in cancer therapy:A review[J]. Trends Food Sci Tech , 2015, 44 (2) :258–271. |
| [18] | Gao X G, Zhi Y, Sun L, et al. The inhibitory effects of a rhamnogalacturonan I (RG-I) domain from ginseng pectin on galectin-3 and its structure-activity relationship[J]. J Biol Chem , 2013, 288 (47) :33953–33965. |
| [19] | Fan Y Y, Cheng H R, Li S S, et al. Relationship of the inhibition of cell migration with the structure of ginseng pectic polysaccharides[J]. Carbohydr Polym , 2010, 81 (2) :340–347. |
 2016, Vol. 47
2016, Vol. 47



